
2023-10-26
单细胞测序(Single-cell sequencing)是指获取单个细胞遗传信息的测序技术,即在单个细胞水平上,对基因组或转录组进行提取扩增和高通量测序分析,在肿瘤、免疫、发育等多个应用领域都有巨大的应用潜力。生命活动是复杂的动态变化过程,单细胞技术有助于了解细胞生长或个体发育过程中基因的表达调控机制。今天我们就对近期发表的《Nature Communications》文章进行解析,看单细胞测序技术如何解析早期人类胰腺发育奥秘。
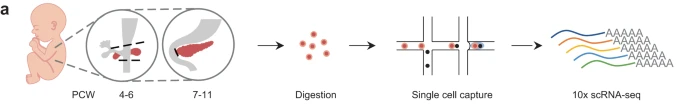
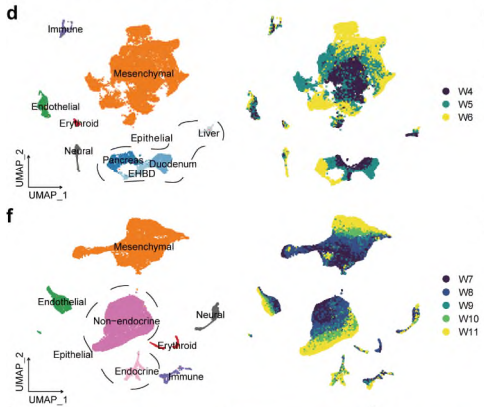
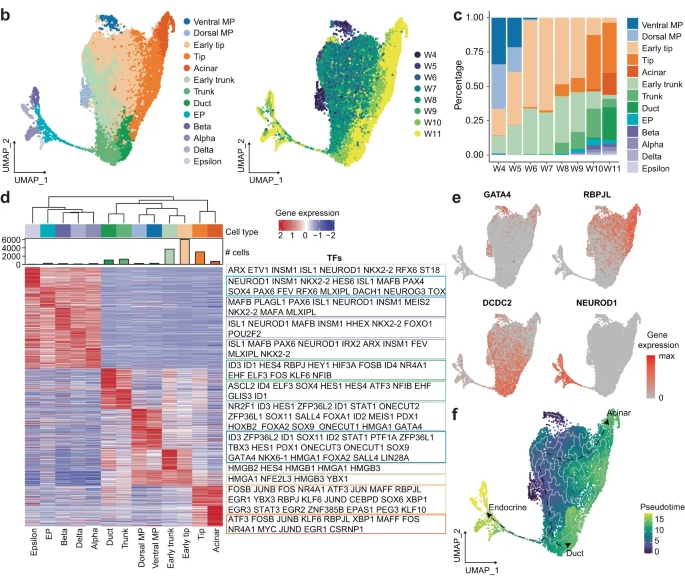
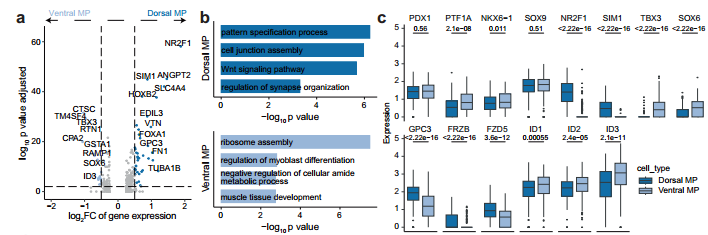
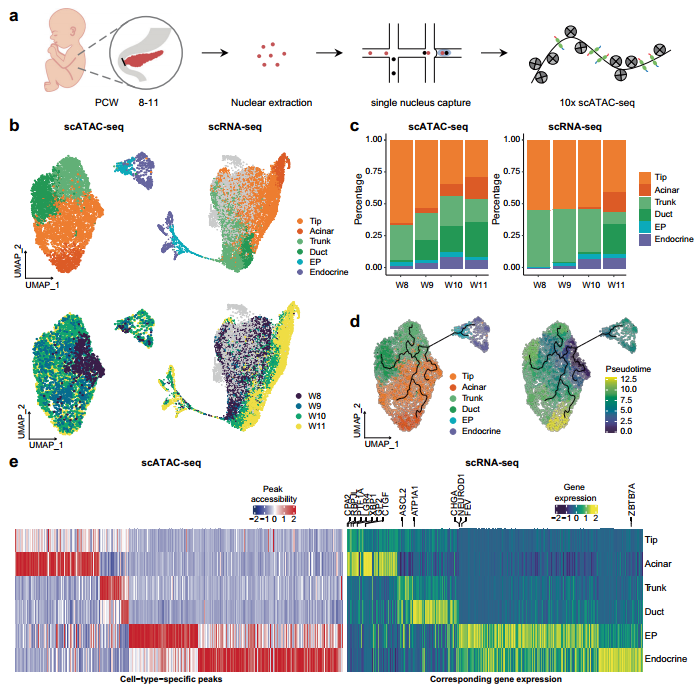
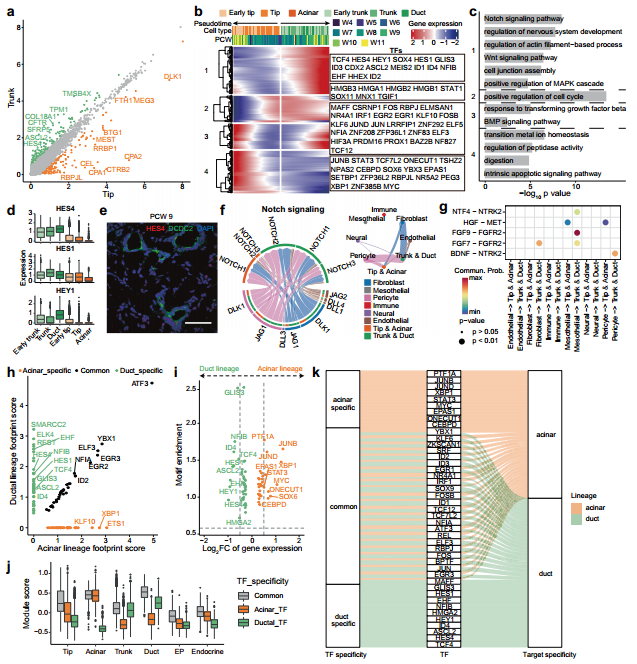
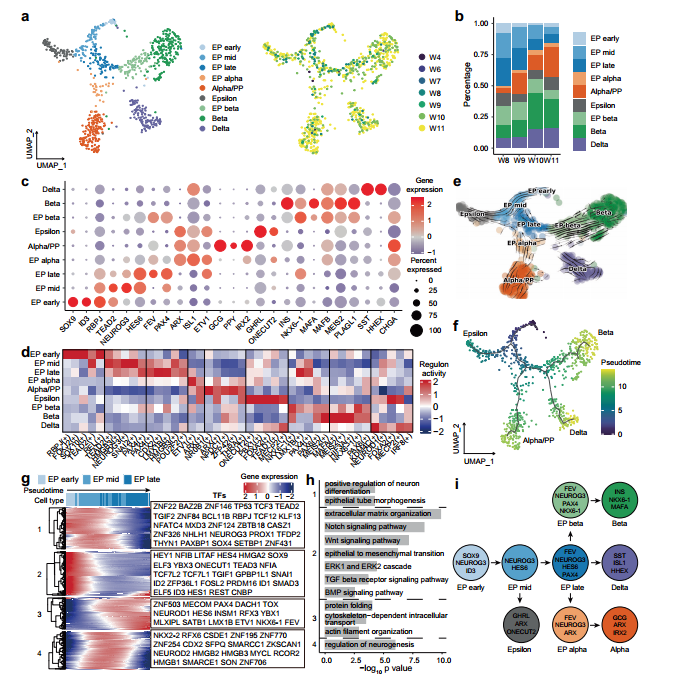
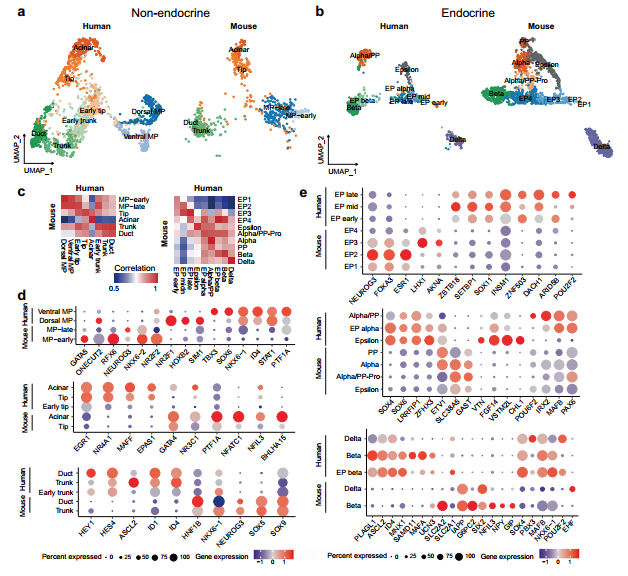
研究背景 胰腺是人体重要的消化和内分泌器官,主要负责体内营养物质的代谢。99%的胰腺上皮由外分泌组织组成,包括分泌消化酶的腺泡细胞和将这些酶运输到肠道的导管细胞。其余1%为内分泌组织,又称朗格汉斯胰岛,由α/β/δ/PP/ε细胞等5种不同的内分泌细胞组成,主要负责调节葡萄糖稳态。这些细胞的功能障碍导致各种疾病,如胰腺炎、胰腺癌和糖尿病。了解胰腺的胚胎发育,特别是细胞命运决定和内分泌细胞分化,有助于改进从人多能干细胞(hPSC)体外分化生成胰腺细胞的方案。 得益于强大的遗传工具和动物模型,先前的研究揭示了啮齿动物胰腺器官发生的重要分子事件。胰腺起源于背侧和腹侧内胚层区域,它们接受来自相邻组织的不同信号。这一过程在小鼠胚胎第8.5天和人类受孕后27-29天开始。腹侧胰腺的出现晚于背侧胰腺,它与肝脏和肝外胆管(EHBD)具有共同的祖细胞。两个胰芽含有多能祖细胞(MP, multipotent progenitor),可以分化成胰腺上皮的所有谱系细胞,并最终由于肠管旋转而融合形成单个器官。细胞增殖扩大胰腺上皮并重塑其形成分支管状结构。同时,MP细胞发育为尖端细胞(tip cells)和主干细胞(trunk cells),尖端细胞有可能进一步分化成腺泡细胞(acinar cells),而主干细胞具有双向分化为内分泌细胞(endocrine cells)和导管细胞(ductal cells)的能力。两种转录因子(TFs),促进尖端命运的PTF1A和诱导主干命运的NKX6-1是这一过程的主要调控因子。内分泌祖细胞(Endocrine progenitor, EP)受NEUROG3的调控,从主干结构域分层分化为内分泌细胞。受MAFA等特定因子调控的β细胞成熟是一个漫长的过程。虽然已经根据小鼠的研究得出了许多关于胰腺发育和体外分化方案的结论,但已经发现到人类和小鼠之间的存在着物种差异。例如,小鼠的内分泌分化有两个高峰,而人类只有一个阶段。 单细胞转录组测序(scRNA-seq)和单细胞染色质可及性测序(scATAC-seq)是研究发育生物学的有力工具。近期对小鼠和人类的研究揭示了单细胞分辨率下胎儿胰腺组织的细胞组成、分子异质性和分化发育轨迹。然而,由于人类胚胎样本的稀缺和从早期胚胎分离胰腺的困难,对人类早期胰腺发育的分子特征和调控网络知之甚少,特别是在受孕后8周之前。本研究对PCW 4-11收集的人胚胎胰腺组织进行了scRNA-seq,并对PCW 8-11收集的人胚胎胰腺组织进行了scATAC-seq,研究数据描绘了单细胞水平妊娠早期(PCW 4-11)胰腺器官发生的整个轨迹。 1、人类胰腺早期发育的细胞多样性 本研究对从PCW 4至11的8个时间点的17名捐赠者(包括6名男性和11名女性)收集的人类胚胎胰腺组织进行了scRNA-seq(图1a),共得到68714个高质量单细胞,注释出6种主要细胞类型,包括上皮细胞(EPCAM+)、间充质细胞(COL3A1+)、内皮细胞(PECAM1+)、神经细胞(ASCL1+)、免疫细胞(PTPRC+)和红系细胞(HBA1+)(图1d、1f),从PCW 7到11,间充质细胞的比例逐渐下降,上皮细胞和其他类细胞的比例增加(图1i)。 图1 实验设计和细胞图谱展示 2、早期人类胚胎胰腺上皮细胞的异质性 上皮细胞是胰腺的主要组成部分,执行胰腺的基本功能。本研究根据上皮细胞经典marker基因(EPCAM和PDX1)的表达,共鉴定了13个cluster,它们代表了胰腺早期发育中的所有上皮细胞谱系(图2b)。研究发现MP细胞仅存在于PCW 4和5中,在此阶段其数量存在逐渐减少的趋势。从PCW 4到PCW 7,早期尖端(early tip cells)和早期主干细胞(early trunk cells)数量逐渐增加。PCW10后出现导管细胞和腺泡细胞,PCW8后产生大量内分泌祖细胞(EP endocrine progenitor)和内分泌细胞(endocrine cells)(图2c)。此外,文章利用热图展示每个亚型top100的差异基因,并标注了关键的转录因子(图2d)。一些内分泌细胞表达高水平的内分泌激素,EP细胞表达高水平的NEUROG3,胰腺上皮细胞中内分泌细胞数量在PCW 4中可以忽略不计,在PCW 5-7中消失,而在PCW 8后逐渐增加,在PCW 10和11时达到峰值,提示胰腺上皮细胞在PCW 8后分化形成了大量的内分泌细胞。故接下来利用Monocle3构建了腺泡细胞、导管细胞和内分泌细胞的发育轨迹证实了推测(图2f),即背侧和腹侧的MP细胞分化为早期尖端细胞和主干细胞。然后,早期尖端细胞发育成尖端细胞和腺泡细胞,而早期主干细胞则发育成主干细胞和导管细胞。主干细胞是双潜能细胞,可分化成EP细胞和导管细胞。 图2 单细胞转录组测序鉴定了早期人类胚胎胰腺上皮中的主要细胞类型 3、背侧和腹侧多能祖细胞具有不同的表达模式 本研究对背侧和腹侧MP进行差异分析和功能富集分析,结果表明背侧MP细胞与Wnt信号传导、细胞连接组装和突触组织有关,而腹侧MP细胞则与核糖体组装、肌肉组织发育和成肌细胞分化有关(图3a、3b)。背侧和腹侧MP细胞都表达了常见的胰腺标记物,如PDX1、PTF1A 和 NKX6-1(图3c),Wnt信号传导相关的基因(GPC3, FRZB, FZD5 和LYPD6)在背侧MP细胞中高表达,而BMP信号传导靶向TF(ID1、ID2和ID3)在腹侧MP细胞中高表达(图3c)。这些结果表明,背侧和腹侧MP细胞在发育过程中接收到了不同的信号。 图3. 背侧和腹侧多能祖细胞对比 4、人类胰腺早期发育的染色质可及性图谱 为了解析驱动细胞命运分化和每个胰腺谱系持续分化的潜在基因调控过程,本研究对PCW 8-11的人类胚胎胰腺组织进行了scATAC-seq分析(图4a),共获得12288个高质量单细胞,鉴定出腺泡、导管以及内分泌谱系中的细胞类型,与scRNA-seq结果一致(图4b)。此外,本研究发现腺泡细胞、导管细胞、EP和内分泌细胞,在scATAC-seq数据中比在scRNA-seq中更早被识别出来,相应的标志区域似乎比mRNA更早被检测到,反应了在基因表达之前就已发生了基因调控(图4c)。拟时序分析发现,与在scRNA-seq中观察到的轨迹相似,反映了scRNA-seq和scATAC-seq图谱之间的高度一致性(图4d)。进一步比较细胞类型特异性peak以及对应基因的表达谱,发现在成熟的腺泡细胞和内分泌谱系细胞中有更明显的peak,这可能与其相对成熟的特性和逐渐获得更复杂的功能相关(图4e)。 图4. 人类胰腺早期发育的染色质可及性图谱 5、腺泡细胞和导管细胞发育过程中的细胞命运决定 胰腺上皮的主要细胞群由腺泡(尖端细胞)和导管(主干细胞)谱系组成,为了探索这两个谱系的细胞命运决定,本研究比较了它们的基因表达模式,发现HES4和RBPJL在早期尖端细胞和早期主干细胞中表达存在差异(图5a),以热图的形式展示了尖端细胞和主干细胞中不同分化方向分支基因的表达,并突出了TF(图5b)。分支基因的GO功能富集分析发现主干细胞和导管细胞激活了Notch、Wnt、MAPK通路、肌动蛋白、细胞连接和神经系统发育,而金属离子稳态、肽酶活性、消化和内在凋亡信号通路在尖端细胞和腺泡细胞中被活化(图5c)。本研究发现HES1和另一个Notch信号通路相关的TF HEY1在导管谱系细胞中高表达,这一发现表明Notch信号通路对于人类胰腺导管谱系细胞的分化至关重要(图5d)。为了表征尖端、主干细胞和支持细胞之间的信号通路关系,本研究将支持细胞分为6个亚型,包括成纤维细胞、间皮细胞、周细胞、免疫细胞、神经细胞和内皮细胞,细胞通讯分析发现细胞间通过Notch信号通路相互作用,主要涉及成纤维细胞和周细胞的DLK1和JAG1基因,以及主干细胞和导管细胞中的NOTCH1、NOTCH2和NOTCH3基因(图5f)。FGF信号通路对胰腺发育非常重要,研究发现FGFR2在主干细胞和导管细胞中高表达,其配体FGF7和FGF9在成纤维细胞和间皮细胞中表达(图5g)。此外,间皮细胞和导管谱系细胞之间存在NTF4-NTRK2相互作用,周细胞和导管谱系细胞之间存在BDNF-NTRK2相互作用。FGFR2和NTRK2参与MAPK级联反应酪氨酸激酶的受体。这些结果表明,Notch和MAPK信号通路促进了主干和导管细胞的分化。 为了构建调控细胞分化的基因调控网络(GRN),本研究整合了同一时间点的scRNA-seq和scATAC-seq的数据,确定了驱动腺泡和导管谱系发育的关键调控因子和相应的调控网络,有一组TF在细胞类型特异性peak中富集,还有一组TF在这两种谱系中都普遍富集(图5h),谱系特异性转录因子的motif富集与其表达水平一致(图5i),三组TF在scRNA-seq中的平均表达水平与其在scATAC-seq中的足迹富集一致(图5j),对于谱系常见的转录因子,GRN 分析表明,尽管在两个谱系中都观察到了丰富的足迹,但这些转录因子在两个谱系中具有不同的靶标。在腺泡谱系中,靶标包括各种酶和蛋白酶抑制剂,如CELA2A和SERPINA4;在导管谱系中,靶标是导管细胞的标记基因COL4A1、COL4A2和KRT17,以及其他导管谱系特异性的转录因子,例如 HES4 和 HES1(图5k)。 图5. 胰腺发育过程中腺泡和导管谱系细胞的比较 6、人类胰腺早期发育过程内分泌细胞的分子异质性 为了进一步研究内分泌细胞发育的分子机制,本研究对EPs和内分泌细胞进行聚类分析,共鉴定出5个表达Neurog3的EP细胞群和4个表达内分泌激素基因的内分泌细胞群,一些主干细胞标记物,包括SOX9和ID3,在EP早期细胞中表达,表明EP早期细胞在主干细胞和EP细胞的过渡状态中的作用(图6a、6c)。接下来,本研究重点分析了内分泌细胞中的TF,发现ARX和ETV1在EP α细胞中活性较高,NKX6-1和LMX1B在EP β细胞中活性较高(图6d)。内分泌细胞的拟时轨迹分析发现,EP早期细胞被认为是所有内分泌细胞的起点。epsilon细胞是EP中间细胞的一个分支。然后,EP晚期细胞首先分化为EP alpha细胞,然后分化为delta 和 EP beta细胞。最后,EP alpha细胞和EP beta细胞产生alpha和beta细胞(图6e、6f)。接下来将EP早期细胞、EP中间细胞和EP晚期细胞按照拟时间变化的基因聚成4个cluster,如Cluster-1基因,包括TEAD2、SOX4和NEUROG3,在EP早期和EP中期细胞中表达上调,对应的功能富集分析发现该基因参与了上皮管的形态发生和神经元分化(图6g、6h)。综上,本研究描绘了人类胰腺胚胎发育过程中EP和内分泌细胞的分化轨迹(图6i)。 图6. 胰腺中EP和内分泌细胞的转录异质性 7、人和小鼠胚胎胰腺上皮细胞的比较 为了确定人类和小鼠胚胎发育过程中主要胰腺上皮细胞类型的分子特征,本研究将胰腺数据集与两个已发表的E9.5至E17.5小鼠胚胎胰腺数据集进行了比较(其中E9.5至E17.5阶段对应于人类PCW 4至11),分别整合了非内分泌和内分泌细胞数据集(图7a、7b),发现人类背侧MP细胞与小鼠的早期MP细胞表达模式更为相似,此外,一些TF,包括GATA5、RFX6、NKX6-2和NEUROG3,仅在小鼠MP细胞中表达,而其他TF,包括NR2F1、TBX3和ID4,仅在人背侧或腹侧MP细胞中表达(图7d)。结果表明,尽管人类和小鼠的发育轨迹是保守的,但两个物种之间揭示了一些明显的特征,如不同的基因表达模式。 图7. 人和小鼠胚胎胰腺上皮细胞的比较

研究总结 本研究分析了胰腺上皮细胞的主要细胞类型,包括背侧和腹侧MP细胞,并揭示了它们的分子异质性和发育轨迹。分析了腺泡和导管谱系细胞的TFs、调控网络和信号通路,揭示了内分泌的调控网络以及EP和内分泌细胞的转录动力学。研究进一步比较了人类和小鼠之间的发育轨迹,并确定了每个物种的几个不同特征。综上所述,研究数据描绘了单细胞水平妊娠早期(PCW 4-11)胰腺发生的发育轨迹。本研究为人类胰腺早期发育的转录动力学提供了宝贵的资源,也为体外生成胰腺细胞提供了蓝图。