
2023-11-02
嵌合抗原受体(Chimeric Antigen Receptor,CAR)是指由胞外段(可结合抗原的单链抗体可变区),跨膜区域和胞内段(胞内信号传导结构域构成的重组跨膜分子,负责传递活化信号),是一种人工构建的可识别特异性抗原的受体。通过各种载体在体外将CAR基因转入T细胞中所制备的表达CAR分子的T细胞就被称为嵌合抗原受体T细胞(CAR-T cell)。CAR-T细胞可以根据其表面携带的特异性受体来追踪和识别并引导T细胞杀伤癌细胞。
单细胞测序(Single-cell sequencing)是指获取单个细胞遗传信息的测序技术,即在单个细胞水平上,对基因组、转录组、表观组等遗传信息进行提取扩增和高通量测序分析。单细胞组学领域近年来发展迅猛,为人们揭示了纷繁复杂生物学体系的众多线索。将高分辨率的单细胞测序和CAR T治疗相结合,可以帮助我们进一步探讨CAR-T细胞疗法的疗效,作用机制,开发新的靶向性药物和联合治疗方案等,来优化和提高CAR-T细胞治疗临床应用范围 !
接下来,让我们从近期文章中看一下CAR-T治疗研究如何与单细胞测序相结合吧~
1
文章名称 Vaccine-boosted CAR T crosstalk with host immunity to reject tumors with antigen heterogeneity[1] 疫苗增强CAR T细胞与宿主免疫相互作用进而抑制抗原异质性肿瘤 发表期刊:Cell 影响因子:64.5 发表时间:2023.07 研究背景 近年来,癌症免疫疗法蓬勃发展,为广大癌症患者带来了新的希望,其中,嵌合抗原受体( chimeric antigen receptor,CAR)T细胞疗法是突破性技术之一。CAR-T疗法就是收集癌症患者的T细胞并对其进行重新编程,然后再把它们输回患者体内,改造后的CAR-T细胞能够精准地摧毁癌细胞,帮助患者重获新生。该方法在某些癌症,如白血病和淋巴瘤的治疗上卓有成效。但在实体肿瘤中,CAR-T治疗迄今为止并不成功,其中两个关键挑战是1)肿瘤本身存在的抗原异质性,即不是所有的肿瘤细胞都表达CAR靶向的抗原;2)在治疗过程中发生的抗原丢失,即肿瘤细胞在受到CAR T细胞的攻击时,一些肿瘤细胞的反应是停止靶抗原的产生。抗原扩散效应(Antigen spreading,AS)是指靶向某个抗原的T细胞能够激活靶向其他抗原的T细胞的现象。越来越多的证据表明,AS在癌症免疫治疗过程中可以被诱导,并可能有助于整体治疗结果,因为它产生了大量的T细胞,这些T细胞一起工作,克服实体肿瘤抗原异质性,可以完全根除肿瘤并防止肿瘤再生。 本文作者之前在研究中发现,给小鼠注射CAR-T细胞后不久后,又通过注射携带CAR-T细胞靶向的相同抗原的疫苗直接在原生淋巴结微环境中重新刺激CAR - T细胞可以有助于工程化的CAR-T细胞攻击肿瘤,而且还有助于产生针对其他肿瘤抗原的宿主T细胞,即发生AS现象。因此,本次研究作者主要想进一步探究AS的作用机制。 研究结果 作者使用这种CAR-T治疗联合疫苗增强作为模型,结合单细胞转录组测序及其他验证手段,来了解AS效应在CAR-T清除具有抗原异质性实体瘤中的作用机制。结果发现,疫苗增强的CAR-T可以促进树突状细胞(DC)向肿瘤的募集,增加DC对肿瘤抗原的摄取,并诱导内源性抗肿瘤T细胞的启动。这一过程伴随着CAR-T代谢向氧化磷酸化(OXPHOS)的转变,并严重依赖于CAR-T衍生的IFN-γ。疫苗增强的CAR-T诱导的抗原扩散效应(AS)可以有效应对实体瘤的抗原丢失现象,增强CAR-T表达IFN-γ的能力可以进一步增强异质性肿瘤的治疗效果。因此,CAR-T细胞来源的IFN-γ在促进AS中起着关键作用,这一组合疗法有望成为治疗实体瘤的有效手段!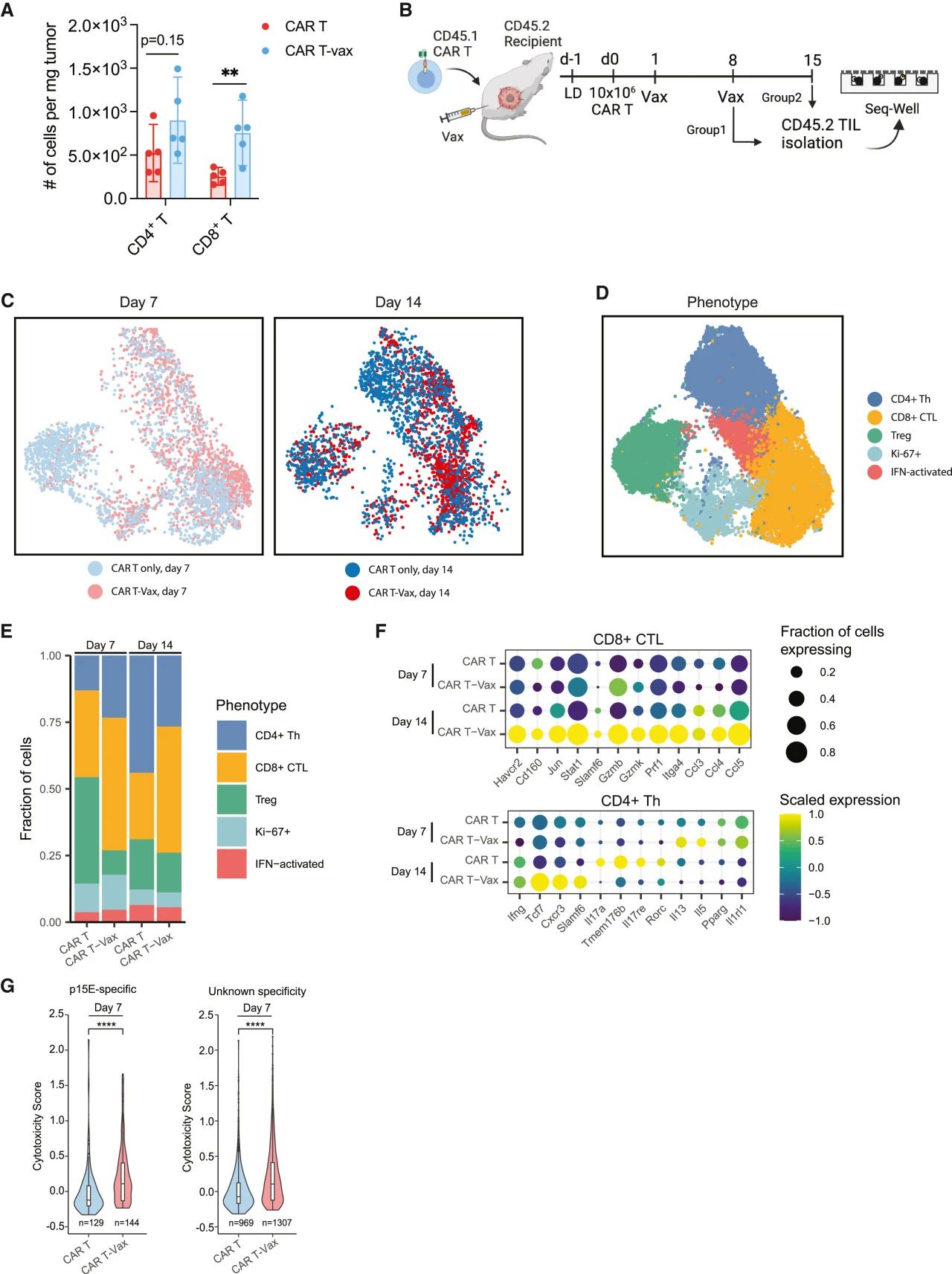
2
3、文章名称 Transcriptional signatures associated with persisting CD19 CAR-T cells in children with leukemia[2] 单细胞转录组测序揭示在复发/难治性儿童B细胞型急性淋巴细胞白血病中具有长期效用的CD19 CAR-T的转录特征 发表期刊:Nature Medicine 影响因子:82.9 发表时间:2023.07 研究背景 B急性淋巴细胞白血病(B-ALL)是儿童癌症中最常见的类型,主要来自携带细胞表面抗原CD19的未成熟的B细胞。大多数患有B-ALL的儿童可以通过包括细胞毒性药物在内的系列一线治疗手段得到治愈。然而,即便增强细胞毒性化疗方案,复发的B-ALL仍然是儿童死亡的主要原因。近年来,CD19嵌合抗原受体CAR-T细胞疗法的出现,改变了难治性B-ALL的治疗方法,已成为难治性或复发性B-ALL儿童的既定治疗选择。然而,不同患者对CAR-T细胞治疗的反应存在差异,有些患者可以维持长期的治疗效果,但60%的儿童会因CAR-T细胞治疗效果不持久或CD19逃逸而复发。目前,CAR-T细胞持久性的分子特征尚不明确。 研究结果 此文章的研究团队使用scRNA-seq,scTCR-seq等技术,对10例复发难治性儿童急性B淋巴细胞白血病患者接受CD19 CAR-T细胞治疗后5年内的血液和骨髓样本用流式细胞术分离CAR-T细胞并进行单细胞免疫组库测序。他们对持续存在CAR-T细胞的患者和效果不如预期的患者进行了比较,发现长寿命CAR-T细胞具有CD4/CD8双阴性表型和类似衰竭的记忆状态,并具有独特的转录特征。这种持久性特征在所有长期治疗反应良好的儿童中占主导地位,并在两名慢性淋巴细胞白血病成年患者中检测到。这项工作为为揭示临床上有效、持久的CD19 CAR-T细胞存在的普遍转录特征提供线索。

文章名称 Single-cell transcriptomic atlas-guided development of CAR-T cells for the treatment of acute myeloid leukemia[3] 单细胞转录组测序发现AML的CAR-T治疗新靶标 发表期刊:Nature Biotechnology 影响因子:46.9 发表时间:2023.03 研究背景 CAR-T 细胞靶向CD19或BCMA已在大量患有不同B细胞恶性肿瘤的个体中显示出强大的临床疗效,如B细胞淋巴瘤、B细胞急性淋巴细胞白血病和多发性骨髓瘤等。但由于缺乏安全有效的靶标,CAR-T细胞用于治疗急性髓细胞白血病(AML)尚未取得成功。AML是成人最常见的急性白血病,它的分子异质性使发展新型AML治疗方案的开发变得更加复杂。尽管大多数患者在接受联合化疗后都有较为显著的治疗效果,但该疾病复发率仍然高达50%。复发后,同种异体造血干细胞移植(allo-HSCT)是唯一的治疗方法,但即使做移植,患者长期生存概率仍低于20%。目前,靶向AML相关靶抗原CD33和IL3RA(CD123)CAR-T细胞正在进行临床研究。其他靶标,如CD70、CLL1,FLT3、CD44v6、Siglec-6或CD117已经作为替代CAR靶点进行临床前研究。然而在AML这样的髓系恶性肿瘤中,常见的靶标通常在其他重要组织上表达,增加了非肿瘤靶向毒性,因此,找寻安全靶标,对于将具有巨大治疗潜力的CAR-T细胞应用于髓系肿瘤具有重大的意义。 研究结果 作者基于15个AML病人的scRNA-seq数据集和来自9个健康人体组织(大脑、肺、淋巴结、心脏、皮肤、肝脏、肾脏、结肠和食道)的11个scRNA-seq数据集,生成了包含28000多个健康和恶性骨髓细胞以及500,000个健康细胞的单细胞转录组图谱,对这些数据进行了细胞表面分子表达分析,找到在恶性肿瘤细胞表面表达,但在人类健康细胞中(包括T细胞)最少表达的抗原。经过严格筛选,最终确定两个新的可用于治疗AML的CAR-T细胞的靶点:CSF1R和CD86。作者还开发了针对这两个靶点的CAR-T细胞,并在体内外细胞系和人源性模型(包括原发性AML母细胞)中测试了它们的功效。在体外使用先进的原代细胞培养方法对这些靶向表达细胞类型进行的安全性评估显示,其比现有的抗 CD33 CAR-T 细胞具有更好的鉴别能力。此外,作者使用了几种体内模型来减轻安全性问题。总之,文章的结果说明了基于 scRNA-seq 的无偏倚筛选方法的转化潜力,并为我们的 CAR 候选药物的临床开发奠定了基础。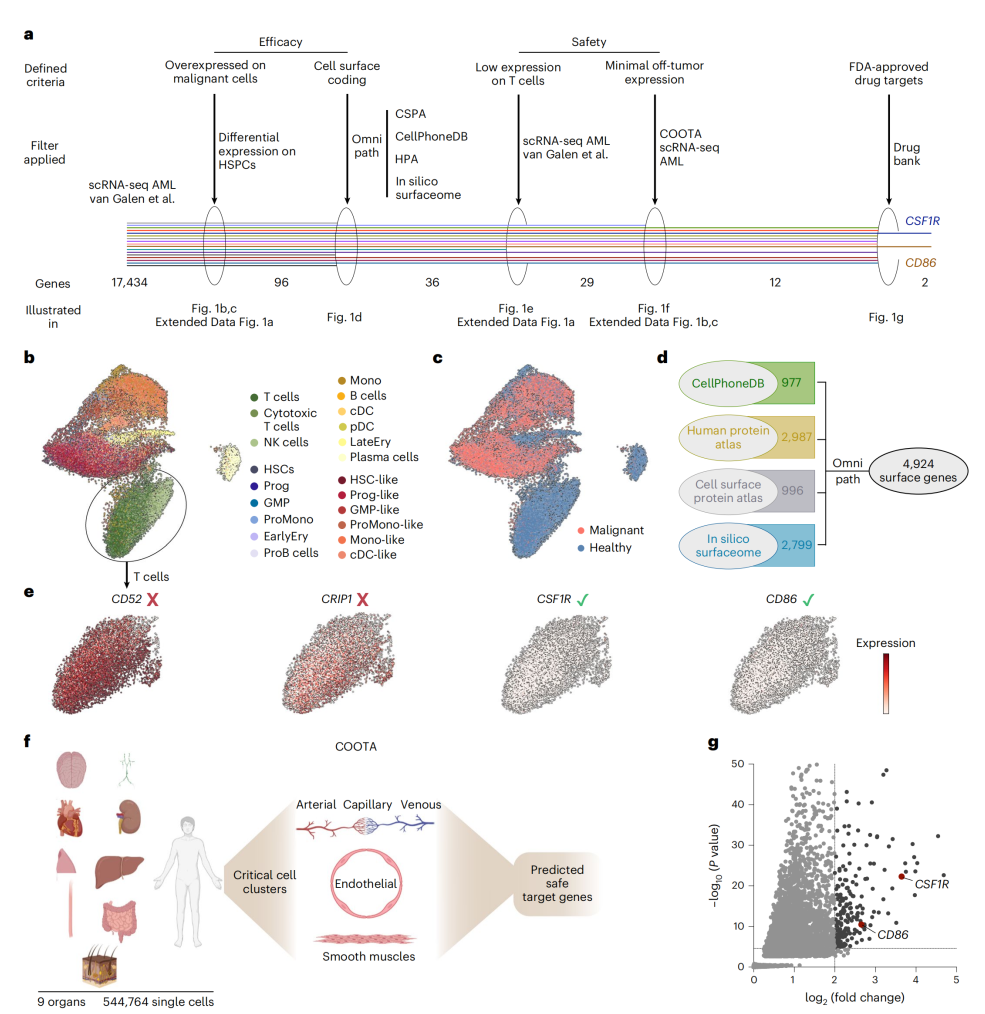
参考文献: [1] Ma L, Hostetler A, Morgan DM, Maiorino L, et al., Vaccine-boosted CAR T crosstalk with host immunity to reject tumors with antigen heterogeneity, Cell (2023). [2] Anderson, N.D., Birch, J., Accogli, T. et al. Transcriptional signatures associated with persisting CD19 CAR-T cells in children with leukemia. Nat Med 29, 1700–1709 (2023). [3] Gottschlich, A., Thomas, M., Grünmeier, R. et al. Single-cell transcriptomic atlas-guided development of CAR-T cells for the treatment of acute myeloid leukemia. Nat Biotechnol (2023).