
2024-02-05
随着单细胞测序技术的快速发展,单细胞测序的应用范围也越来越广泛,从动物、植物逐渐触及微生物领域。在微生物领域中,尤其是原核生物,细胞体积小,存在细胞壁、转录本不稳定,拷贝数低,mRNA缺乏polyA尾等特征严重阻碍了微生物单细胞测序的应用,该技术目前仍处于起步阶段。为促进微生物领域的快速发展,本公司推出一款单细胞测序新产品:smRNAPSN-seq,该产品为科研人员提供了一种高通量的微生物单细胞转录组分析工具,它将促进未来在鉴定新的细胞亚群、微生物表型异质性的分子机制(耐药性、刺激环境适应性、代谢产物产量差异等)、微生物演化及微生物与宿主相互作用等领域的研究,接下来我将从以下7个方面进行介绍:
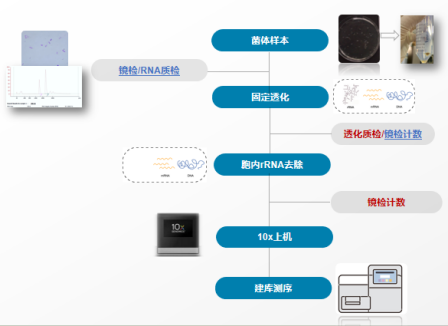
微生物单细胞测序-实验流程 首先需要使用甲醛溶液对培养至对数生长期的微生物细胞进行固定,交联胞内的核酸和蛋白质,以防止mRNA降解;接着对固定后的微生物细胞进行透化,以便进行rRNA的去除;然后通过细菌计数板确定处理后的细胞悬液浓度并稀释至合适浓度。使用10X平台将单个微生物细胞与胶珠等组分封装到液滴中并进行RT反应,给每个cDNA上添加分子标签。破油后对标记cDNA进行扩增,最后进行文库构建,上机测序,如图1所示。 图1基于10X平台的smRNAPSN-seq的技术路线及实验流程
微生物单细胞测序-送样指南 因微生物样品的特殊性,大部分实验操作需要在生物安全柜或超净工作台上进行,实验中使用的培养基、培养瓶以及耗材等都是无菌的,从而避免或减少外部污染或外部信号干扰。对于常规的细菌培养样品,优先取位于生长曲线指数期(OD600=0.3-0.5)的甲醛固定样品进行送样(实验操作可参考附录),需寄送2管1ml新鲜冷的0.1M Tris-Hcl-RI重悬的细胞样品;如未经过甲醛固定,则需要提供2管(20ml)培养好的菌液或划线平板,附带液体或固体培养基以及培养条件;对于特殊处理的细菌培养样品,需老师自行进行相关的特殊处理操作,为锁定特殊处理后的实验样品的转录本状态,可进行甲醛固定(实验操作可参考附录),需寄送2管1ml新鲜的冷的0.1M Tris-Hcl-RI重悬的细胞样品。另外特殊处理操作信息可填写在样品信息单的备注一栏中;之后使用封口膜将存放甲醛固定样品或培养好的菌液的离心管以及划线平板封闭好,放入样品袋中封装,在样品袋外包裹有缓冲膜,防止样品直接接触冰袋出现结冰现象,然后将样本信息单与微生物细胞样品一起打包邮寄,如图2所示。详细介绍可见:微生物单细胞测序——送样指南篇。 图2 样品制备及包装流程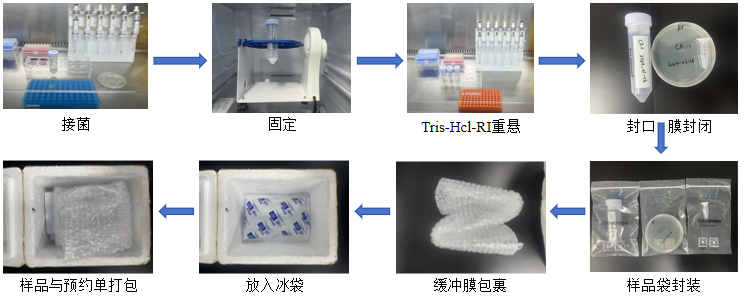
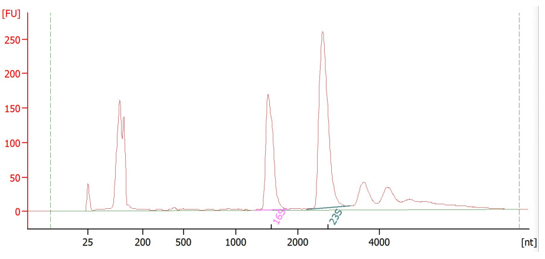
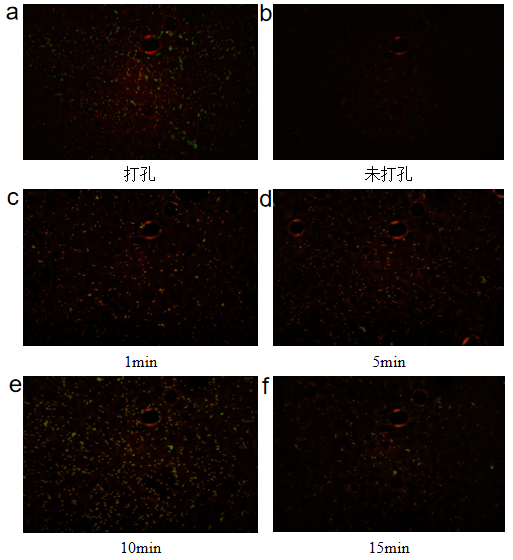
微生物单细胞测序-样品质控 实验操作是否规范在很大程度上决定了测序数据的质量,微生物单细胞转录组测序实验操作中,单细胞悬液的制备、细胞的固定透化等环节都需要严格质控,质控合格才能保证数据结果的质量和稳定性。例如样品核酸质检、细胞死活率质检和透化效果质检。寄送的微生物细胞样品需要对其样品状态(死活率、RNA状态等)进行鉴定。首先从样品中取出一部分细胞悬液进行荧光染料染色,在荧光显微镜下观察,发出绿色荧光的为活细胞(图3a),发出红色荧光的为死细胞(图3b),使用软件工具将两者合并在一起计算细胞活率(图3c)。其次需要对微生物细胞核酸进行提取并检测(图4),保证样品核酸具有较好的完整性(RIN > 8)。最后需要对样品的透化效果进行鉴定,因透化效果决定了样品的数据有效利用率。透化效果鉴定分为两种:打孔透化效果鉴定(图5a,b)和溶壁透化效果鉴定(图5c,d,e,f),荧光强度与透化效果成正比。 图3 微生物细胞死活率质检图 图4 微生物细胞RNA 2100质检图 图5 样品透化效果镜检图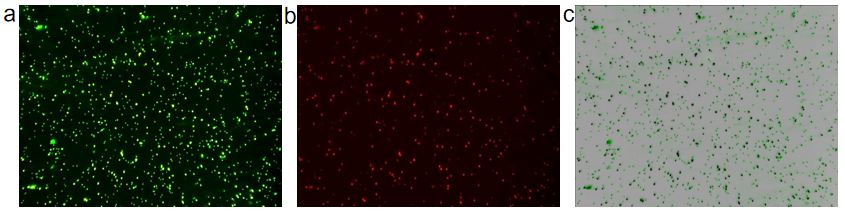
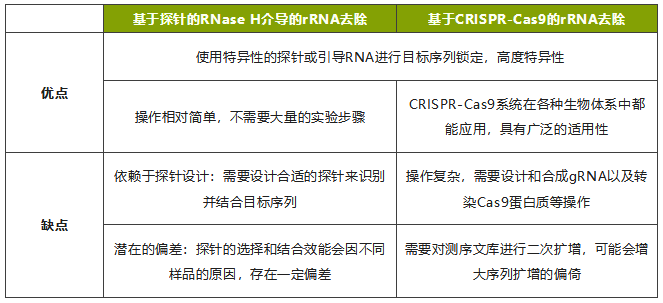
微生物单细胞测序-rRNA去除 细菌核糖体核糖核酸(rRNA)是存在于细菌细胞中的一类RNA分子,约占总RNA 80% - 98%,rRNA在蛋白质合成过程中起到关键作用,但是在研究遗传调控机制或NGS测序技术等方面,还是要看信使核糖核酸(mRNA)。而在微生物单细胞转录组测序中,由于原核生物mRNA缺乏PolyA尾,无法效仿真核生物进行mRNA的捕获,从而选择进行rRNA的消减。目前应用于微生物单细胞转录组测序的rRNA去除方法主要有:基于CRISPR-Cas9的rRNA去除方法(图6a),基于酶法的RNase H介导的rRNA去除方法(图6b)。两种方法各有优劣(表1)。目前本公司推出的新产品smRNAPSN-seq采用的rRNA去除方法,经多种微生物细胞样品测试,rRNA占比最低可达5.82%,后期我们会进一步优化rRNA去除方法,加强数据稳定性,进一步降低rRNA占比(图6c)。 图6 微生物单细胞测序rRNA去除 表1 两种去除rRNA方法的优缺点比较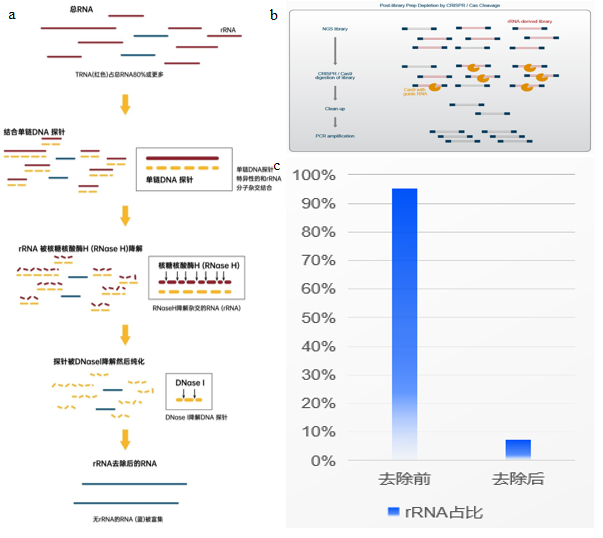
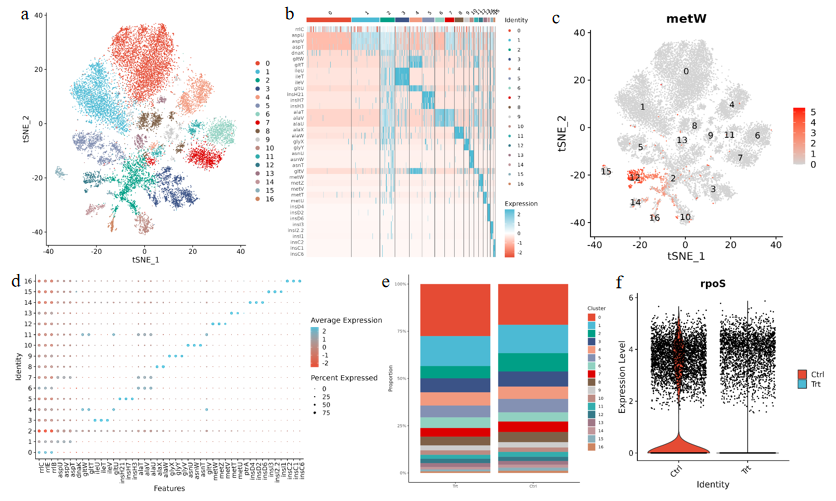
微生物单细胞测序-数据分析 微生物单细胞测序分析流程如图7所示,首先需要对获得的原始数据进行数据质控、基因组比对、10x Barcode和UMI统计及生成表达矩阵等基本分析;之后对过滤后的数据进行细胞聚类及可视化等初步分析,在此基础上可进行菌群鉴定、基因功能注释及拟时序分析等高级分析。为验证smRNAPSN-seq实验技术和分析流程的可行性,我们进行了内测实验,部分数据分析结果如图8所示,UMAP分析显示出17个细胞亚群,其次每个亚群间的高表达基因和基因表达量也出现明显差异(图8a、b、c)。同时确定每个亚群的差异表达基因并进行了热图分析(图8d)。此外,样本间的数据分析显示:空白组与处理组的细胞亚群比例和部分功能基因表达量存在显著差异(图8e、f)。以上结果表明细菌在处理的条件下会出现异质性,而传统的转录组测序会掩盖这种异质性的存在,而smRNAPSN-seq可以发现并区分这种异质性。 图7 smRNAPSN-seq数据分析流程 图8 smRNAPSN-seq实测数据结果展示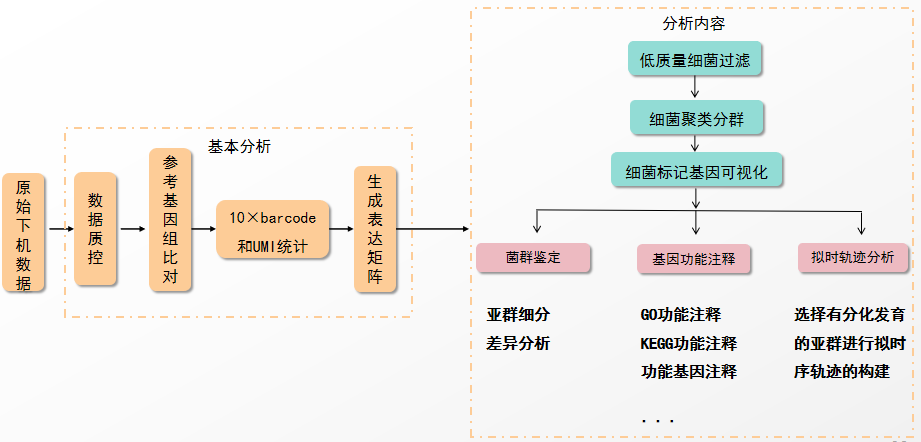
微生物单细胞测序-项目优势 smRNAPSN-seq是本公司自主研发的基于10X平台的创新型微生物单细胞转录组测序技术,具有以下优势: 具有完善的质控体系(如图9a,b),保证高质量数据产出(如图9c); 具有较低的rRNA占比(如图9d),保证具有较高的数据利用率; 基于10X微流控平台,具有稳定的微流体分隔体系; 具有实验流程和操作简单快捷,减少人为误差; 周期可控,更快的项目周期和更好的数据; 本公司具有完善的配套分析流程,从实验到分析一站式服务。 图9微生物单细胞测序项目优势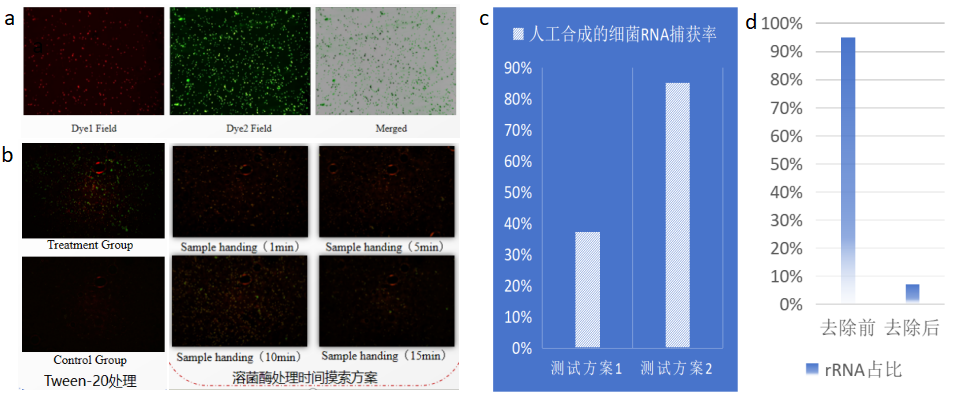
微生物单细胞测序-应用方向 本公司采用smRNAPSN-seq实验方法分析了在实验处理条件下微生物菌群的异质性,大大增加了发现稀有罕见细胞亚群的概率,同时可以根据细胞亚群间的差异和高表达基因进行选择敲除,以此在单个细胞的层次来探究细胞代谢调控等通路的分子机制。此外微生物单细胞转录组测序还可应用于抗生素耐药机制研究、微生物时序表达、微生物群落功能定位,如图10所示。 图10 微生物单细胞转录组测序的应用方向 近年来,随着微生物单细胞转录组测序文献陆陆续续的发表,单个菌体或混合菌体的微生物单细胞转录组的研究方法已相当成熟,扩宽了当前微生物组学的相关研究,同时也开启了微生物组学测序新篇章,也显示了科研工作者们对于微生物组学研究的追求,对于微生物单细胞转录组测序技术有着更高的期望。因此环境样品的微生物单细胞转录组测序成为了下一个研究热点。而环境样品具有复杂的理化性质、丰富的微生物种类,对于实验样品的预处理存在巨大的考验,后期我们会进一步克服相关的难点,完善环境样品的微生物单细胞转录组测序技术,为微生物组学的发展提供更大的助力。
附录-细胞甲醛固定实验流程 (1)将培养至对数生长期的菌液样品在4℃,5500×g条件下离心10min; (2)弃上清,将底部细菌重悬在5ml新鲜的冷4%甲醛溶液(1×PBS溶解)中,4℃震荡过夜16h; (3)次日,将细胞在4℃条件下以5500×g离心10min。去除上清液,将细胞重新悬浮在1ml新鲜的冷PBS-RI(0.1U/ul)中,并转移到无酶1.5ml离心管中,在4℃,7000×g离心10min,去除上清液,将细胞重新悬浮在补充有0.1U/ul RNase抑制剂(终浓度)的1ml新鲜的冷0.1M Tris-Hcl-RI(pH7.5)中(每一重悬细菌细胞操作,至少吹打10次以上,无肉眼可见沉淀)。 (4)试剂配制: ①10ml的4%甲醛溶液:在15ml离心管中加入0.4ml的甲醛溶液,用9.6ml的1xPBS溶解; ②10ml的PBS-RI(0.1U/ul)溶液:在15ml离心管中加入1000U的RNase抑制剂,补充1xPBS溶液至10ml; ③10ml的0.1M Tris-Hcl-RI(0.1U/ul)溶液:在15ml离心管中加入1000U的RNA酶抑制剂和1ml 1M Tris-Hcl pH8,补无酶水至10ml。