
2024-02-18
单细胞(核)样本制备是单细胞测序中关键步骤之一,为了获得纯度好、质量高的单细胞(核)悬液,需要根据不同的样本类型和实验目的选择合适的方法进行细胞(核)纯化分离。密度梯度离心和流式分选是两种常用的细胞分离纯化技术,两种技术不论是在科学研究还是临床应用中都发挥着重要作用。密度梯度离心基于细胞密度差异进行细胞(核)分选,将细胞(核)混合物通过不同离心转速在离心管中因为密度不同而分层,形成密度梯度,根据细胞(核)密度差异收集不同分层中的目标样本,这种纯化分离方法存在一定局限性,仅适用于细胞体积和密度差异较大的样本制备。
相较于密度梯度离心,利用流式细胞仪对细胞(核)进行分选具有更高的精确性和灵活性。流式细胞分选是一种从混合(异质性)细胞群体中进行快速检测、分析、分类,同时设定筛选“门”选择性分离出目标细胞的技术。流式分选利用荧光标记物进行标记,通过调节合适的电压、补偿等,通过荧光将目的细胞与非目的细胞区分开来,在设定的筛选“门”范围内,根据收集到的参数信息,流式细胞仪会判断目标细胞是否符合预定条件,如果符合,则触发电荷或压力控制系统,将目标细胞从混合细胞中单独分离出来,这样就实现了对目标细胞的有选择性纯化。那流式分选是如何检测荧光标记物并分析分类?流式分选可以做什么?怎么做?接下来为大家一一解答。
1、原理1、 流式细胞术(Flow cytometry,FCM)是通过利用流式细胞仪对处于快速直线流动状态中的单列细胞或生物颗粒进行逐个、多参数、快速的定性、定量分析或分选的技术。 分选型流式细胞仪一般由液流系统、光路系统、检测分析系统和分选系统4部分组成,其基本原理是通过基于层流规律的流体动力学聚焦,将带分选样本注入流动液体(称为鞘液)层流中间的流室中,鞘液可帮助缩窄细胞流,从而将细胞/颗粒组织成一行大致单行的流线;单个细胞/颗粒依次快速通过激光束,检测器会检测细胞或颗粒的散射光。前面的检测器检测前向散射光 (FS),放置在侧面的多个检测器检测侧向散射光(SS),荧光检测器则检测被染色的细胞/颗粒发射的荧光。通过滤光片将FS、SS以及荧光分成既定的波长并分配通道。荧光会被过滤,以使各传感器仅检测特定波长的荧光。这些传感器称为光电倍增管(PMT) ,荧光会被过滤,以使各 PMT 仅检测特定波长的光。PMT 会将光子能量转换成电信号,即电压。通过计算机进行实时展示、分析和储存处理后,将携带所需分选荧光信号的细胞/颗粒带上电荷并通过两个偏转板产生的静电场通道,发生偏转,落入收集管中(图1)。 图1 流式细胞术示意图[1]
2、应用 2、应用 流式细胞术可以提供待分析的颗粒的结构和化学特性的信息。虽然最常见的应用是单个哺乳动物细胞,但它也适用于植物、细菌、酵母和病毒以及线虫和果蝇等整个生物体的研究。相反,也可以分析细胞的某些部分,例如分离的细胞核、染色体、细胞器或细胞外囊泡。 (1)细胞。流式细胞术非常适合分选天然悬浮细胞或者是已制备好的单细胞悬浮液。通过细胞自发荧光或加入相应染料,可以在分析时排除死细胞从而保持分选得到高活力细胞悬液。同时,细胞任何部分都可以用荧光探针标记,但是流式细胞术提供整个细胞的信息,没有荧光的定位,无法判断其在细胞内分布。为了确定荧光的位置,需要利用荧光或共聚焦显微镜或成像流式细胞术进行分析。 (2)细胞核。在实验研究中有时研究对象仅有DNA 或核蛋白,或者在单细胞测序中因为样本限制无法制备细胞悬液,在这种情况下,可以选择分离纯化得到细胞核悬液,对其进行流式分选,而且细胞核通常具有较少的非特异性结合,因此背景更干净。与整个细胞相比,分离的细胞核通常具有更好的CV,从而更容易进行分析。 (3)细胞器。整个细胞内的细胞器都可以通过用荧光染料标记的抗体或荧光探针染色来特异性鉴定分选,线粒体、溶酶体、内质网、高尔基体等都可以通过染色被识别,但因为细胞器大部分为未经固定,在分析中不仅需要评估背景荧光的阴性对照,也需要增加确保染色成功的阳性对照。 (4)染色体。通过具有不同碱基对特异性的DNA结合染料染色,经流式细胞术可以分析得到染色体大小和碱基对情况,同时因为流式细胞术可以更快速简便的分析中期染色体进行倍性分析,可以快速准确检测同一物种范围内不同倍性的样品 (5)细胞外囊泡(extracellular vesicles,EVs)。EVs 不仅携带母体细胞多种特征性生物信息分子,而且可以将这些分子传递给其他细胞,在许多生理病理学过程中充当生物信息传递载体。为了研究 EVs在免疫学中的作用,流式细胞术是对表达某些抗原的EVs进行准确的定性及定量的首选技术。EVs主要由脂质膜和胞质内容物组成,其中可能包括细胞器,因此,可以通过标记脂质、特定膜蛋白或特定细胞器荧光和光散射(侧向散射或直角光散射优于正向散射)来识别和检测EVs。但是普通流式检测检测下限为 200-500 nm,无法检测小EVs(30-150 nm),因此在分析此类微粒时,目前有通过紫光侧向角散射光替代前向散射光检测以及其他超高灵敏流式检测装置的流式细胞仪。
3、基本步骤3、基本步骤 (1)样本准备:根据实验需求准备带分选样本,若为细胞样本需保证细胞样本的纯度和活力; (2)荧光标记:利用易于检测的标记直接标记细胞,以区分不同细胞便于后续分析分选,目前利用不同光谱性质的荧光团标记不同细胞是最常见和最成熟的技术,荧光标记主要包括荧光标记偶联抗体、细胞示踪染料、荧光蛋白; (3)流式细胞仪设置:根据标记物的特性,设置流式细胞仪的参数,包括激光波长、滤光片设置等。确保仪器正常工作并准备好进行检测分析; (4)样本分析:将标记后的细胞上样,仪器通过激光照射检测细胞荧光信号。根据标记物的特异性,可以识别和分析不同类型的细胞。 (5)设定分选参数:根据实验需要,设置流式细胞仪的分选参数,包括调整补偿、设定筛选门、分选速度等,确保分选的准确性和有效性; (6)分选收集:根据设定的分选参数,进行细胞的有选择性收集和分选。可以将目标细胞单独收集或排除非目标细胞; (7)分选后处理:对分选后的细胞进行镜检观察细胞状态,对其进一步处理和分析,确保所得到的细胞符合实验要求后,进行下一步实验。 图2 流式分选基本流程示意图[2]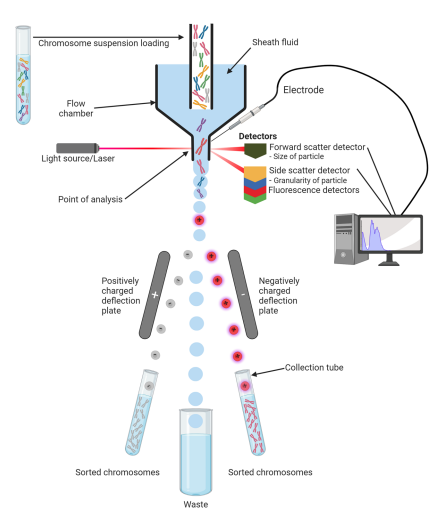
4、影响因素 4、影响因素 (1)调整样本重悬液及收集液组分。样本制备的目的是获得高活性、低杂质、少聚集的单细胞悬液。根据不同样本可选择不同缓冲液作为样本重悬液,通常情况选择无Ca2+Mg2+的1×PBS加入1%BSA作为重悬液;分选后所得细胞已经历过激光照射、喷嘴剪切力、液滴充电、入液冲击等不利刺激,为尽可能恢复细胞活性,收集液可选择完全培养基,若后续需进行高通量测序,则更建议选择无Ca2+Mg2+1×PBS加入1%BSA、RI作为收集液进行收集; (2)液流。在流式分选中,液流作为细胞的载体和分选的对象,影响着分选所有四个指标(纯度、速度、得率及活性)。液流的稳定是保证分选准确进行的基础,因此,形态正常且稳定的液流是得到纯度高、活性好细胞的关键。维持液流稳定的关键就是液路与鞘液系统稳定、保持温度恒定、必要时进行无菌分选; (3)假阳性。进行基于荧光信号的分选时,假阳性信号的干扰是分选后存活率低的主要原因,而荧光假阳性信号主要有3种来源:样品中自发荧光的死细胞、粘连后增加荧光值的阴性样品和经过分选后致死的正常细胞,为减少由于非活性细胞引起的假阳性,最有效方法是引入与目的探针不同颜色的阴性选择探针,将非活性细胞去除; (4)液滴延迟。液滴延迟是从目标细胞被检测到所在液滴被充电所用的时间,是分选精确性的直接影响因素。在调节液滴延迟前,应调整监测激光的照射角度,使四路模拟分选液流被均等照亮。否则会使分选液流和中心液流的照度不同,影响液滴延迟的设置[3]; (5)液滴收集。含目标细胞的液滴在断点处需进行充电,在汇入收集器后又发生放电,对其中细胞的状态有一定影响。因此在分选较为特殊的样本时,根据样本不同特性调整仪器设置,例如使用低压力、大喷嘴以及在保证分选液流偏转角度的前提下使用较小的充电量,相应地增大偏转电压,以减少电荷对细胞的刺激; (6)平衡纯度、浓度、分选时间。在流式分选过程中,需要最大限度地提高分选样本的浓度和纯度,并尽量减少流式分选的时间。但因为浓度和纯度相互影响,且都取决于速度,所以三者之间不能同时最大化。上样速度过高会使得分选回收率下降,造成部分阳性细胞被丢弃,分选速度过低会延长分选时间,不利于维持细胞活性。因此在分选实验中,不能同时对纯度、浓度、时间进行优化,需要在三者之间找到一个折中方案(如图3); 图3 平衡纯度、浓度、分选时间[4]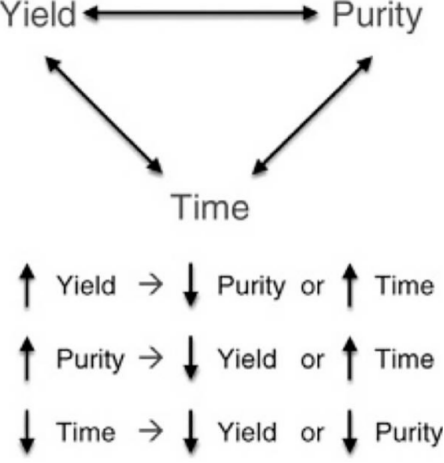
5、派森诺流式分选平台 5、派森诺流式分选平台 派森诺流式分选平台引入Beckman CytoFLEX SRT 全自动流式细胞分选仪,其配置四根高功率固态激光器,配置FSC、SSC、VSSC以及不少于15 个荧光探测器、四路分选模式、可采用混合分选逻辑(纯度模式、富集模式和单细胞模式);仪器可以在很短时间内检测大量细胞,对同一个细胞进行多参数分析,并精准的分选到相应目的细胞,在满足日常实验多色分析和分选的需求的同时也能满足当下热点应用小颗粒分析分选方面的需求,可以完美提供0.1-50um细胞颗粒的高动态范围检测;顶级的信号和电子处理系统,可以获得最优化的分选得率和纯度;仪器具有高数据分辨率和信号精度,保证微弱荧光信号的识别;仪器配置精准的高通量克隆分选技术Cyclone,最多可以分选到384孔板,真正实现单克隆分选。该仪器多参数分析和高通量分选功能,能够满足不同样本单细胞测序的科研需求,提升实验效率和准确性。 图4 Beckman CytoFLEX SRT 全自动流式细胞分选仪
[1]Li, Y., Mahjoubfar, A., Chen, C.L. et al. Deep Cytometry: Deep learning with Real-time Inference in Cell Sorting and Flow Cytometry. Sci Rep 9, 11088 (2019). https://doi.org/10.1038/s41598-019-47193-6. [2]Doležel, J., Urbiš, P., Said, M. et al. Flow cytometric analysis and sorting of plant chromosomes. Nucleus 66, 355–369 (2023). https://doi.org/10.1007/s13237-023-00450-6. [3]刘洋.流式细胞分选优化经验浅谈[J].科学咨询,2018,(1):55-56. [4]Cossarizza A, Chang HD, Radbruch A, et al. Guidelines for the use of flow cytometry and cell sorting in immunological studies (second edition). Eur J Immunol. 2019;49(10):1457-1973. doi:10.1002/eji.201970107