
2018-10-27

文案 | 微生物组事业部
正文
近期,派森诺生物与西北农林科技大学合作,在《Bioresource Technology》(影响因子5.807)发表论文,通过研究优势和稀有微生物亚群的群落组成和功能特征,揭示无机碳(IC)对氨氧化颗粒系统中优势和稀有微生物类群的影响。
研究背景
在氨氧化颗粒系统中,氮转化微生物在氮循环网络中起着举足轻重的作用,其中无机碳(IC)作为化学自养微生物同化作用的碳源,在维护氨氧化颗粒系统的稳定中有着十分重要的影响。然而,无机碳对氨氧化颗粒系统中优势和稀有微生物类群的组成模式和功能概况的影响,目前仍知之甚少。
研究目的
1. 探究在不同IC/TN比值胁迫下,优势和稀有亚群是否呈现出对比鲜明的组成模式和功能特征;
2. 在分类水平和代谢功能上了解两个亚群的特点和背后的驱动力;
3. 明确不同细菌亚群中氮转化途径的关键调控因子。
研究方法
测序技术:Illumina MiSeq高通量测序平台
测序模式:微生物组细菌16S rRNA基因V3V4区测序
实验对象:厌氧氨氧化污泥颗粒反应器
实验设计
在为期200天的试验周期中,对厌氧氨氧化颗粒系统分9个阶段施加IC(无机碳),形成各时期不同的IC/TN(无机碳/总氮)比值。取各阶段结束时的污泥样本,每个阶段取3个重复,并将其混合进行总DNA的提取。DNA用于测序分析和氨氧化功能基因的绝对定量分析。
分组 | 处理 |
Phase Ⅰ | 正常状态 |
Phase Ⅱ | 不添加IC |
Phase Ⅲ | IC/TN比值0.31 |
Phase Ⅳ | |
Phase Ⅴ | IC/TN比值0.62-1.24 |
Phase Ⅵ | |
Phase Ⅶ | |
Phase Ⅷ | IC/TN比值增至1.87 |
Phase Ⅸ |
研究结果
▶ 无机碳处理下厌氧氨氧化颗粒系统的氮转化效率
图1总结了IC对氨氧化颗粒系统氮处理能力的影响。在阶段1(0-20天)中,氮加载速率(NLR)和氮清除速率(NRR)分别为0.88和0.74 kg-N/(m 3 ·d)。ΔNO 2 − /ΔNH 4 + 和ΔNO 3 − /ΔNH 4 +的比值分别为1.26 ± 0.02和0.25 ± 0.04。之后,其他阶段进行不同浓度的IC处理。
在阶段2中,不施加IC处理,NH 4 + -N、NO 2 − -N和TN的清除效率分别降低至70.83 ± 1.50%、84.43 ± 2.42 %和74.16 ± 1.41%。ΔNO 2 − /ΔNH 4 +比值上升至1.33 ± 0.03,但ΔNO 3 − /ΔNH 4 +的比值下降为0.11 ± 0.03。NH 4 + -N、NO 2 − -N在出水流中能被观察到。NLR和NRR大幅下降至0.35 和0.26kg-N/(m 3 ·d)。这表明IC不足对氨氧化活性有不良影响。在阶段3和阶段4中,随着IC/TN的比值由0升至0.31,NH 4 + -N、NO 2 − -N和TN的清除效率均逐渐开始回升。这说明厌氧氨氧化菌的活性可以通过施加IC来恢复。
在第5、6、7阶段中,IC/TN比值继续从0.62增加至1.24,NH 4 + -N、NO 2 − -N和TN的清除效率较大幅度下降,而NLR和NRR只有轻微地减小,表明尽管厌氧氨氧化活性在较高的IC/TN比值(0.62-1.24)下稍稍被抑制,但氨转化微生物开始逐渐适应新环境。在阶段8和9中,IC继续增加,IC/TN比值升至1.87。NH 4 + -N、NO 2 − -N和TN的清除效率又开始回升,NLR和NRR也得到恢复。表明更高比值的IC/TN有助于氨氧化颗粒系统的恢复。
图1:脱氮性能的表现:(a)进水和出水NH4+-N、NO2−-N和NO3−-N的浓度分布;(b)NH4+-N、NO2−-N 和TN的清除效率分布;(c)NH4+-N、NO2−-N 、NO3−-N和TN的转化速率分布;(d)氮加载速率(NLR)、氮清除速率(NRR)和水力停留时间(HRT)。
▶ 优势和稀有亚生物群落组合模式和功能特征
在整个群落中,阶段3、5、8的Alpha多样性与其他阶段有显著差异(P<0.05),表明在以上阶段IC/TN比值对细菌群落的均匀度和优势度有不同的影响。优势、瞬态和稀有类群包括507、264和1337个OTU,分别占总OTU数的24.1%、12.5%和63.4%。此外有208个OUT属于核心分类单元,占总数的9.8%。核心分类单元隶属于优势和瞬态类群为主,分别占核心分类单元的43.3%和56.7%,而稀有类群在核心分类单元的占比为0。
从分类水平上来看,优势和稀有类群的细菌群落结构差异很大(2a,b)。Proteobacteria(30.6%)、Chloroflexi(15.7%)、Bacteroidetes(12.5%)、WWE3(12.1%)和Planctomycetes(9.5%)为优势亚群中占主导地位的门,而Proteobacteria(35.4%)、Actinobacteria(17.9%)、Acidobacteria(12.6%)、Chloroflexi(12.4%)和Bacteroidetes(5.1%)为稀有亚群中的有势门。Wilcoxon秩和检验结果表明,优势亚群落与稀有亚群落在IC/TN比值胁迫下组成模式存在显著差异(P<0.05)。
优势和稀有亚群的功能预测和代谢途径分析结果显示前21种代谢途径为上述两种细菌亚群所共享。氨基酸利用代谢、转运体、核酸代谢、细胞应激反应和氮循环为主要功能模块(图2c,d)。其中与氨基酸利用代谢、细胞应激反应和氮循环相关的功能模块在优势亚群中更为普遍。相反,与转运体和核酸代谢相关的功能模块在稀有亚群中更加优势。Wilcoxon秩和检验表明,优势亚群和稀有亚群在功能分布上存在显著差异(P<0.05)。
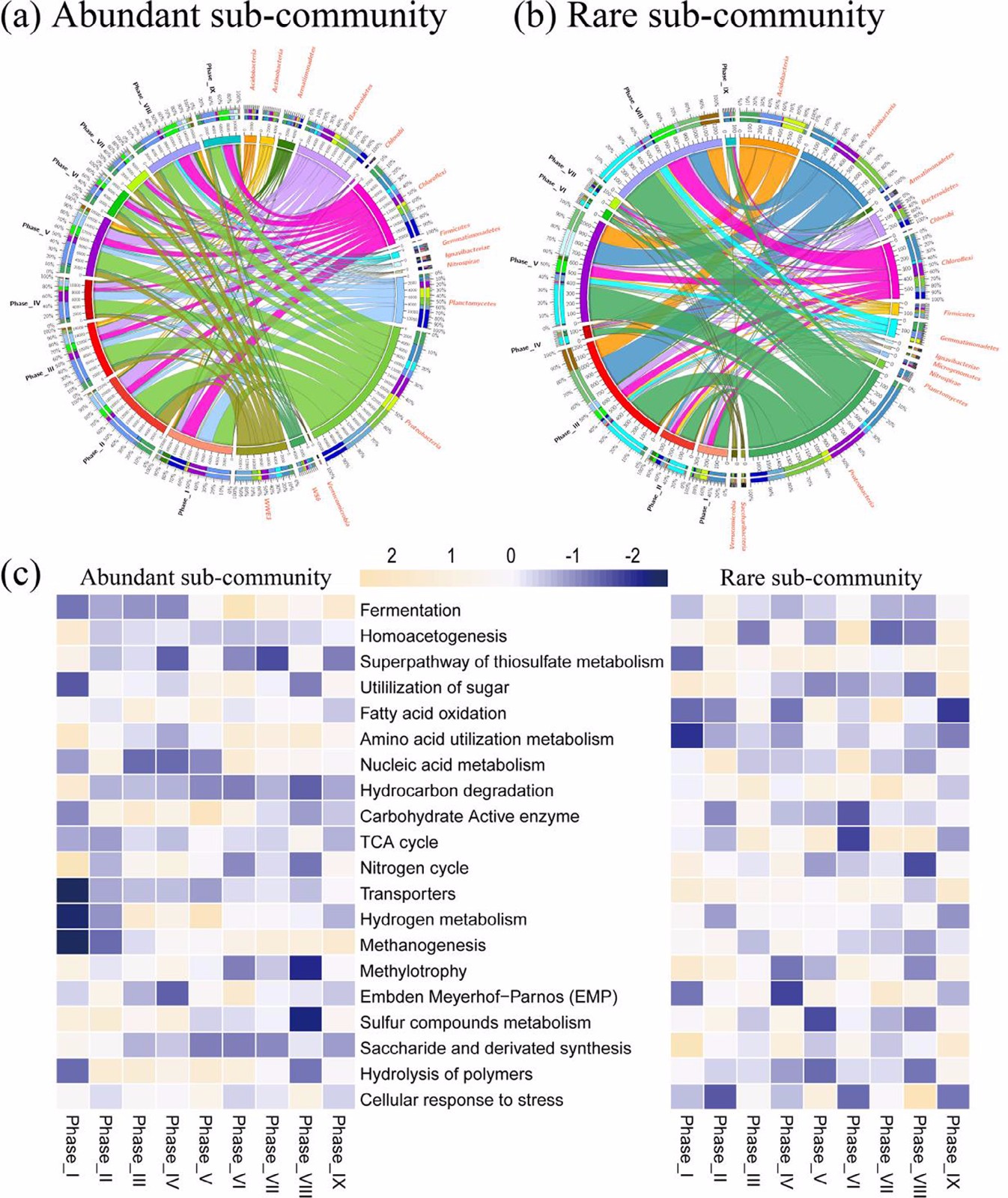
图2:不同处理阶段优势门和功能性状在优势和稀有亚群中的分布。每条带的厚度表示对应分类单元的丰度。内段的绝对厚度和外段的相对厚度分别代表每个分类单元的绝对丰度和相对丰度。其他代表未鉴定的序列。数据由Circos进行可视化(Version 0.69,http://circos.ca/)。
▶ 共现网络的拓扑和分类学特性
为了确定不同细菌亚群的共生模式,本研究构建了群落组成和功能特征的子网络。在OTU共现分析中,整个网络关系1712个节点共捕获了72179个边缘(Spearman’s |ρ|≥0.8,P < 0.01)。在这些节点中,385个属于优势亚群子网络,1296个属于稀有亚群子网络(图3a,b),表明稀有亚群比优势亚群有更高的共现实例。与此同时,子网络的拓扑特征如介度、贴近度、节点可及性、节点度等,在优势亚群和稀有亚群之间存在差异(图3c-e)。如图3c所示,优势亚群和瞬态亚群的节点间中心性值较高,表明整个网络中存在优势类群的核心位置。相反,低介中心性值表明稀有类群具有外围分布。此外,与优势亚群相比,稀有亚群具有更高的贴近度、节点可及性和节点度,表明稀有亚群的类群内关联更强。
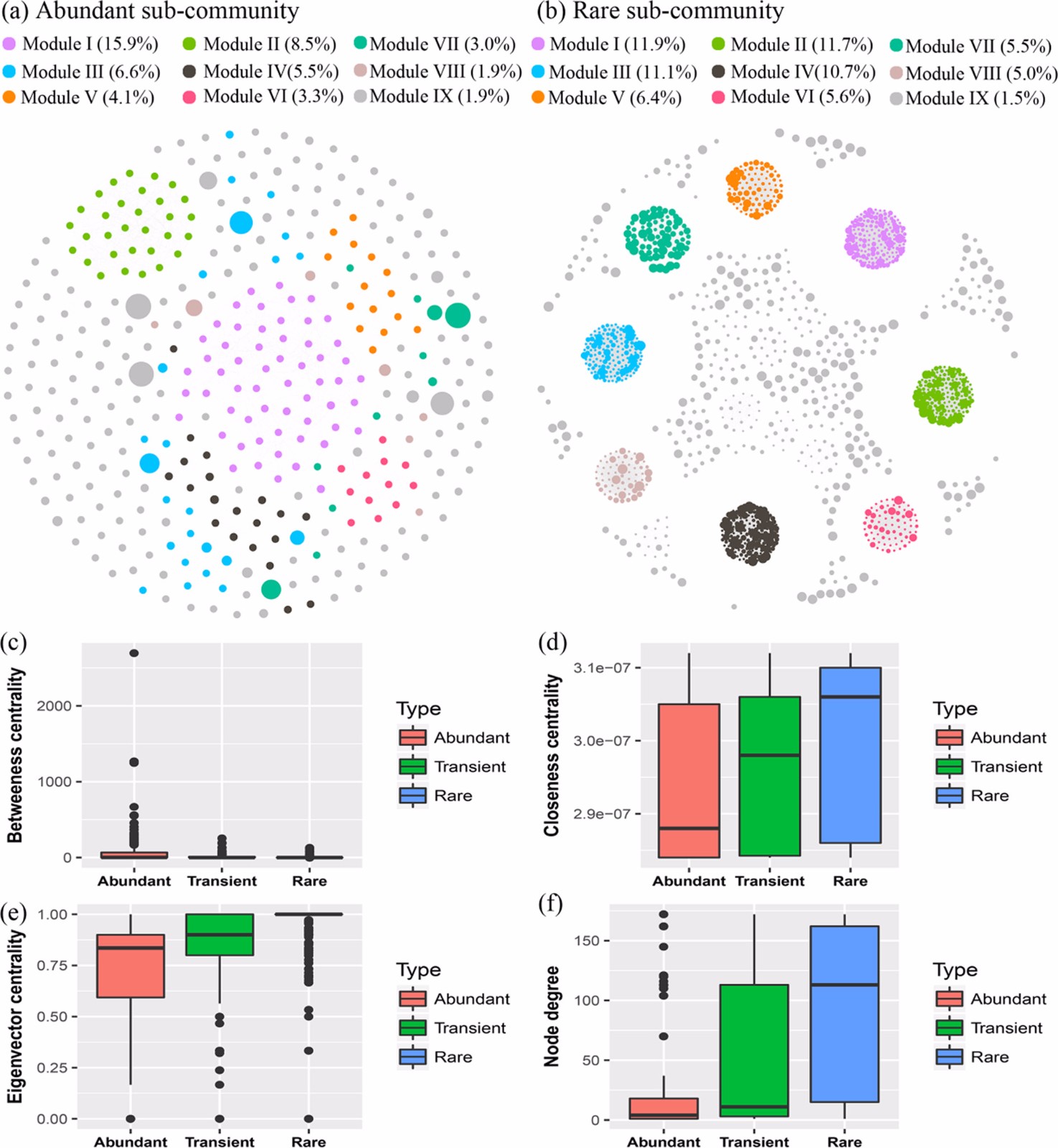
图3:网络分析揭示了OTUs的共现模式。节点分别根据不同的模块分类着色(a,b)。连接代表强大(斯皮尔曼相关系数ρ > 0.8 或者 ρ < -0.8)和显著(P<0.01)的相关性。每个节点的大小与OTUs的丰度成正比。不同亚群的节点级拓扑特征命名为betweenness(c)、closeness(d)、transitivity(e)和degree (f)。AT、MT和RT分别表示优势分类群、瞬态分类群和稀有分类群。
▶ 优势和稀有亚群的驱动力
为探究环境和物种的显著相关性,本研究建立了斯皮尔曼相关性网络(图4)。通常细菌亚群的群落组成和功能特征受到不同环境因子的制约。在环境-物种关联网络中,环境变量如出水流中的NO3−-N、NO2−-N和NH4+-N与优势亚群相关的属之间有显著相关性,其他环境变量如IC/TN比值和TN清除率显示相对较弱的相关性(图4a)。对于稀有亚群,环境变量如NH4+-N、NO2−-N和TN清除率和选中的属有更紧密的关联性(图4b)。在环境-功能关联网络中,与脱氮相关的功能模块主要与出水流的NO3−-N、NH4+-N、NO2−-N和TN清除率相关,并在优势和稀有亚群中均表现出正相关。然而,结果表明其他功能特征和环境变量之间的正负相关性在两个亚群中普遍不同(图4c,d)。这些结果表明,优势和稀有亚群是由不同的操作变量控制的。
图4:基于相关分析的优势属、功能性状和环境变量的网络分析。图中只显示斯皮尔曼系数ρ > 0.6 或ρ < −0.6且显著相关(P<0.05)的关系。每个节点代表优势属或功能特征的相对丰度。菱形节点代表环境变量。实线表示正相关,虚线表示负相关。每条线的厚度与所相连的相关性系数成正比。
▶ 氮代谢特征与功能属的适应性
针对厌氧氨氧化通路,通过KEGG数据库预测发现,在第4、7和9阶段,c-di-GMP 的含量远高于其他阶段。与硝酸盐同化作用相关的功能基因nasA、nasB 和nirA在稀有亚群落中比在优势亚群落中更为优势;与反硝化相关的功能基因nosZ、qnorB 和nirS 在优势亚群中的丰度高于稀有亚群;与硝酸盐分解相关的功能基因napA 和nrfA 在稀有亚群中的预测丰度更高(图5a,c)。这些结果表明氮转化如反硝化、硝化和固氮作用受到优势亚群的调节,而同化硝酸盐还原和异化硝酸盐还原成铵主要受到稀有亚群的调控。
由于氨氧化颗粒反应器的工艺性能受到多种功能物种的介导,本研究基于MiDAS数据库对结构-功能关系进行了预测分析(图5b,d)。在所有经过过滤的属中,对核心功能属(相对丰度最高的12个分类群)为优势或稀有亚群进行了注释。MiDAS数据库显示这些功能物种包含8个功能类群,分别是氨氧化细菌(AOB)、亚硝酸盐氧化菌(NOB)、厌氧氨氧化菌、异养微生物(HET)、磷酸盐积累生物(PAO)、糖原积累生物(GAO)、亚硝酸盐还原菌(NIR)和硝酸盐还原菌(NAR)。如图5b和 d所示,较低的IC/TN比值有利于AOB和Candidatus Brocadia 生长,而适中的IC/TN比值(0.62-1.24)有助于NOB、HET和Candidatus Jettenia 生长,特别的是Candidatus Kuenenia 和GAO能够在更高比值的IC/TN(1.56-1.87)胁迫下生长。由此可见这些氨氧化相关的微生物在IC胁迫下有着不同的适应性。
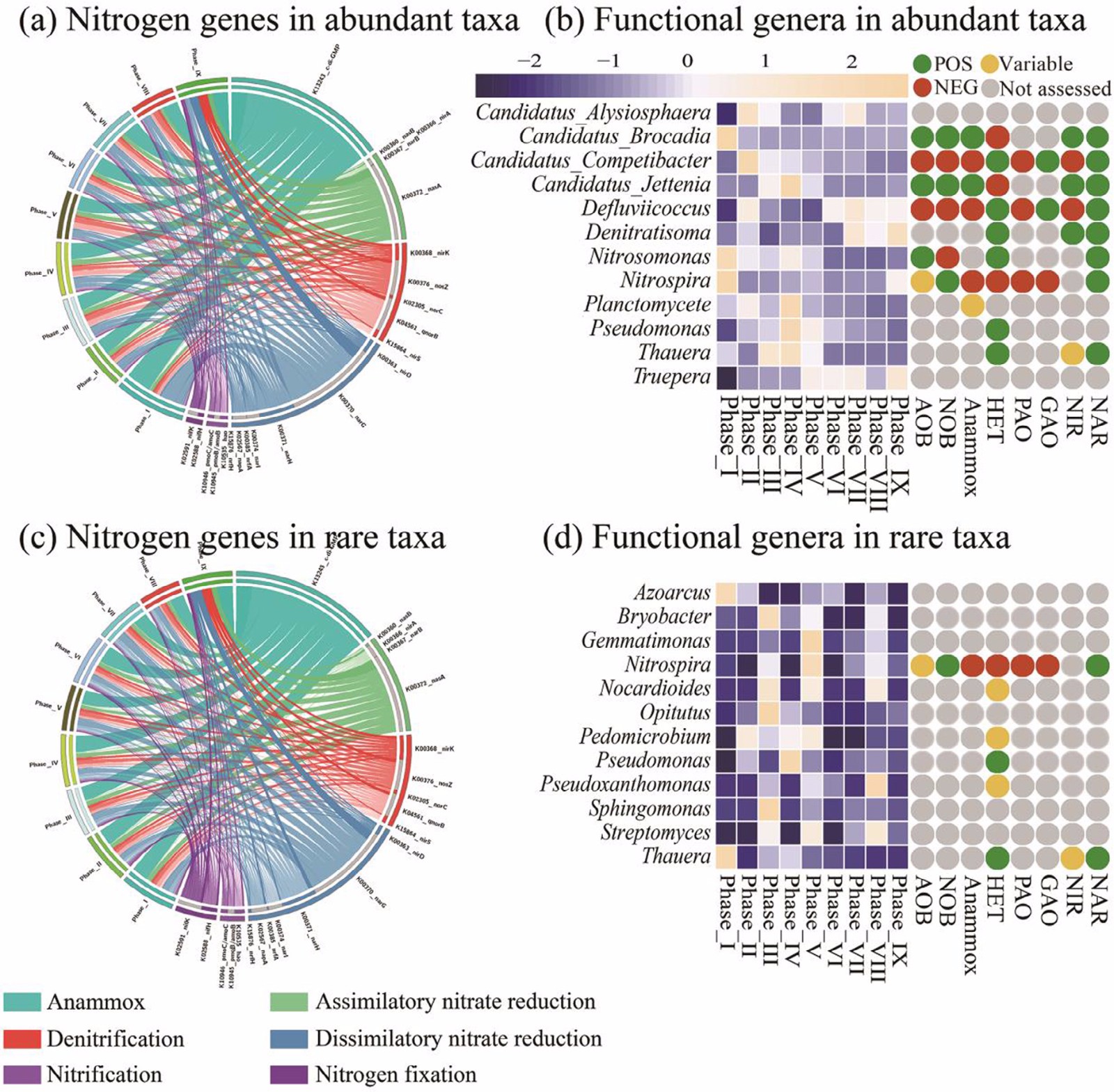
图5:由Tax4Fun基于KEGG数据库对参与微生物氮循环预测得到的功能基因(a和c);基于MiDAS数据库分析得到的与硝基环化相关功能属在优势和稀有亚群中的分布(b和d)。POS和NEG分别代表正相关和负相关。
为了证实MiSeq的测序分析结果,研究者对氮转化相关的功能基因进行了定量分析(图6)。该结果表明优势亚群是NH4+-N和NO2−-N消耗的关键调控因子,而稀有亚群主要负责NH4+-N和NO2−-N的积累。这些结果表明氮转化途径是由不同的细菌亚群介导,此外在不同的IC处理条件下,细菌亚群有不同的生存策略。
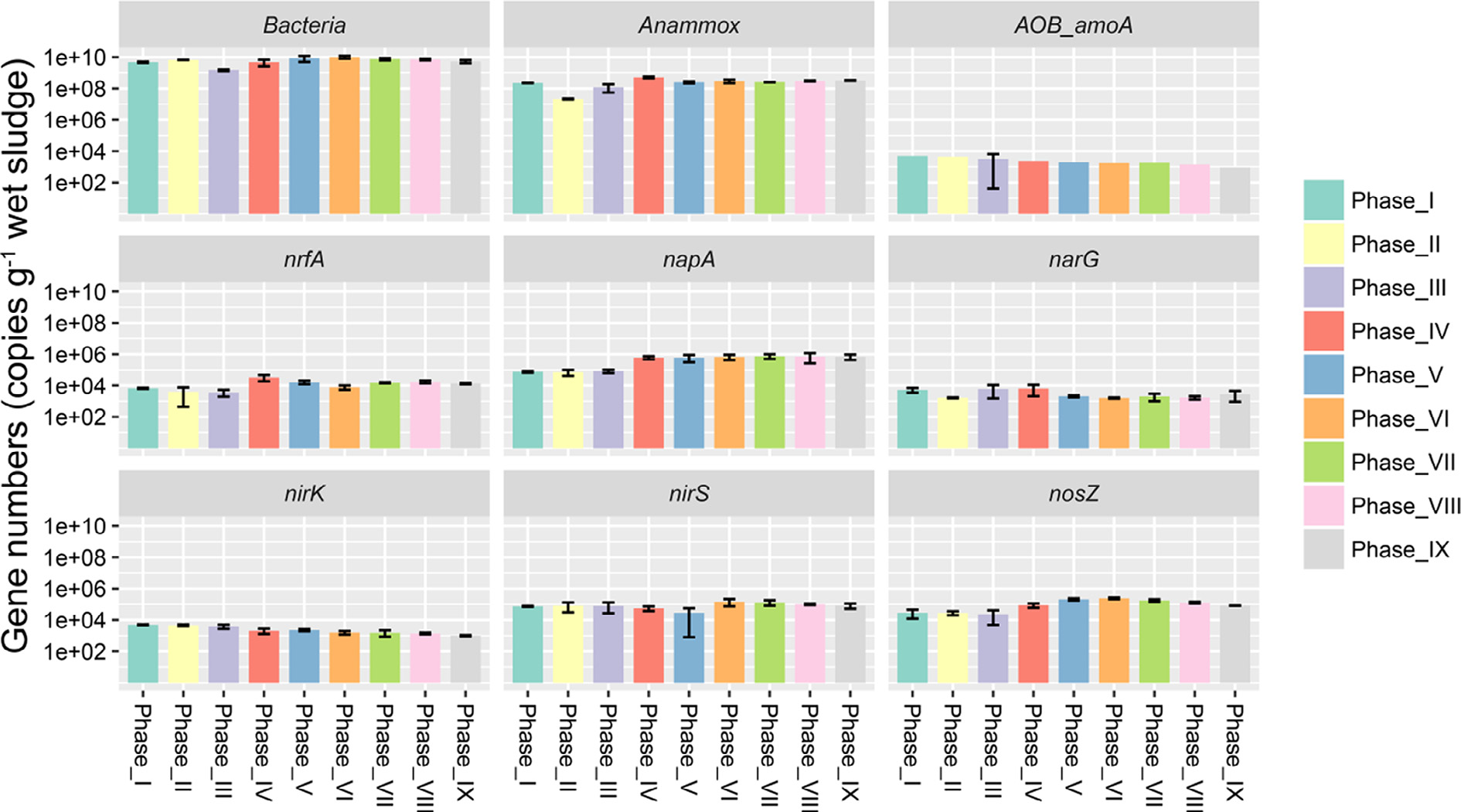
图6:不同时期氮功能基因的定量分析。误差线代表由3个独立重复实验得到的标准差。
总结
本研究结果表明,优势和稀有亚群在IC/TN胁迫下表现出不同的组合模式和功能特征,而该功能特性决定了细菌亚群的选择。细菌亚群在IC胁迫下的生态策略与环境变量密切相关。此外,较低的IC/TN比值(<0.31)对AOB和Candidatus Brocadia 有益,中等的IC/TN比值(0.62-1.24)对NOB、HET和Candidatus Jettenia 较为有利,而Candidatus Kuenenia 和GAO更偏好于较高的IC/TN比值(1.56-1.87)。最后qPCR结果证实在不同程度的IC处理条件下氮转化网络受到不同细菌亚群的调节。
本研究的测序工作由上海派森诺生物科技股份有限公司完成。
文章索引
Duntao Shu et al. Abundant and rare microbial sub-communities in anammox granules present contrasting assemblage patterns and metabolic functions in response to inorganic carbon stresses. Bioresource Technology 265 (2018):299–309.