
2019-08-13
派森诺生物与华中科技大学同济医院携手合作,于2019年6月在《Molecular Therapy: Nucleic Acid 》上发表了基于miRNA的糖尿病性心肌病临床治疗新思路,影响因子5.919。
研究背景
心血管疾病是糖尿病患者严重的并发症之一,而目前常规的抗高糖治疗手段对于糖尿病性心肌病(DCM)患者的心力衰竭无显著疗效。越来越多的研究表明,线粒体功能障碍诱导生成的活性氧(ROS)可能是糖尿病性心肌病的主要诱因;此外有实验数据证实,miRNA能够转位到线粒体,可对线粒体基因的表达起正调控作用。然而,线粒体miRNA在糖尿病性心肌病中的作用目前尚无定论。
基于此,本研究假设线粒体miRNA表达量的改变可能与糖尿病性心肌病的病情发展有关,以db/db小鼠(科研用2型糖尿病小鼠)为研究对象,利用miRNA-mRNA测序及联合分析手段,进行了针对糖尿病患者心衰治疗的线粒体生物学研究。
研究结果
1、线粒体Cytb的下调表达导致db/db小鼠心脏ROS增加
通过比对db/db小鼠和正常小鼠的心脏切片可发现,前者的ROS量显著增加(图1)。由于线粒体是ROS的主要来源,接下来通过Western blot和Real-time PCR (RT-qPCR)分别检测db/db小鼠线粒体各亚基的表达情况。结果显示,从转录水平看,db/db小鼠线粒体电子呼吸链的各亚基mRNA表达量无显著差异(图2);而从蛋白水平看,db/db小鼠线粒体ETCIII上的细胞色素b(Cytb)表达量显著低于对照组(图3)。
为证实低表达Cytb与高表达ROS间的关系,以大鼠心肌细胞H9C2研究对象,对包括Cytb在内的、由mtDNA编码的多个线粒体亚基进行了特异性siRNA转染实验。结果表明,仅si-Cytb处理导致细胞内ROS量显著上升(图4)。这些数据表明Cytb在ROS生成中起着关键作用。因此选择Cytb作为对象,进行深入研究。
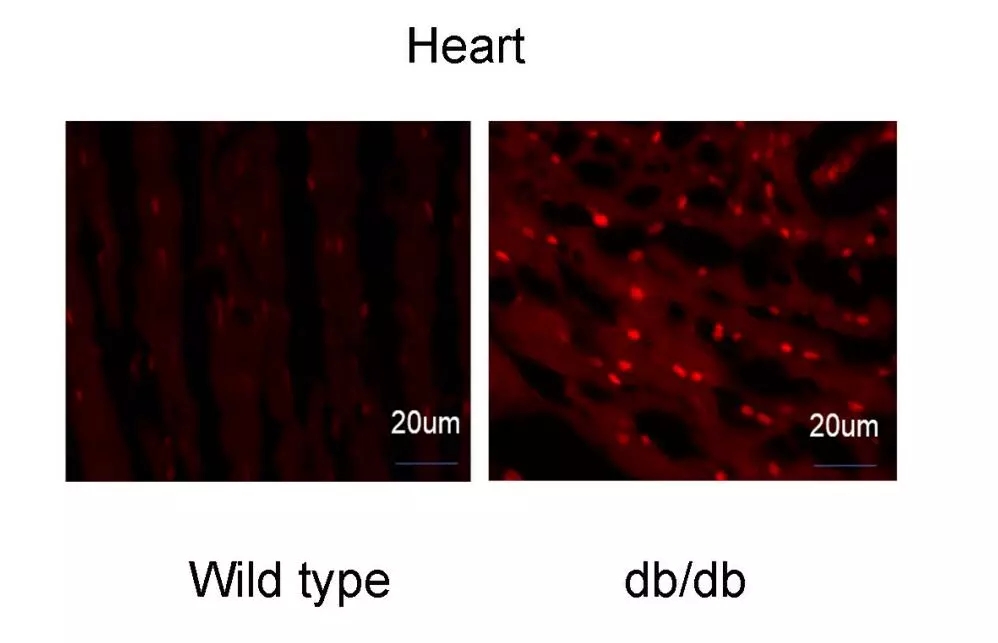
图1 用DHE探针在db/db小鼠冷冻心脏切片中检测ROS的情况(n=3)
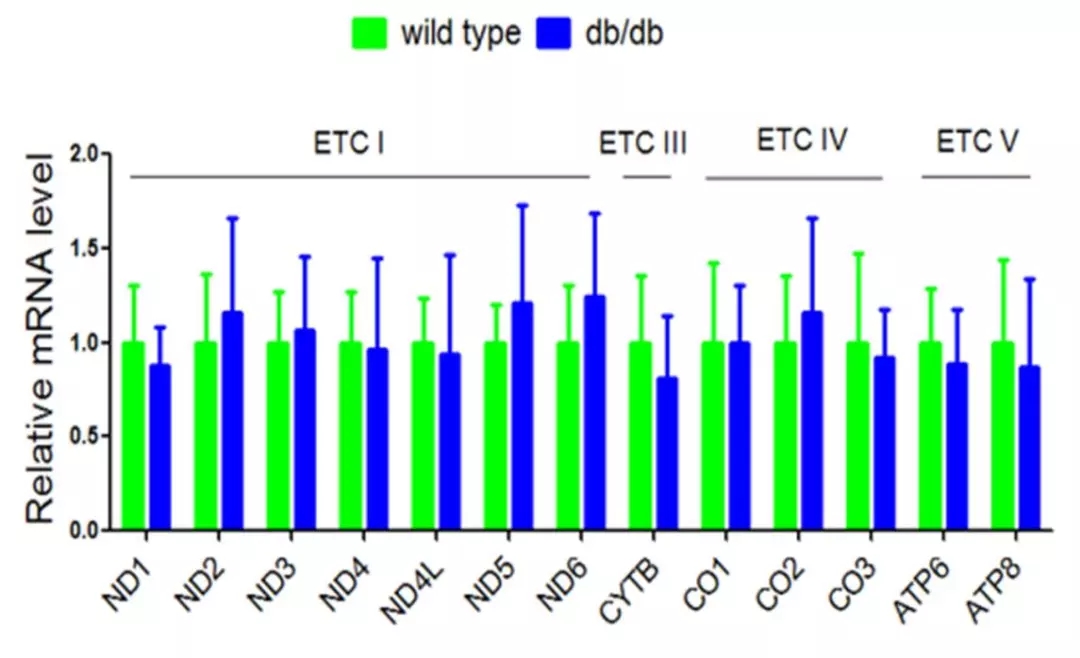
图2 RT-qPCR检测db/db小鼠心脏中ETC各亚基的mRNA表达水平
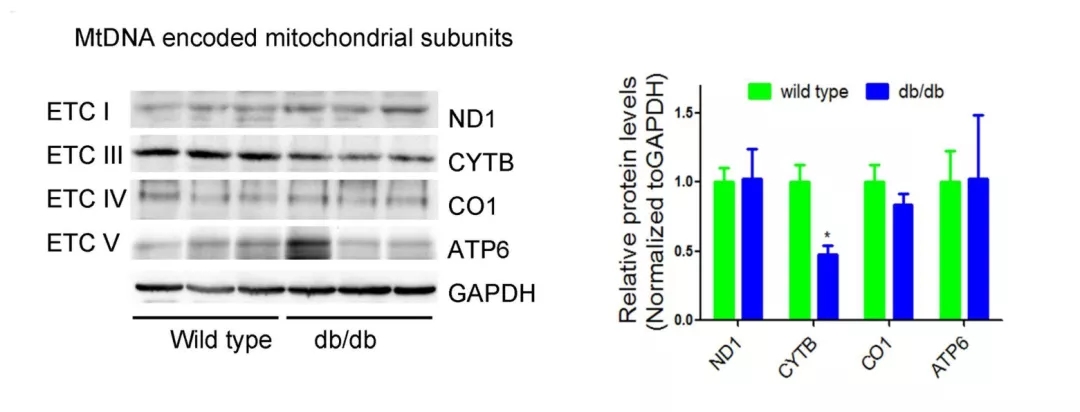
图3 Western blot检测db/db小鼠心脏中ETC各亚基的蛋白表达水平
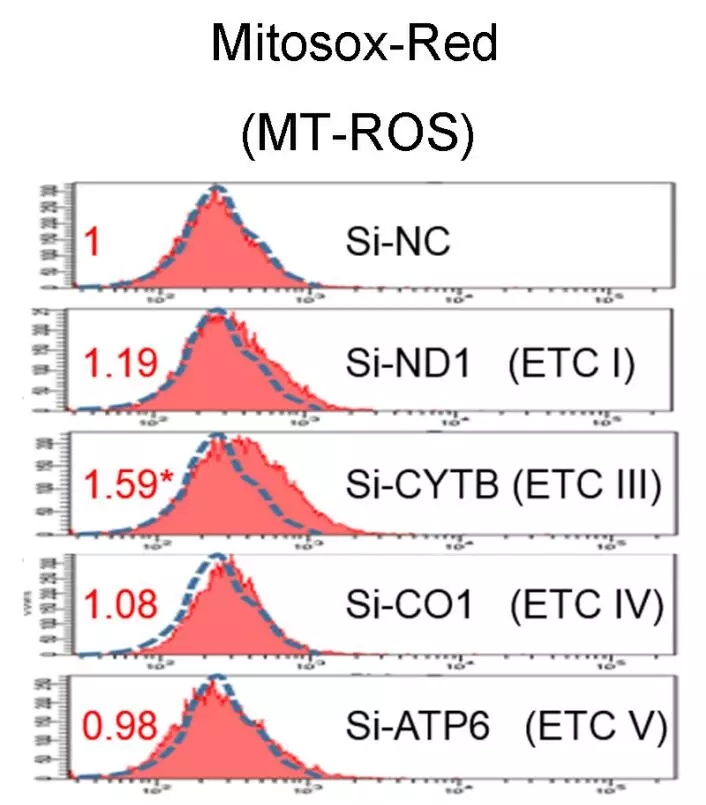
图4 用MitoSox Red检测si-ND1、si-Cytb、si-COI和si-ATP6处理后H9c2细胞的线粒体ROS水平
2、转录组测序揭示Cytb在心肌细胞中的功能
以正常的人心肌细胞为对照组,si-Cytb处理的心肌细胞为处理组(n=3),通过转录组测序进一步研究Cytb在心肌细胞中的功能。Heatmap显示两种心肌细胞的基因表达模式存在明显差异(图5A),火山图显示两种细胞间的差异基因多达数百个(图5B)。KEGG pathway富集分析结果表明,si-Cytb处理的心肌细胞中TNF信号通路、细胞因子-细胞因子受体相互作用通路、NF-kappa B信号通路显著上调(图5C),而细胞周期、cAMP信号通路、钙信号通路显著下调(图5D)。有研究表明,肿瘤坏死因子信号通路,如TNF和NF-kappa B等,是糖尿病性心肌病进展的重要调控因子。这些数据暗示Cytb在糖尿病性心肌病中发挥着潜在作用。
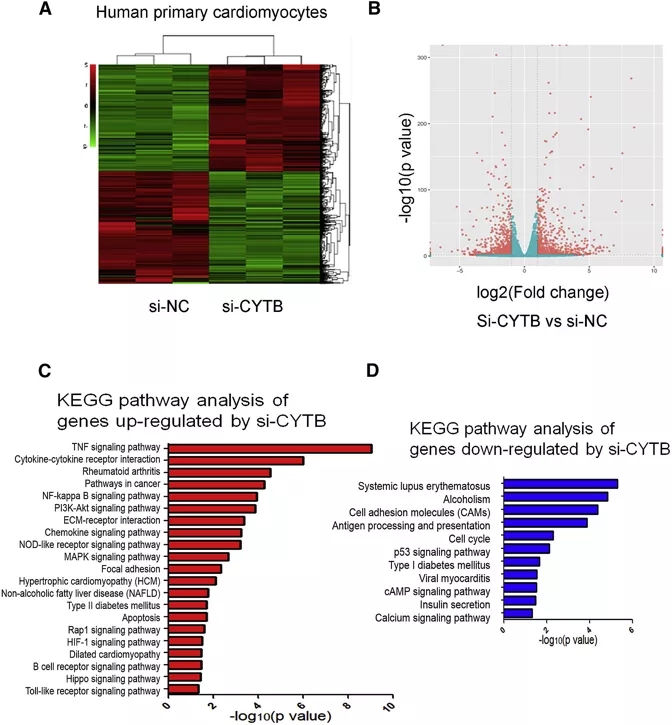
图5 应用mRNA-seq分析Cytb在人心肌细胞中的功能
A:两种处理下的心肌细胞基因双向聚类热图
B:两种处理下的心肌细胞差异基因火山图
C:si-Cytb处理心肌细胞的上调基因KEGG pathway富集分析结果
C:si-Cytb处理心肌细胞的下调基因KEGG pathway富集分析结果
3、miRNA-mRNA联合分析寻找可作用于Cytb的miRNA
为寻找以Cytb为靶标的miRNA,以db/db小鼠的心脏和心脏线粒体为处理组,正常小鼠的相应样本为对照组(n=3)进行miRNA测序。结果显示,db/db小鼠的心脏样本中,有24个miRNA上调表达,24个miRNA下调表达(表1),而其心脏线粒体样本中,仅有14个miRNA下调表达(表2)。基于线粒体翻译中miRNA的正向调控作用,选择下调的miRNA作为预测指标,分别与人、大鼠、小鼠的Cytb mRNA序列进行比对,筛选出了4个以Cytb转录本为靶标的miRNA(图6)。
为进一步确认候选线粒体miRNA对Cytb表达的影响,分别用这4种miRNA转染不同类型的心肌细胞,发现仅有两种miRNA:let-7b-5p和miR-92a-2-5p,会导致Cytb上调表达;此外过表达miR-92a-2-5p或let-7b-5p可降低心肌细胞的ROS水平。这些数据强有力地证实了miR-92a-2-5p和let-7b-5p可正向调控Cytb的表达,从而降低ROS量。
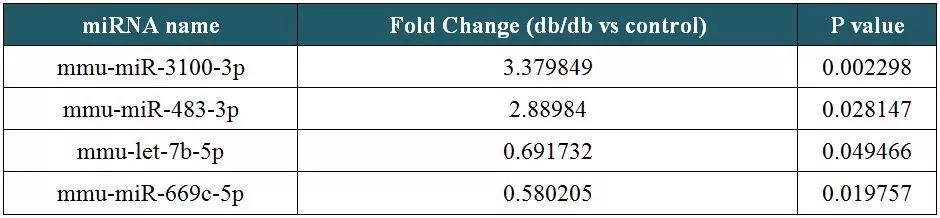
表1:小鼠心脏样品中差异miRNA数据(部分)
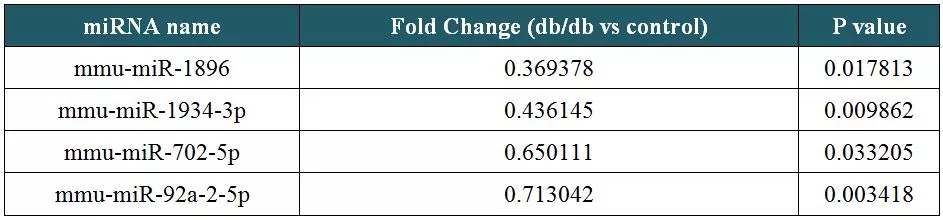
表2:小鼠心脏线粒体样品中差异miRNA数据(部分)
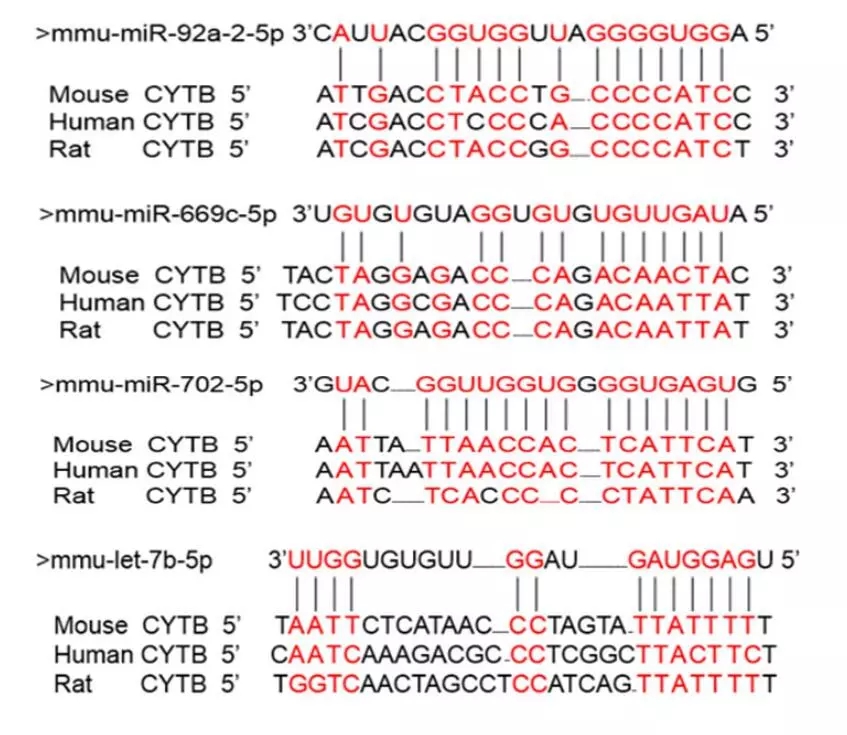
图6 候选miRNA(miR-92a-2-5p、let-7b-5p、miR-669c-5p和miR-702)与不同生物Cytb mRNA的序列比对结果
4、活体验证结合富集分析明确两种miRNA的作用机制
为明确分别达miR-92a-2-5p和let-7b-5p是否能够减轻糖尿病性心肌病的症状,用db/db小鼠模型进行生物活体验证。结果表明,仅转染miR-92a-2-5p可缓解db/db小鼠的心脏舒张功能障碍,而转染let-7b-5p却无效果,这似乎与miRNA-mRNA联合分析的结果相悖。
为解释这一现象,对let-7b-5p的靶基因进行了富集分析。结果表明,MAPK信号相关基因,如IRS1、AKT1、IGF1可能受let-7b-5p调控(图7),Western blot进一步证实let-7b-5p可导致心肌细胞的IRS1下调表达;IRS是一种胰岛素受体底物,它的降低会导致脂质沉积增加,从而加重心脏负担。换言之,let-7b-5p降低心肌细胞ROS的效果与其增加心肌脂质沉积的效果相互“抵消”,最终造成该miRNA对心脏舒张功能障碍无缓解效果。miR-92a-2-5p和let-7b-5p在糖尿病性心肌病中发挥的作用可用图8模型说明。
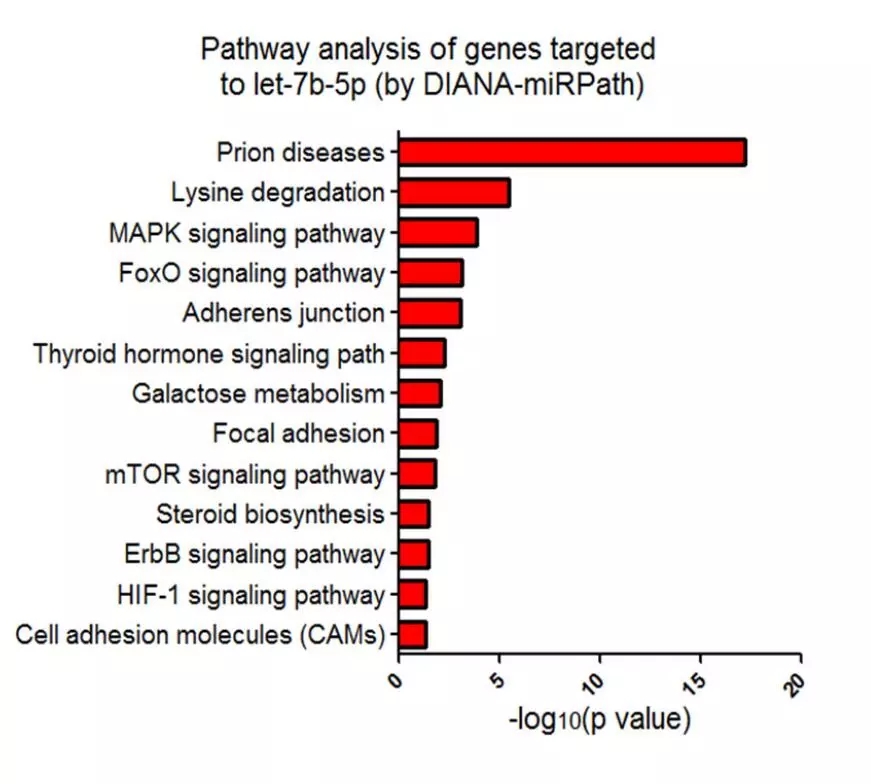
图7 基于DIANA-miRPath对let-7b-5p的潜在靶向基因进行KEGG Pathway富集分析结果
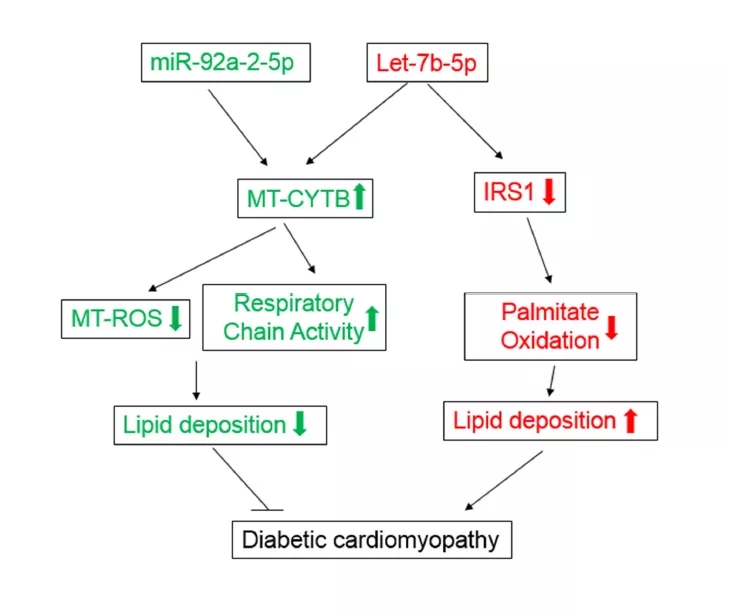
图8 miR-92a-2-5p和let-7b-5p在糖尿病性心肌病中的作用模式图
文章小结
该研究通过mRNA-miRNA测序及联合分析,揭示了miR-92a-2-5p在线粒体翻译中的积极作用。具体而言,该miRNA的过表达可增强线粒体Cytb的翻译,从而减少ROS生成和脂质沉积,最终缓解心脏舒张功能障碍。该结果为发展基于miRNA的糖尿病性心肌病治疗手段提供了理论基础。
本研究的测序和数据分析工作由上海派森诺生物科技股份有限公司完成。
原文索引
Li HP, Dai BB, Fan JH, et al. The different roles of miRNA-92a-2-5p and let-7b-5p in mitochondrial translation in db/db mice [J]. Molecular Therapy:Nucleic Acid, 2019, 17: 424-435.