
2019-11-27

文章题目:
C-Src confers resistance to mitotic stress through inhibition DMAP1/Bub3 complex formation in pancreatic cancer
发表期刊:
Molecular Cancer
技术手段:
ChIP、WGBS、LC-MS/MS、表达谱等
派森诺生物与上海交通大学携手合作,于2018年12月在《Molecular Cancer》上发表了有丝分裂应激下胰腺癌细胞的生存相关机制的研究成果,影响因子10.679。
有丝分裂上的染色质修饰与随后的细胞周期中的转录激活密切相关。作者认为该过程受致癌信号的调节,这将有助于胰腺癌的有丝分裂应激抗性。本文中显示DMAP1 / Bub3复合物介导有丝分裂应激诱导的细胞凋亡,而这种作用在胰腺癌细胞中被c-Src抵消。该研究旨在揭示在正常细胞和胰腺癌细胞之间对有丝分裂应激不同反应的潜在机制。
通过分子和细胞生物学方法确定Bub3和DMAP1在有丝分裂应激信号转导中的相互作用。研究了c-Src对DMAP1 / Bub3介导的DNA甲基化和基因转录谱的抑制作用。分析了c-Src介导的DMAP1磷酸化与体内紫杉醇活性和临床病理特征之间的关系。
有丝分裂阻滞诱导Ser211处Bub3的p38依赖性磷酸化,从而促进DMAP1 / Bub3相互作用。TAp73将DMAP1 / Bub3复合物募集到抗凋亡基因BCL2L1的启动子,从而介导DNA甲基化并抑制与细胞凋亡相关的基因转录。同时,DMAP1在Tyr 246处被c-Src在胰腺癌细胞中高度磷酸化,这阻碍了DMAP1 / Bub3相互作用和相关的细胞活化。阻断DMAP1 pTyr-246可增强紫杉醇抑制的肿瘤生长。在临床上,DMAP1 Tyr 246磷酸化与人类胰腺癌标本中的c-Src活性和胰腺癌患者的不良预后相关。
1、在有丝分裂停滞期间,Bub3与DMAP1相互作用。
免疫沉淀和质谱分析(图1a,右图)表明,有丝分裂阻滞极大地促进了Bub3和DNA甲基转移酶1(DNMT1)相关蛋白DMAP1之间的相互作用。通过使用分别针对Bub3和DMAP1的抗体进行共免疫沉淀分析,进一步验证了内源性Bub3和有丝分裂阻滞下DMAP1之间的相互作用(图1b);虽然DNMT1缺失对DMAP1和Bub3之间的相互作用没有影响,但DMAP1的消耗导致Bub3/DNMT1复合物的形成显著减少(图1c),表明DMAP1介导有丝分裂阻滞下Bub3-DNMT1复合物的形成。细胞系实验表明有丝分裂停滞只导致了轻度的增加DMAP1/Bub3在癌细胞中的相互作用(图1d),推测某些癌症特异性信号参与了调控Bub3/DMAP1复合物的形成;随后证明在胰腺癌中高活性的c-Src在Bub3 / DMAP1相互作用中起负作用。通过构建Bub3的一系列氨基酸截短图,并在有丝分裂阻滞的HPDE细胞中进行的免疫共沉淀分析,确定了与DMAP1结合区范围(图1f)。
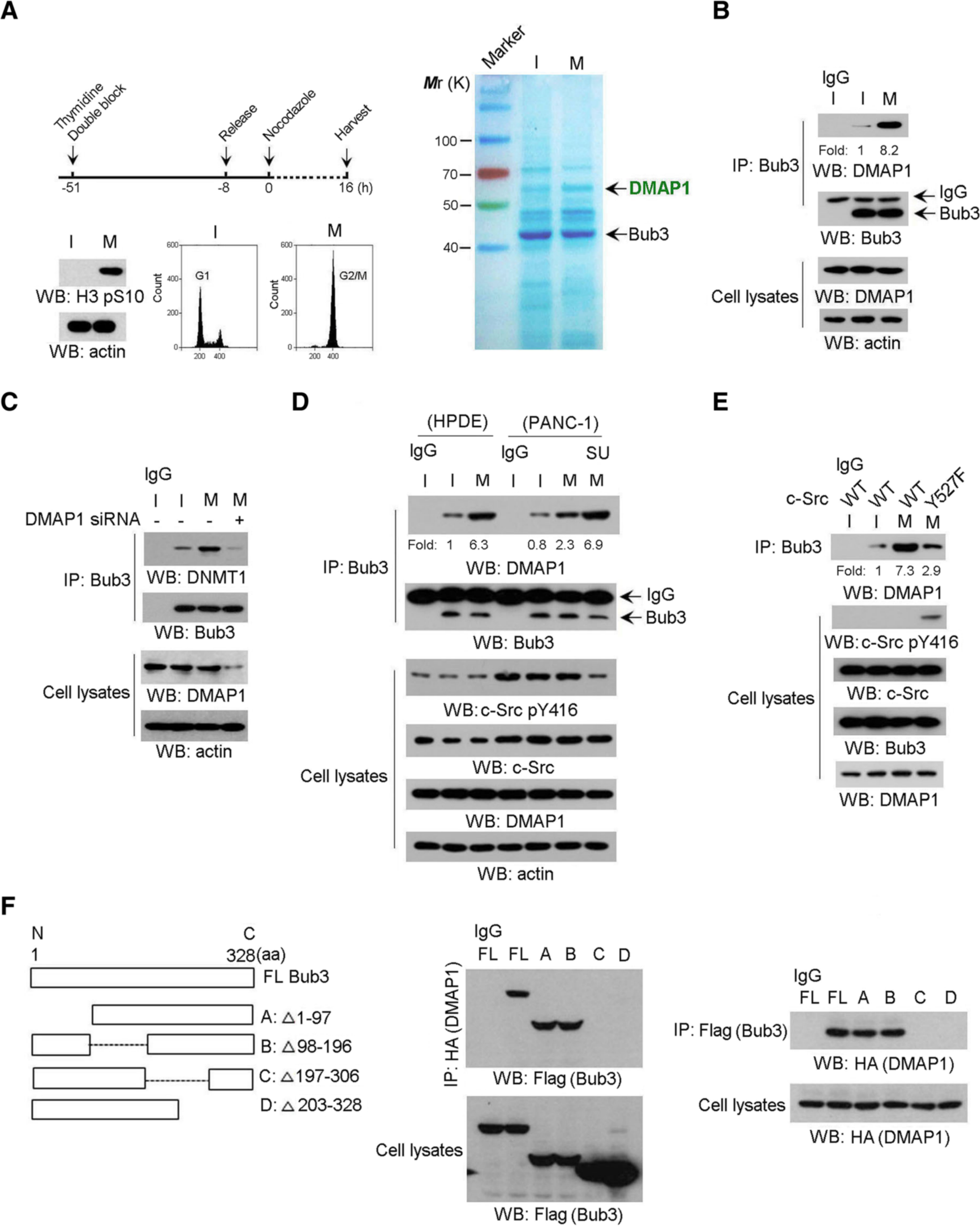
图1 在有丝分裂停滞期间,Bub3与DMAP1相互作用
2、 p38在Ser211磷酸化Bub3并促进Bub3/DMAP1相互作用。
Bub3 / DMAP1相互作用是磷酸化依赖性的,有丝分裂阻滞诱导的Bub3 / DMAP1相互作用被SB203580(p38抑制剂)处理特异性破坏(图2b)。一致的是,用SB203580进行的预处理在具有c-Src抑制作用的情况下很大程度上阻断了细胞中有丝分裂阻滞诱导的Bub3 / DMAP1相互作用(图2c)。这些结果表明p38活性是Bub3 / DMAP1相互作用所必需的。免疫共沉淀分析也表明,有丝分裂阻滞促进了两种细胞(图2d)中p38与Bub3的结合。体外蛋白质磷酸化分析和Scansite分析预测了Bub3的氨基酸序列中两个潜在的p38磷酸化残基。扫描位点分析 (图2f,左侧)和进一步的体外蛋白磷酸化分析表明,只有进化上保守的Ser 211突变为丙氨酸,才能消除p38介导的Bub3磷酸化,这一点在使用特定的Bub3 Ser-211抗体的放射自成像和免疫印迹分析中得到了证实。GST拉检结果表明,p38介导的Bub3 S211磷酸化足以使其与DMAP1结合((图2g),在有丝分裂胁迫下,p38介导的Bub3 S211磷酸化是其与DMAP1结合所必需的。
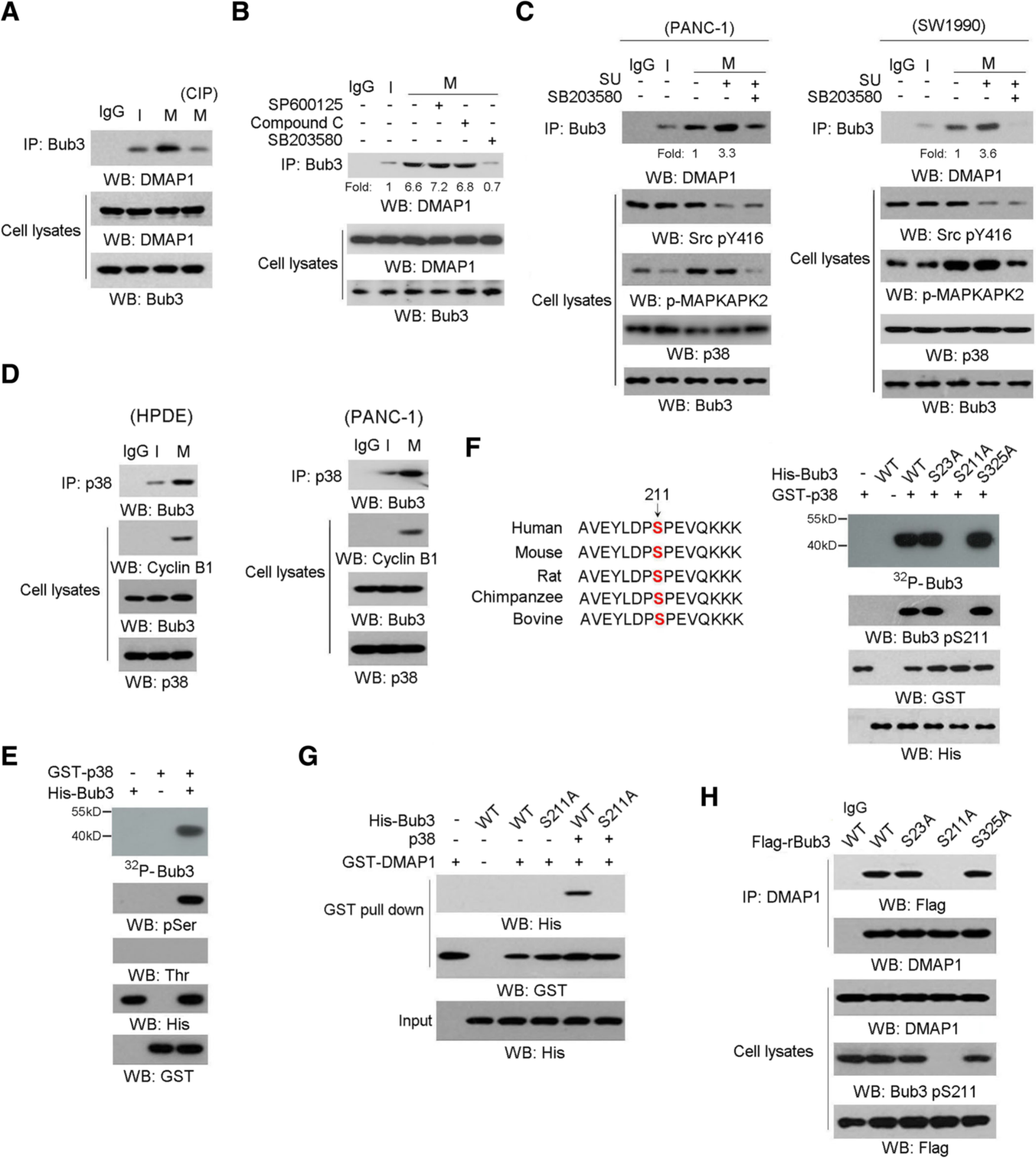
图2 p38在Ser211位点磷酸化Bub3并促进Bub3/ dmap1相互作用
3、C-Src使Tyr246处的DMAP1磷酸化并破坏Bub3 / DMAP1复合物的形成。
c-Src在整个细胞周期中始终与DMAP1相关,而与Bub3无关,且通过Scansite分析,在DMAP1氨基酸序列上发现了许多潜在的Src磷酸化位点;进化上保守的Tyr 246突变为苯丙氨酸的突变消除了Src介导的DMAP1磷酸化(图3a,b)。c-Src介导的DMAP1磷酸化阻碍了Bub3 / DMAP1的相互作用。GST拉检数据(图3d,e)表明c-Src使DMAP1磷酸化不会直接中断Bub3 / DMAP1的相互作用,并且还有另一个未鉴定的成分,例如含有SH2结构域的分子,可以与Bub3竞争,在有丝分裂停滞下与酪氨酸磷酸化的DMAP1相互作用。
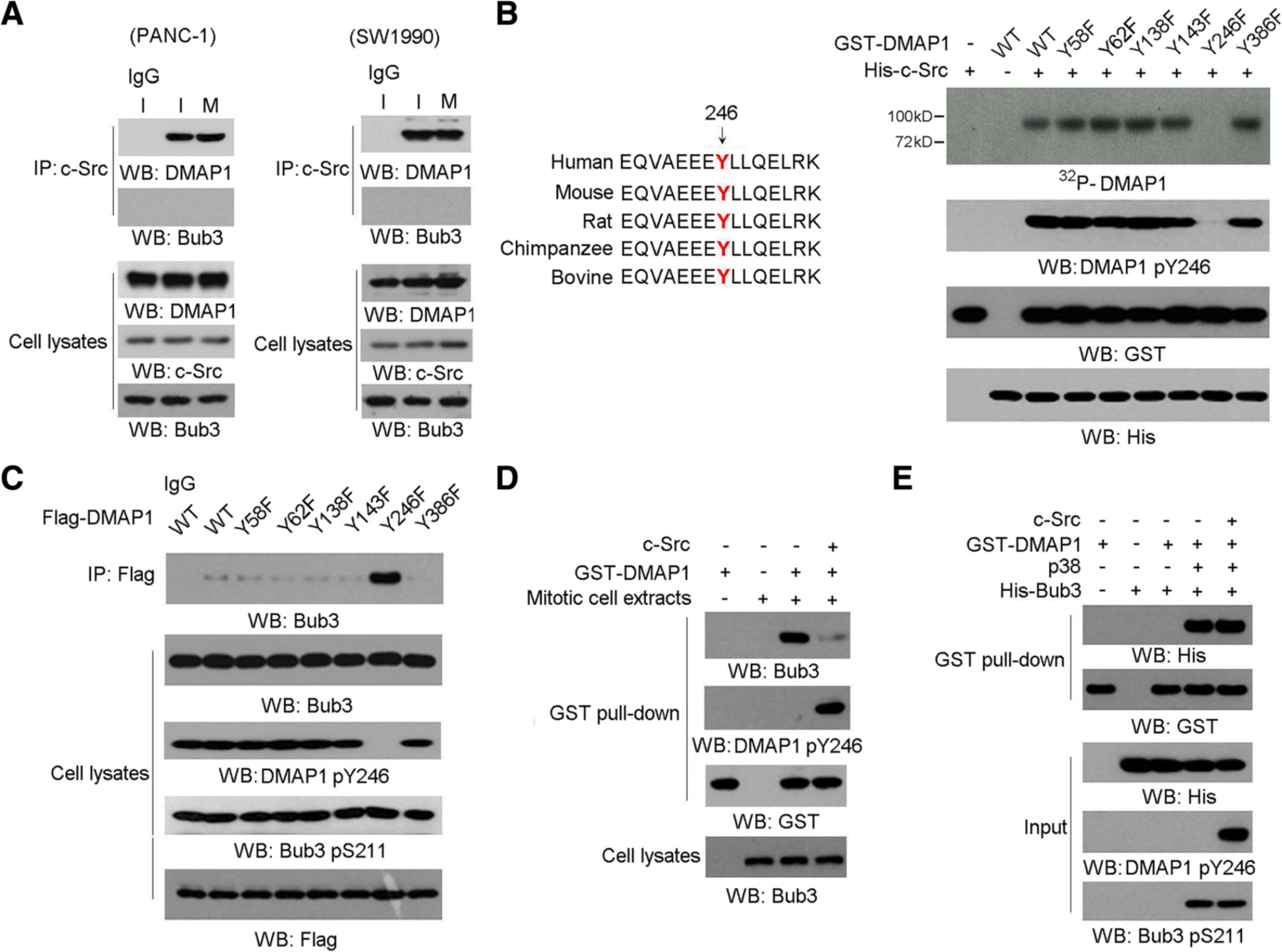
图3 c-Src磷酸化Tyr246处的DMAP1,干扰Bub3/DMAP1复合物的形成
4、C-Src使DMAP1磷酸化并阻止Bub3 / DMAP1抑制的抗凋亡基因转录。
为了研究c-Src介导的DMAP1磷酸化对Bub3 / DMAP1相互作用的抑制作用是否参与有丝分裂后基因转录的调控,作者耗竭了SW1990细胞中的内源DMAP1,并重建了RNAi的WT rDMAP1或DMAP1 rY246F的表达。通过cDNA微阵列分析检查了全局基因表达谱,在表达DMAP1 rY246F的细胞中显示较低水平的许多转录物富含与抗凋亡,炎症和自噬有关的基因,而在表达DMAP1 rY246F的细胞中显示较高水平的转录物与促凋亡或存活维持相关(图4b),并认为被DMAP1 Y246F表达下调的基因是Bub3 / DMAP1复合体的潜在靶标。而Bub3 S211A的表达显著逆转了DMAP1 Y246F抑制的基因转录,同时发现DNMT1消耗消除了DMAP1 Y246F对基因转录的抑制作用(图4c,d)。以上结果结合膜联蛋白V试验,表明在有丝分裂胁迫下,Bub3 / DMAP1复合物可作为抗凋亡基因的转录抑制因子,其作用在具有高水平DMAP1 pY246的肿瘤细胞中受损。
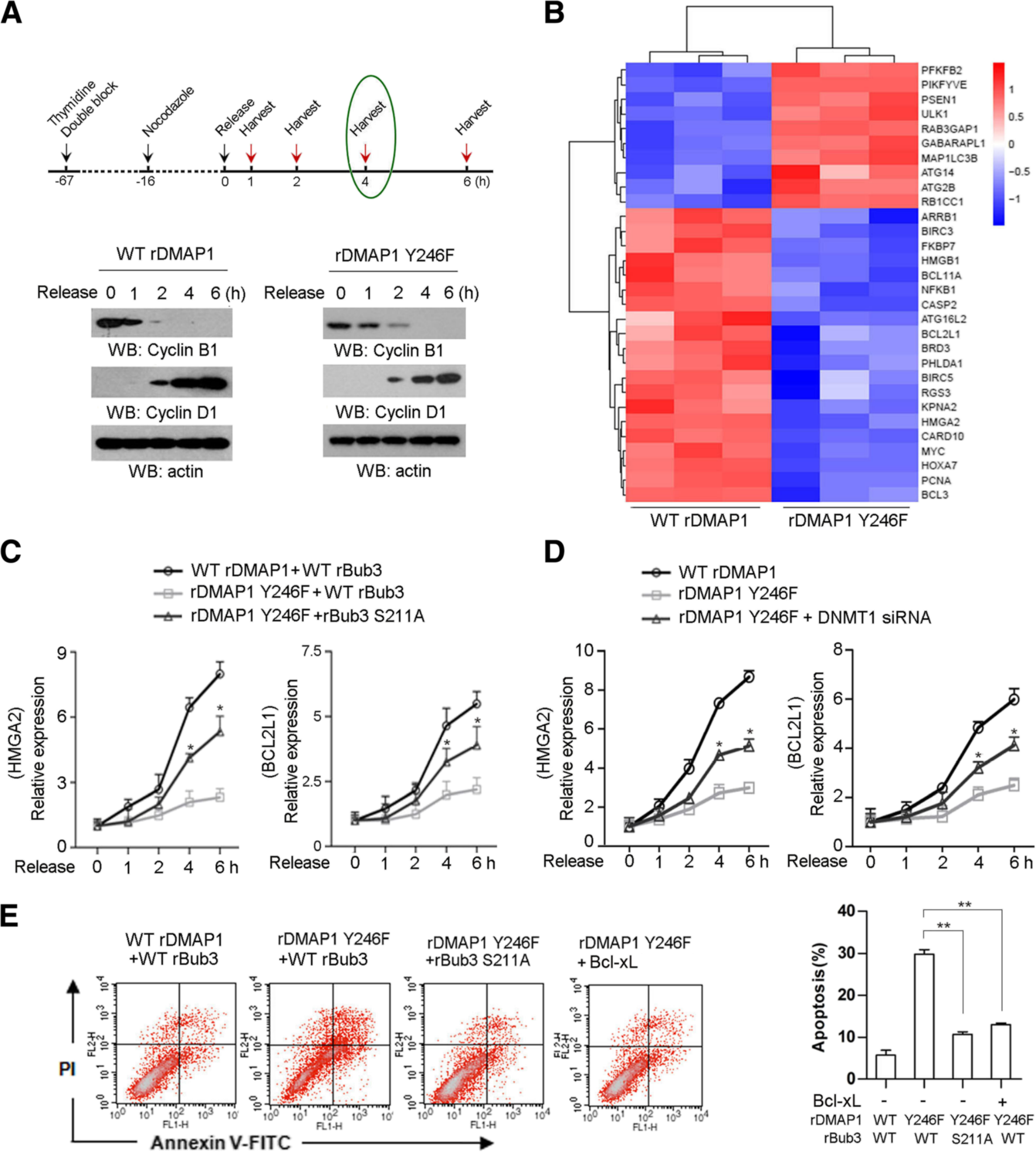
图4 Bub3/DMAP1复合物抑制抗凋亡基因的转录
5、C-Src介导的DMAP1磷酸化阻止Bub3 / DMAP1介导的DNA甲基化。
已知DMAP1/DNMT1与哺乳动物的甲基化有关,为了知道DMAP1 pY246在基因转录中的抑制作用与其对DNA甲基化的潜在作用有关,作者对WT rDMAP1,DMAP1 rY246F或DMAP1 rY246F加rBub3 S211A的重组表达的SW1990细胞进行了WGBS分析。结果表明,DMAP1 rY246F表达增强了富含CpG和缺乏CpG的启动子的DNA甲基化(图5a,左图)。与其他组相比,具有DMAP1 rY246F表达的细胞组在富含CpG岛以及CpG岛的海岸上导致了高甲基化的模式(图5a,右图)。与WT rDMAP1相比,在具有rDMAP1Y246F表达的SW1990细胞的启动子下游区域检测到了CG甲基化的显著升高,这被rBub3 S211A的伴随表达显著逆转(图5b)。总的来说,这些结果表明DMAP1 pY246在基因组的整体DNA甲基化中起负作用,而DMAP1-Bub3复合物的形成是特定基因DNA甲基化所必需的。Bub3与有丝分裂阻滞期间的转录因子TAp73相关,TAp73耗竭逆转了用DMAP1 Y246F表达的SW1990细胞中的BCL2L1转录,序列分析和ChIP分析表明TAp73在覆盖有丝分裂结合位点的启动子区域富集(图5e)。此外,还发现在SW1990细胞的有丝分裂停滞下,BCL2L1启动子相关的Bub3,Bub3 S211磷酸化(图5f)也显著增加。这些数据表明,TAp73负责启动子中Bub3和DMAP1复合物的积累,其中Bub3 S211磷酸化对于DMAP1 / DNMT1募集是必不可少的。
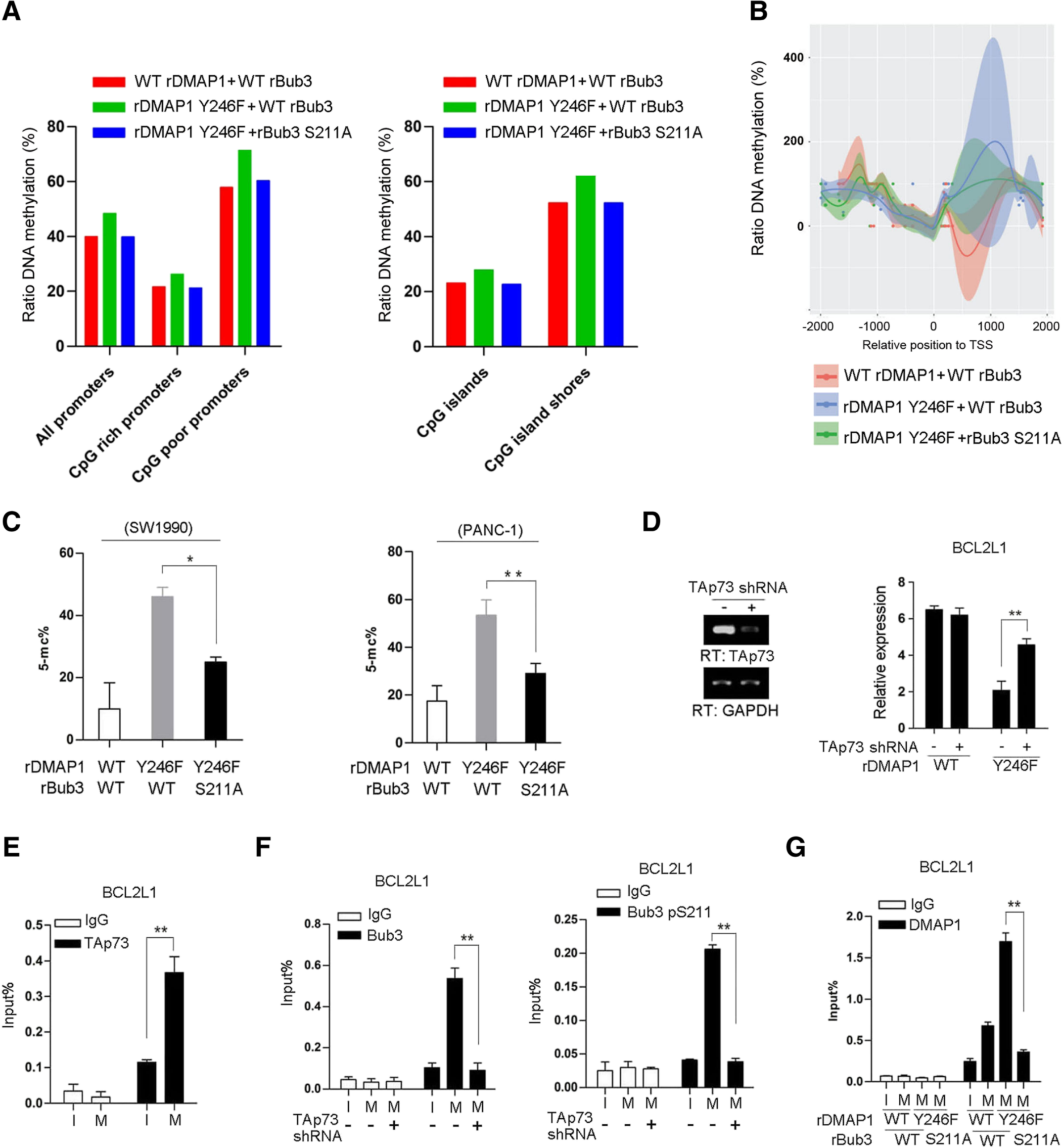
图5 c- src介导的DMAP1磷酸化可阻断DMAP1介导的DNA甲基化
6、DMAP1 Y246磷酸化可抵消紫杉醇的体内抗肿瘤活性。
c-Src介导的DMAP1 Y246磷酸化通过抑制有丝分裂阻滞下的Bub3 / DMAP1相互作用来促进肿瘤细胞存活(图4e),接下来作者通过动物模型确定其在肿瘤发生中的意义。裸鼠实验表明,具有WT rDMAP1表达的肿瘤细胞仍然能够通过紫杉醇治疗引起快速的肿瘤发生(图6a和b)。相反,rDMAP1 Y246F的表达很大程度上抑制了肿瘤的生长。但是,rDMAP1 Y246F的抑制作用被rBub3 S211A的共表达所阻断。这些数据表明DMAP1 Y246磷酸化对Bub3 / DMAP1相互作用的抑制作用促进了肿瘤的发展。为了进一步确定该发现的临床意义,作者通过免疫印迹和IHC分析了人类胰腺肿瘤标本中DMAP1 pY246的水平,并通过DMAP1 Y246磷酸化水平的高和低评估了患者的生存时间(图6e),发现那些具有高DMAP1 pY246水平的肿瘤(61例)的中位生存期显著降低,揭示了DMAP1 Y246磷酸化与人类胰腺癌患者预后不良之间的紧密关系。
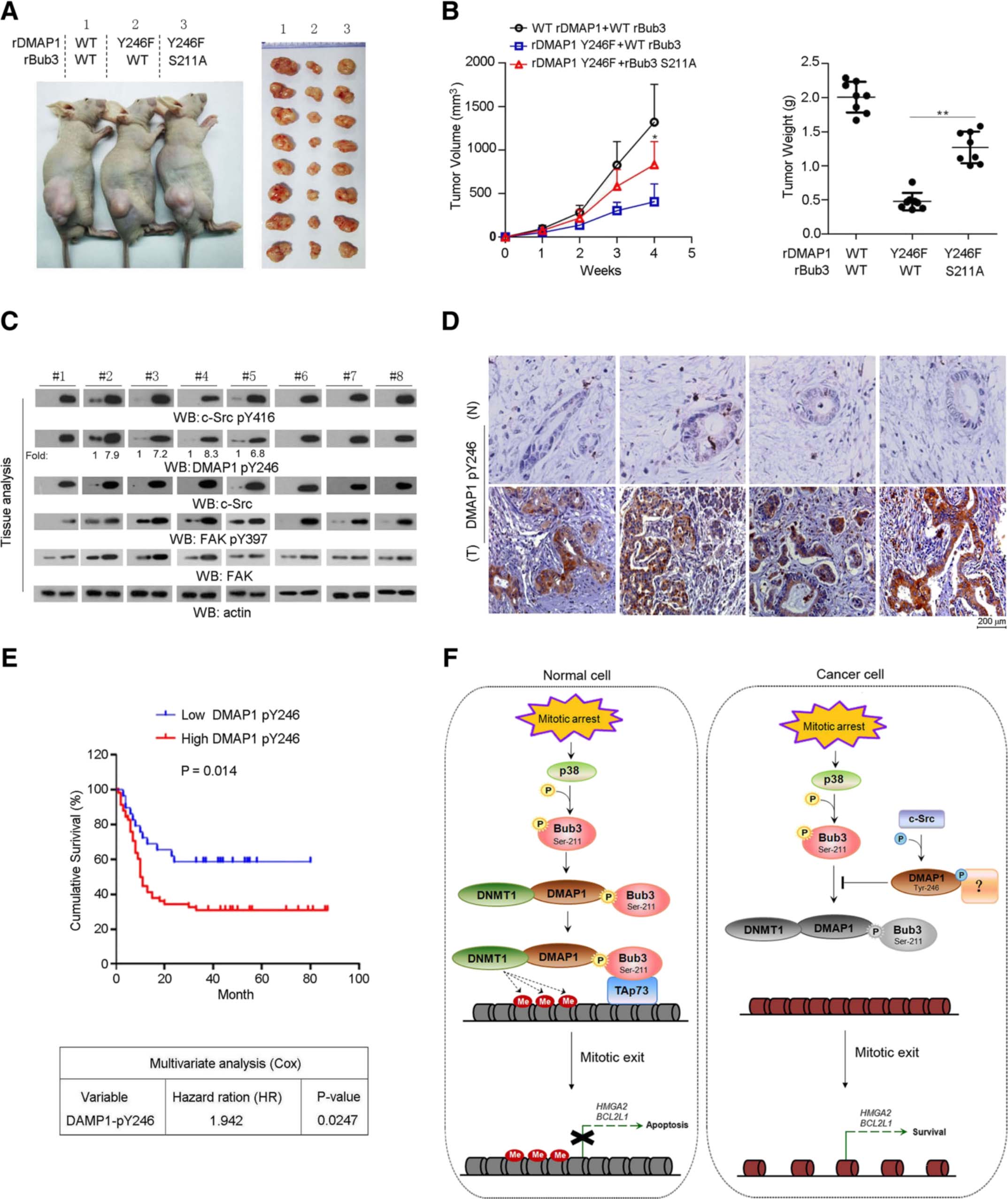
图6 肿瘤发生需要DMAP1 Y246磷酸化
结论
作者的发现表明,Bub3 / DMAP1复合物对于有丝分裂阻滞后的响应基因表达至关重要,并证明在有丝分裂应激下癌细胞的生存优势依赖于c-Src对Bub3 / DMAP1介导的凋亡的抑制作用。有丝分裂停止后,Bub3在基因激活中的新作用得到了确认,这为我们提供了一种新的视角,以了解表观遗传修饰因子是如何根据环境信号不断调节的。另外,c-Src对Bub3/DMAP1/DNMT1轴的抑制作用阐明了癌细胞抵抗有丝分裂应激的关键途径,这一发现为提高c-Src活性上调的抗有丝分裂治疗的胰腺癌的治疗水平提供了重要的分子基础。
本研究的WGBS测序和数据分析工作由上海派森诺生物科技股份有限公司完成。
原文索引:
Li, J., Hu, B., Wang, T., Huang, W., Ma, C., Zhao, Q., … Jiang, Y. (2018). C-Src confers resistance to mitotic stress through inhibition DMAP1/Bub3 complex formation in pancreatic cancer. Molecular Cancer, 17(1).doi:10.1186/s12943-018-0919-5