
2020-07-17

发表期刊:《Food Chemistry》
影响因子:6.306
最近,派森诺与安徽省固态发酵工程技术研究中心合作,在《Food Chemistry》再次发表论文,联合微生物组测序、定量qPCR和代谢组检测,全方位研究高品质酿酒酵池(老窖)与一般品质酵池(新窖)中的微生物群落结构、理化性质,从而探究酿酒品质与酵池微生物群落的关系,以扩展对酿酒酵池底部窖泥衰老过程的认识,促进窖泥的原位改善,为打造更优质的人工窖泥打下坚实基础。
白酒,自古以来一直是我国饮食文化中的重要组成部分。传统的白酒发酵,也是我国十分重要的工业领域。目前的研究表明,在传统白酒的酿造过程中,微生物对白酒的品质、风味都起着至关重要的作用。
不过,以往的相关研究,主要基于窖泥的表面微生物群落,而窖泥不同深度或不同水平部位的理化性质不同,这可能会使得微生物在窖泥中呈不均匀分布。因此,我们有必要从不同维度去研究窖泥中的微生物群落结构及其相应的理化性质,从而增强对酿酒酵池窖泥衰老过程的认识,并应用于生产实践中。
研究不同品质酿酒酵池的底部窖泥中,不同部位、不同深度下的微生物群落构成、理化因子和代谢物含量,探究影响白酒品质的具体因素。
测序技术:Illumina MiSeq高通量测序平台
测序模式:微生物组16S rRNA基因V4区
实验对象:窖泥
本研究在中国安徽省亳州市选取了6个A等(50年以上,高质量)酿酒酵池,6个C等(6年,一般品质)的酿酒酵池;,分别从不同维度采集底部窖泥:每个酒窖取4个深度(0–1 cm、1-3 cm、3-5 cm、5-7 cm),每个深度取3个部位(center、quarter和corner),共144个样本。具体采集方式如表1与图1所示。
采集的样本一部分用于高通量测序,测定样本中的原核微生物群落结构,另一部分用于测定水分、pH、氧化还原电位、NH4+-N等理化性质,并使用气相色谱法测定乙醇、乙酸、丙酸、丁酸、戊酸,使用超高效液相色谱(UPLC)测定乳酸。
表1 样本采集方式
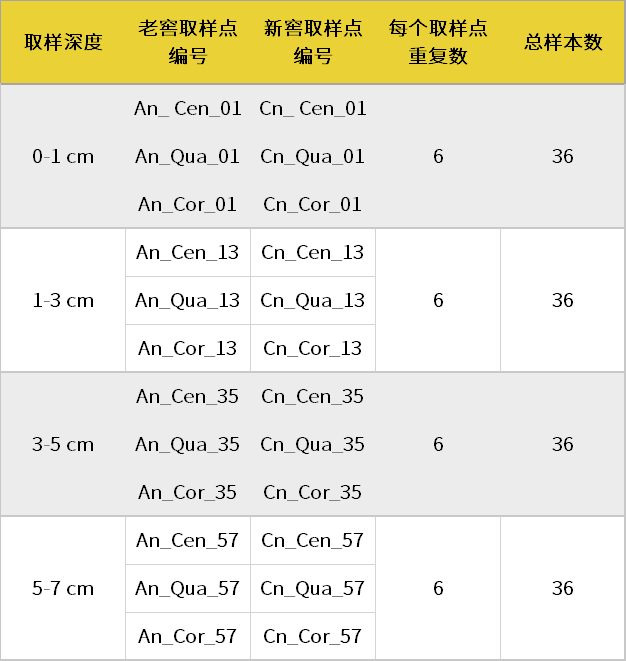
注:A,50年以上A等窖;C,6年C等窖;n:1-6号酒窖
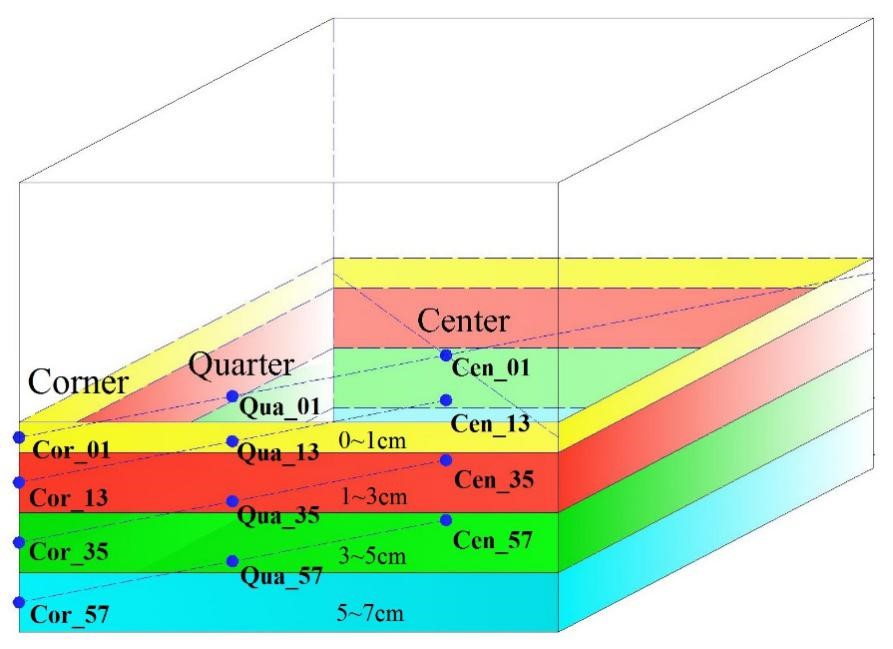
图1 每个酵池的取样示意图
1、不同品质窖泥中的Alpha多样性
新老窖池中各个取样点的微生物群落多样性如表2所示。纵向看,老窖中,0–1 cm深度样本的Shannon多样性指数与Chao1和OTUs丰富度指数明显低于其它三个深度(但不显著),而新窖中4个深度下的Shannon多样性指数与Chao1和OTUs丰富度指数均没有显著差异。
横向看,老窖中,同一深度下不同部位的各Alpha多样性指数均没有显著差异;新窖中,1-3cm深度下,Center处的样本多样性指数均与Corner处的样本显著不同。而quarter处的样本只有Shannon多样性指数与Corner处样本有显著差异。
表2 新旧酵池不同取样部位的Alpha多样性指数

2、不同品质窖泥中的Beta多样性
基于Weighted unifrac distances的NMDS分析结果显示(图2),在所有的24个采样位点中,12个老窖和12个新窖采样点的样本被分为了两个区域,这表明,老窖与新窖中的原核微生物群落结构存在明显差异。
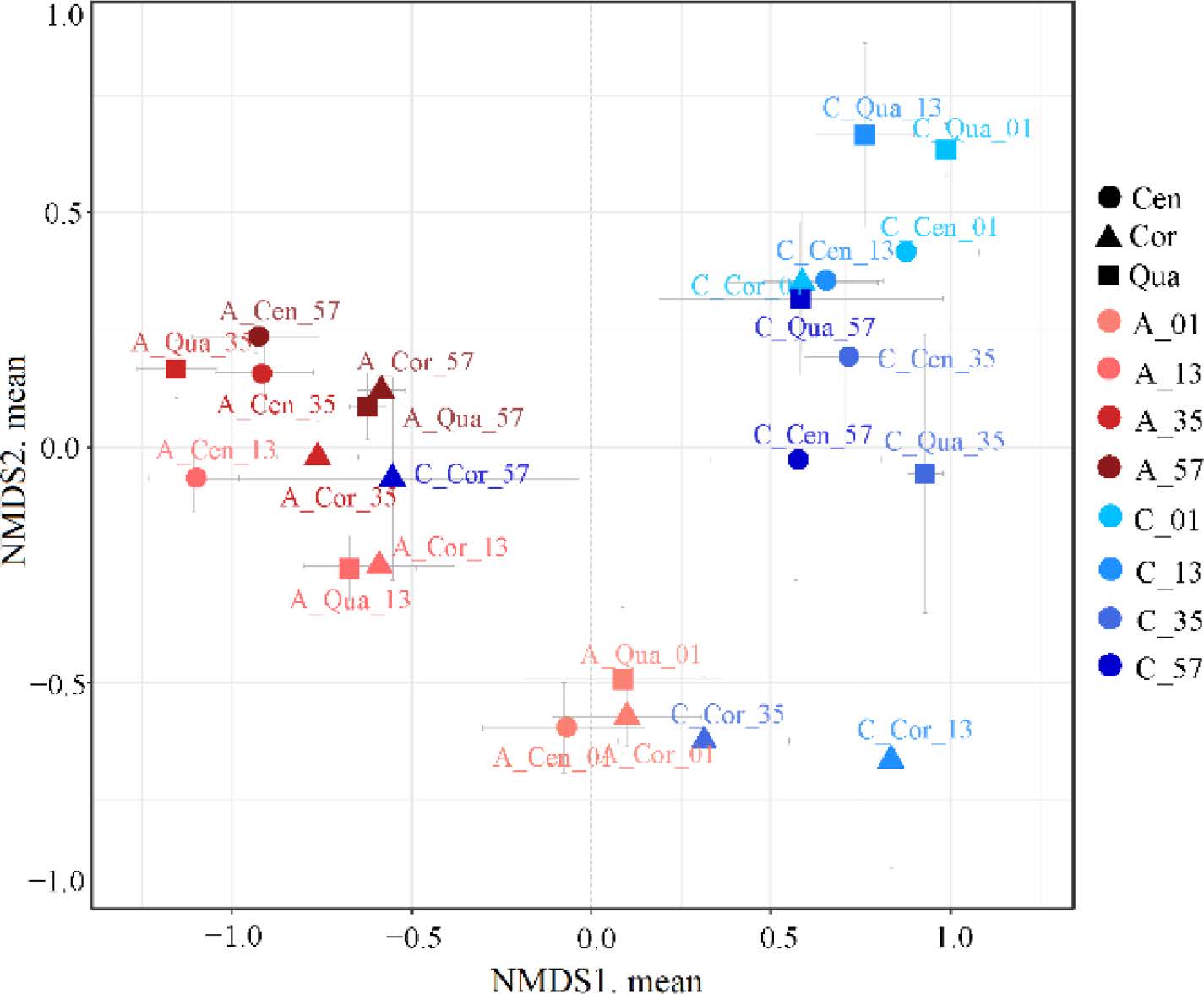
图2 基于weighted unifrac distances的NMDS分析结果
显著差异热图与基于Weighted unifrac distances的boxplot结果也显示,老窖中,同一深度下不同位点的微生物群落差异较小;而新窖中,不同深度下中心取样点的样本(C_Cor_13,C_Cor_35和C_Cor_57),微生物群落结构均与其它样本差异明显,且这三个中心取样点彼此之间差异也很大;同时C_Cen_01和C_Qua_01之间的差异也小于其它取样点的差异。
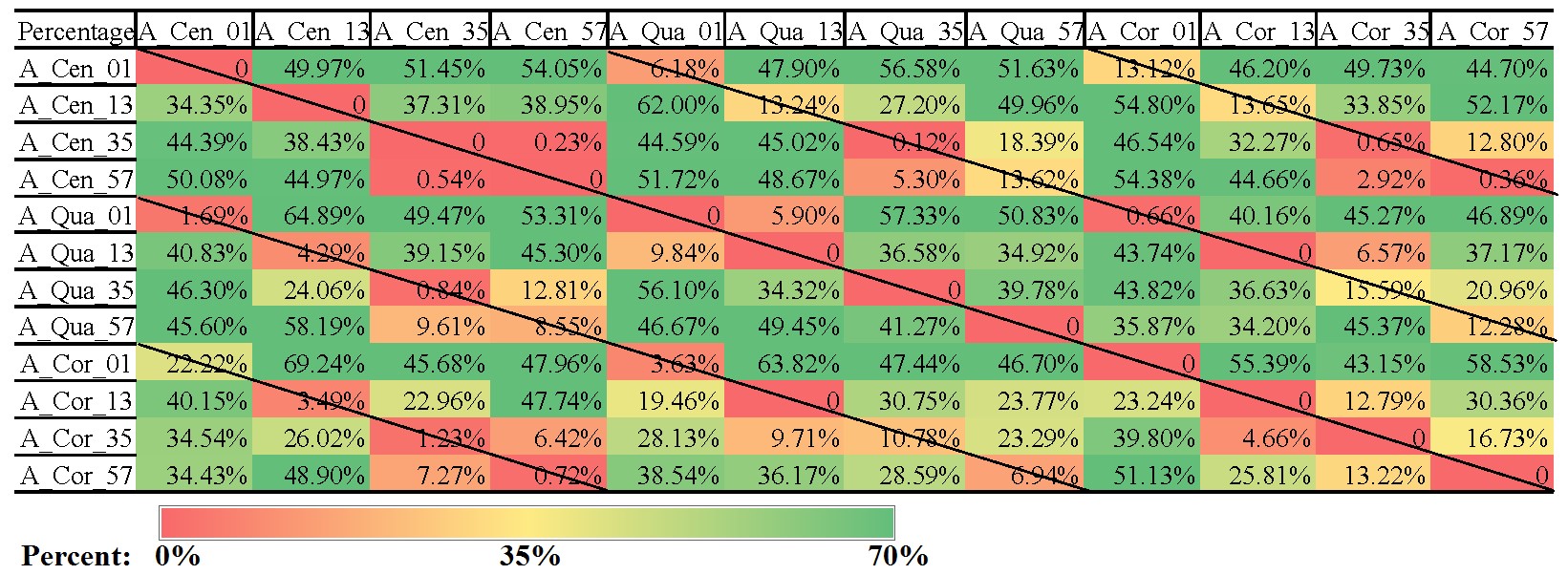
图3 显著差异热图
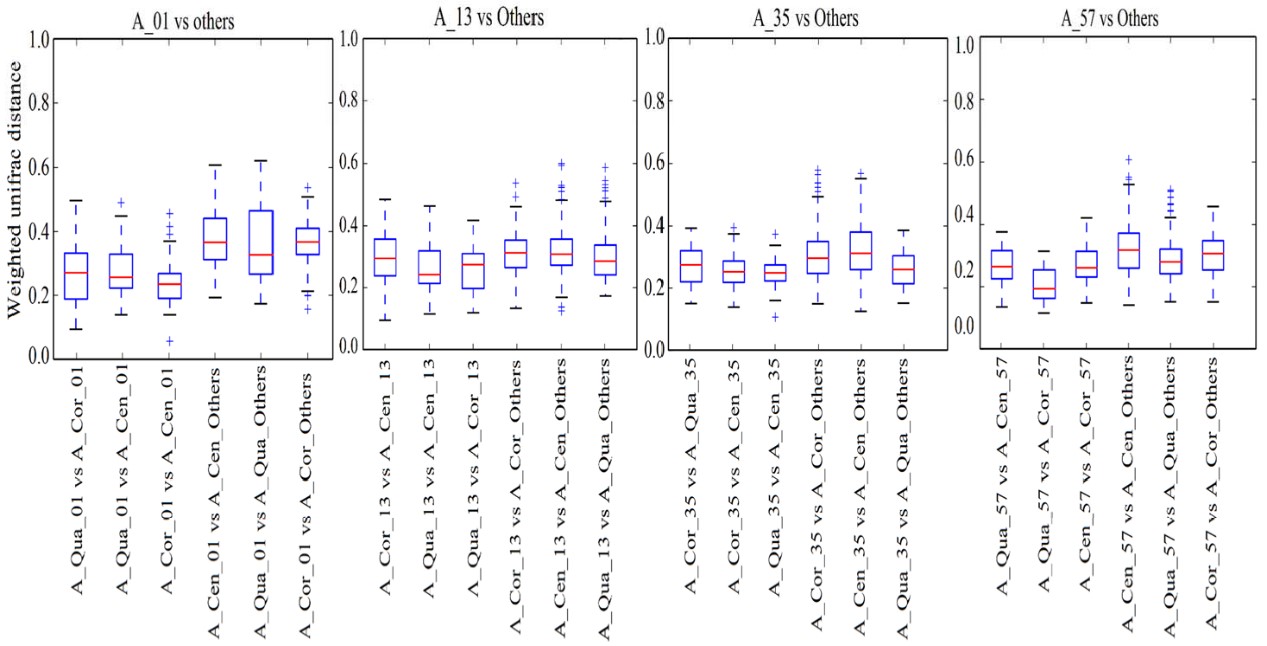
图4 基于Weighted unifrac distances的boxplot
根据以上Beta多样性的分析结果,在后续分析中,作者将取自老窖同一深度下的3个取样点结合在一起,组成4个具有代表性的分组:A_01、A_13、A_35和A_57;而新窖则分为5个组:C_Cen_Qua_01、C_Cor_13、C_Cor_35、C_Cor_57和C_C_Others。
3、酿酒酵池底部窖泥的菌群组成分析
从物种组成上看,新窖中的内部微生物群落差异要明显大于老窖,且C_Cor_57样点中的微生物群落结构与老窖更相似。在门水平上,新老酒窖中的微生物群落差异主要体现在这几个门类:Bacteroidetes,Proteobacteria,Euryarchaeota,Synergistetes和Tenericutes;在属水平上,各分组属水平上的优势微生物组成如图2A所示。UPGMA聚类分析的结果(图2B)显示,A01与4个新窖中的代表性窖泥样本更接近,而C_Cor_57则与3个老窖中的代表性样本更接近。
在老窖中,大部分微生物类群实际上都没有显著差异。不过,值得注意的是,Caproiciproducens和Hydrogenispora,这两个微生物类群,在分布模式上,呈现相反的梯度分布,Caproiciproducens在A_01样本中有大丰度,而Hydrogenispora则在A_57中有高丰度,另外,Caproiciproducens主要存在于0-1 cm处。
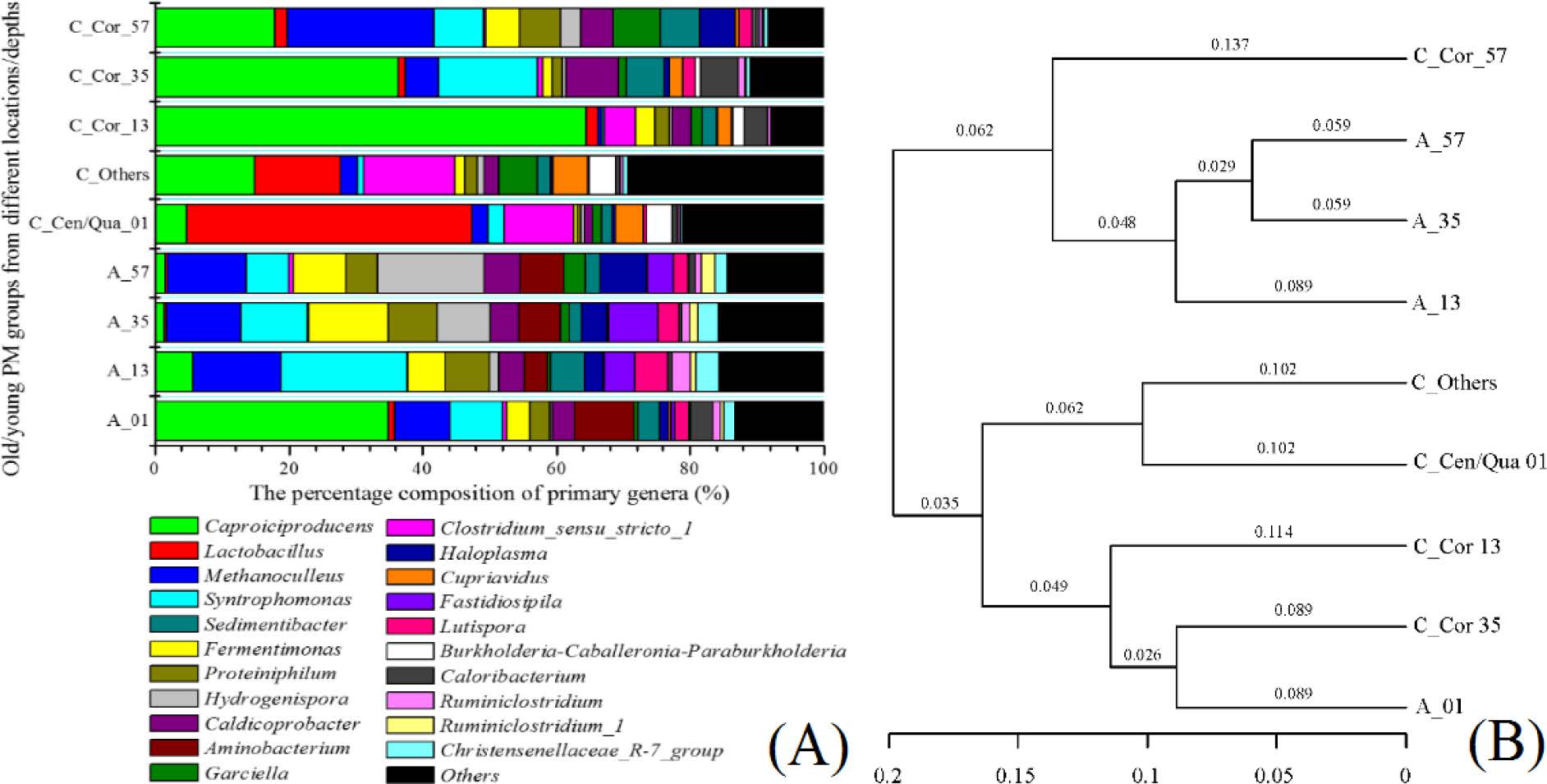
图5 底部窖泥中,九个代表性位点分组中的优势属构成(A)及其对应的UPGMA聚类分析(B)
4、16S rRNA基因的拷贝数定量分析
24个取样位点的16S rRNA基因拷贝数如图3所示,大部分取自老窖的样本,基因拷贝数都显著高于取自新窖的样本(ANOVA,P < 0.05),同时,新窖样本中的Cor_35和Cor_57与老窖样本更接近。
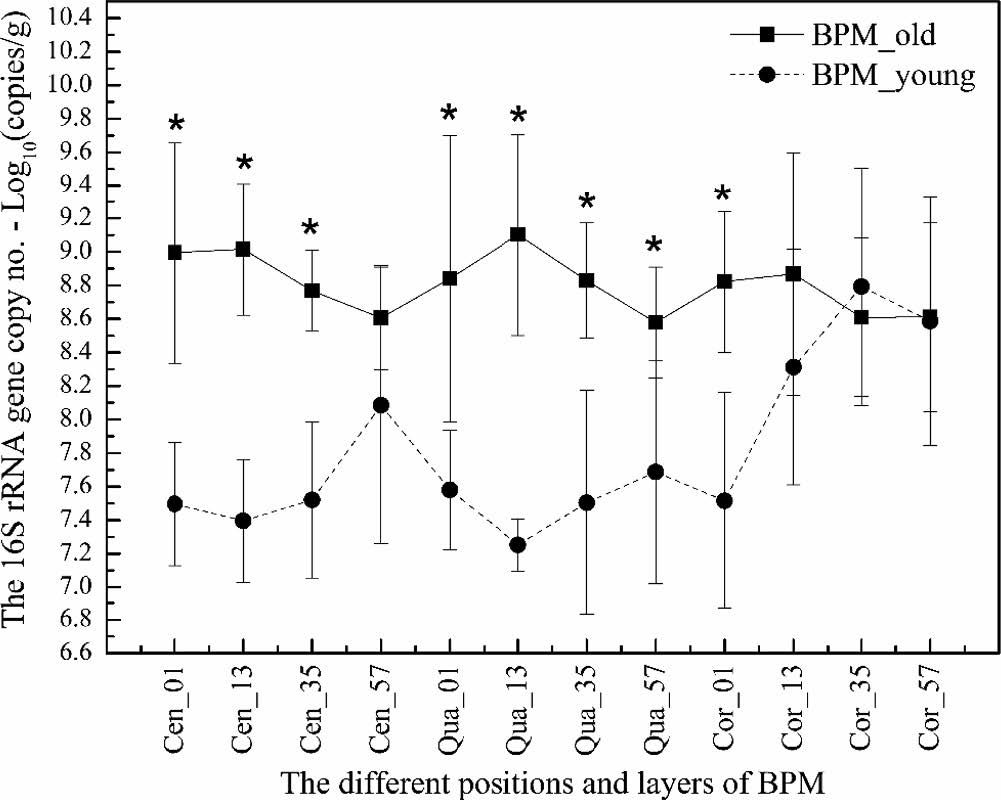
图6 24个取样位点的16S rRNA基因拷贝数分析
5、理化性质与代谢物分析
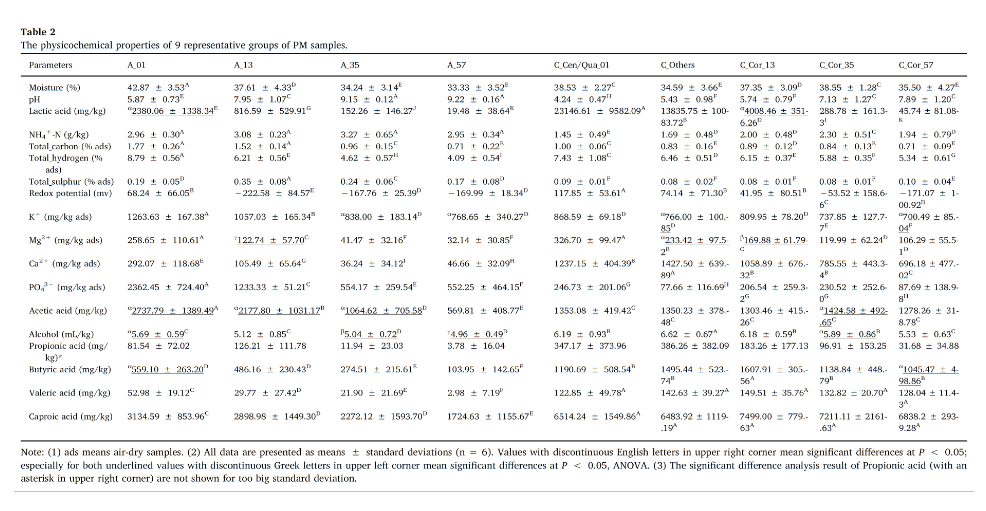
每个代表性位点分组的理化性质和代谢物含量如表3所示。在老窖样本中,大部分理化性质都有从表层到底层逐渐递减的趋势,这表明老窖中的主要理化属性呈梯度分布。同时,与老窖相比,新窖中的Ca2+,Mg2+,丙酸,戊酸,己酸,丁酸和乙醇含量均要显著高于老窖,而NH4+-N、总硫、K+、乙酸和PO43−在新生BPMs中均显著降低。
表3 9组代表性窖泥位点中的理化性质与代谢物含量
6、微生物群落与理化性质、代谢物之间的关联性
RDA冗余分析(图7)显示,理化性质和代谢物的分布特征,与菌群组成具有显著相关性。其中,对微生物群落结构影响显著的三个因子为:乳酸(35.1%)、pH(27.7%)和可溶性Ca2+(8.1%)。同时,大部分老窖样本和新窖样本在RDA分析中是明显分离的,而C_Cor_35和C_Cor_57则与取自老窖表面的样本距离较小,这表明,C_Cor_35和C_Cor_57的原核微生物群落正处于老化的过程。另外,乳酸、可溶性Ca2+、丙酸、戊酸、可溶性Mg2+、氧化还原电位、乙醇、己酸、丁酸,均与新窖中的微生物群落结构存在很强的正相关性;而pH、NH4+-N和总硫,则和老窖中的微生物群落结果有强正相关性。
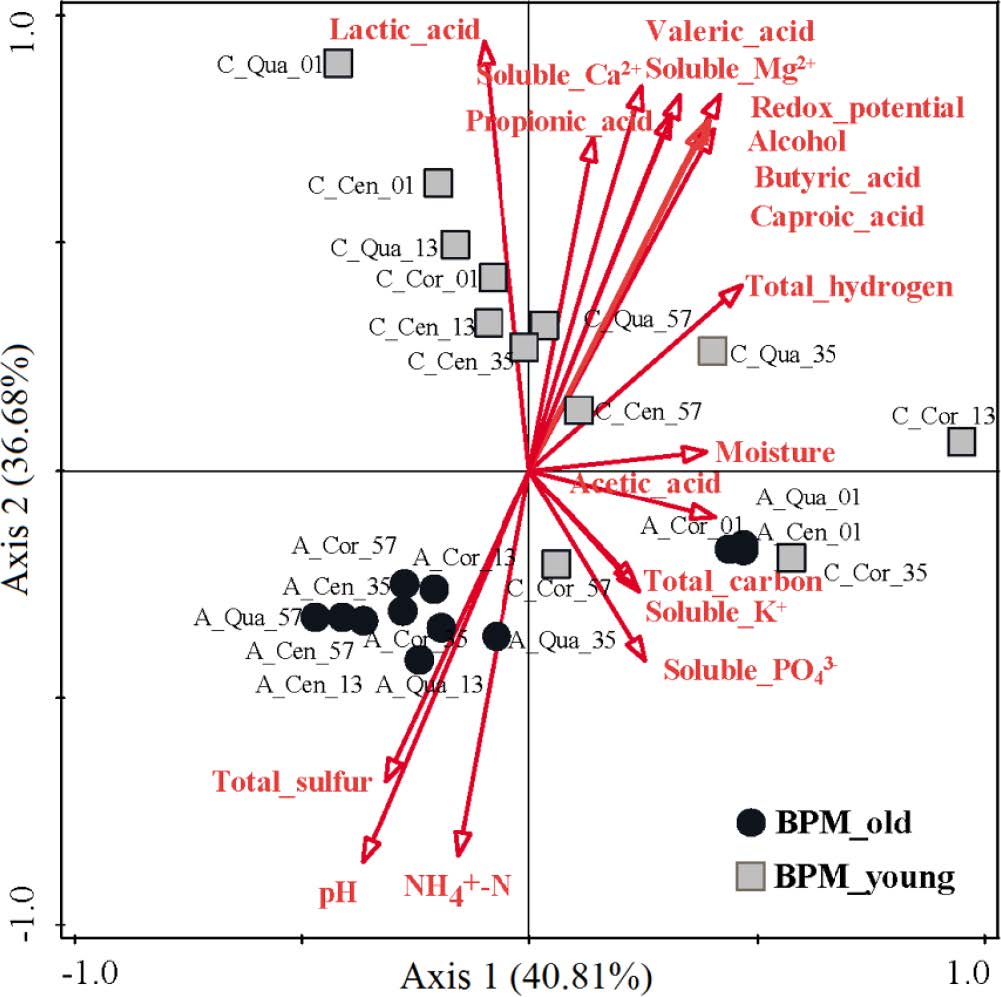
图7 底部窖泥各位点的细菌菌群、理化因子和代谢物之间的冗余分析
本文结合了微生物组16S rRNA基因测序、定量qPCR和代谢组检测,分析了不同品质酿酒酵池的底部窖泥中,各部位微生物群落对于酿酒品质的潜在影响,并得到以下结果:
1、老窖中的菌群结构在垂直深度上有差异,但在水平位置上没有明显差异,这表明,多年的循环发酵在老窖中形成了固定的菌群梯度结构;
2、老窖表面0–1 cm处的微生物主要以Caproiciproducens(34.79%)为主;
3、新窖0-7 cm处的quarter部位,微生物主要以Lactobacillus(12.80%–42.72%)为主,而底部中心的微生物群落则是以Caproiciproducens(17.85%–64.45%)为主;
4、乳酸、pH与可溶性Ca2+是对窖泥微生物群落结构影响显著的三个因子。
老窖中,0-1cm处的优势微生物Caproiciproducens(34.79%)可作为保护性屏障,阻止乳酸菌Lactobacillus的入侵,促进酒窖深处厌氧菌的生长;新窖则在深处(尤其是3~7cm处)的中心位置开始建立Caproiciproducens屏障,而乳酸菌仍在其它位置占优势地位。由此可知,新窖中尚未形成完整的代谢链以降解各种酸性物质,但其深处的中心部位也因其位点优势,窖泥菌群正在逐渐成熟,进而形成完整的代谢链。
本研究的测序和部分数据分析工作由上海派森诺生物科技股份有限公司完成。
文章索引:
Zhang H ,Meng Y ,Wang Y ,et al. Prokaryotic Communities in Multidimensional Bottom-Pit-Mud from Old and Young Pits Used for the Production of Chinese Strong-Flavor Baijiu[J]. Food Chemistry, 2019, 312:126084.
原文链接:
https://www.sciencedirect.com/science/article/abs/pii/S0308814619322332