
2020-10-14

发表期刊:Molecular Therapy: Nucleic Acids
影响因子:7.032
● 文章题目:Identification of ncRNA-Mediated Functions of Nucleus-Localized miR-320 in Cardiomyocytes
● 技术手段:miRNA芯片,荧光原位杂交,RNA-seq,qRT-PCR,CRISPR/Cas9,chip-seq,RIP-seq,LC-MS,ChIRP(ChromatinIsolation by RNA Purification)
派森诺生物与华中科技大学同济医院携手合作,于2020年在Frontiers in Microbiology上发表了ncRNA介导的心肌细胞核定位miR-320功能的鉴定,本研究中的RNA-seq,chip-seq和RIP-seq等工作由上海派森诺生物科技股份有限公司完成。
近年来,对microRNAs (miRNAs)亚细胞分布的系统分析表明,大多数miRNAs同时存在于细胞核和细胞质间。然而,核miRNA在心肌细胞中的完整功能目前尚不清楚。通过miRNA芯片技术,实验揭示了大多数miRNAs在心肌细胞的核和细胞质部分都可以检测到。作者通过前期实验已经鉴定了miR-320、miR-30c和miR-21-3p在心血管疾病中的典型作用,这些miRNA也在细胞核中被检测到,并通过原位杂交在正常人心脏样本中确认了miR320在细胞质和细胞核中的表达,因此本研究以miR-320为例探索核定位miRNAs的功能。
核miR-320靶点的识别
核小RNA被认为是通过与基因启动子结合来调控基因转录的。利用microPIR数据库识别miR-320在细胞核中的潜在靶点,结合miR-320处理的H9c2心肌细胞的mRNA-seq分析结果,鉴定了12个有功能的基因(图1A)。这些基因大部分在H9c2细胞中通过qRT-PCR成功验证(图1B)。
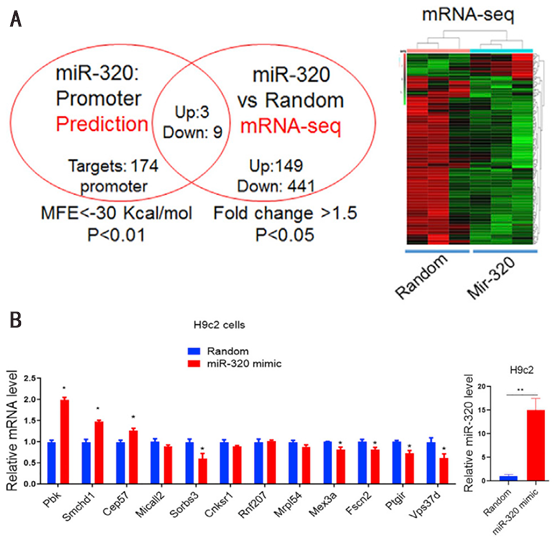
图1 细胞核中miR-320靶点的识别
大部分启动子结合位点在小鼠、大鼠和人类物种中均保守。通过CRISPR/Cas9方法产生Ago2敲除的AC16细胞(图2A),然后在Ago2敲低(kd)细胞中,重新表达携带核靶向信号肽(Ago2nls)的Ago2,Ago2nls转位至细胞核(图2B),恢复mir -320介导的核靶基因调控(Cep57、Sorbs3、Mex3a、Fscn2、Ptgir和Vps37d)(图2C),这些数据为细胞核中Ago2/miR-320在转录控制中的直接作用提供了强有力的支持。
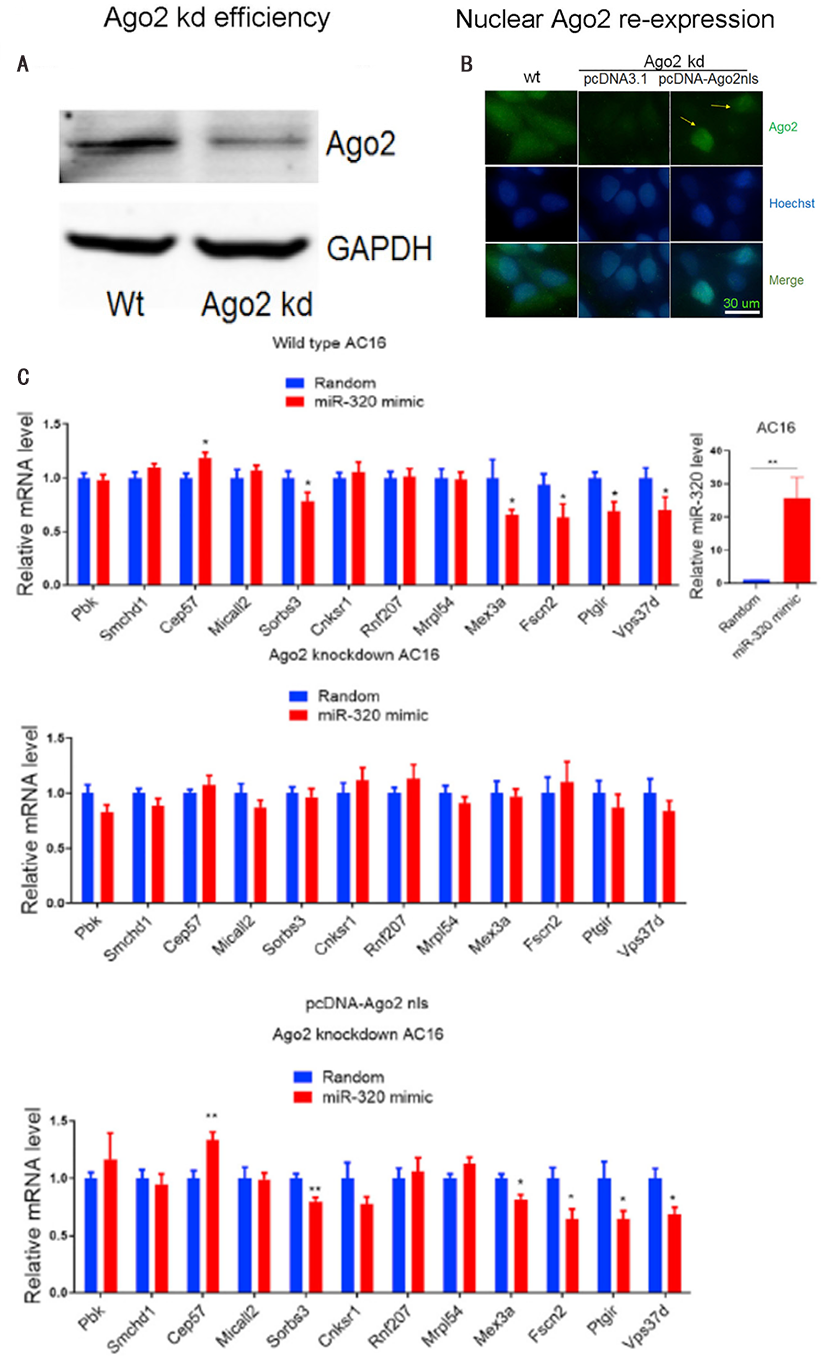
图2 细胞核中Ago2/miR-320在转录控制中的作用
启动子RNA可能参与Ago2-DNA结合
为了进一步研究DNA-Ago2/miRNA结合事件,作者在体内正常小鼠心脏上进行了Ago2-ChIP-seq。在部分基因的启动子区域分别观察到清晰的Ago2结合峰(图3A)。而对于其他基因,结合峰不显著(图3B)。为了探究原因,通过转录组测序,观察到Ago2靶向启动子RNA的大量表达(图3C)。相反,结合峰不显著的基因很少、甚至检测不到启动子RNA的表达(图3D),但是Sorbs3例外,虽然与Ago2结合低,但是仍可以检测到大量的启动子RNA(图3D),启动子RNA可能是必要的,但不足以让Ago2与Sorbs3启动结合。这些初步数据表明启动子RNA可能参与Ago2 -启动子结合事件。
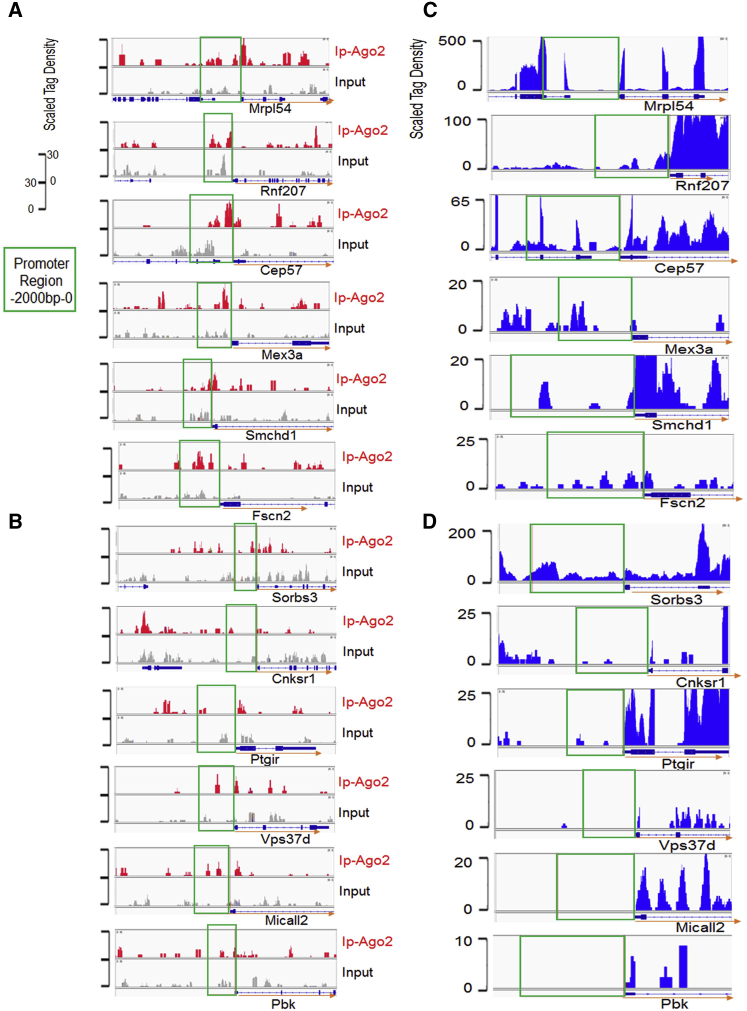
图3 Ago2-ChIP-seq 与RNA-seq
Ago2/miR-320工作模型
研究通过Ago2- chip -seq探索体外Ago2/miR-320启动子的结合机制,检测到miR-320 mimic处理增强了HL-1细胞中Ago2与Cep57、Fscn2、Mex3a和Ptgir启动子的结合(图4A)。为了确定Ago2/miR-320是靶向DNA还是靶向启动子RNA,进行了RIP-seq来确定Ago2和基因启动子RNA之间的关联(图4B-D)。这些数据表明,尽管启动子RNA本身可能不是Ago2/miR-320的直接靶向,Ago2/miR-320结合在基因启动子上是启动子RNA依赖的。此外,通过ChIRP分析显示,mir -320处理的心肌细胞中Cep57和Fscn2启动子RNA在其启动子DNA上的结合事件降低(图4E)。根据这些数据,作者提出当没有启动子RNA时,miRNAs可能无法与DNA结合(图4F)。如果启动子RNA存在,则DNA启动子可能不稳定,并可与miRNA结合(图4G)。
通过液相色谱-质谱(LC-MS)测定细胞核中的Ago2/miR-320辅助因子,4个蛋白通过miR-320过表达可能与细胞核Ago2相关(图4H)。在这些蛋白中,Ylpm1和Ssbp1是转录因子,它们可能共同参与Ago2/ mir -320介导的转录调控。
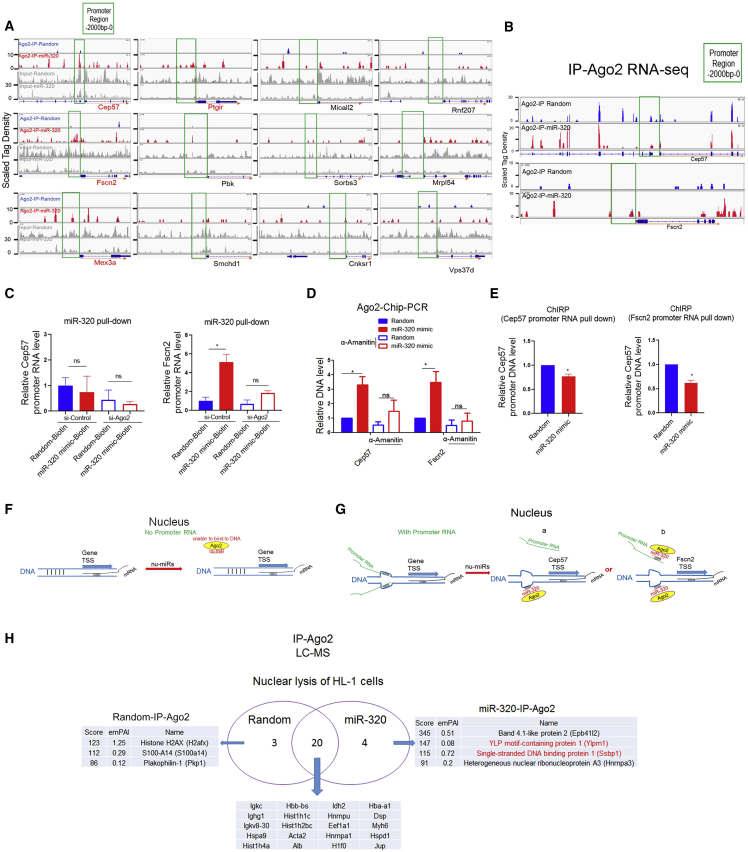
图4 启动子ncRNAs参与miR-320-DNA的结合
miR-320的激活/抑制作用可能取决于启动子RNA
miR-320被预测靶向313个sense启动子和300个antisense启动子(图5A)。然而,通过miR-320 mimic处理,没有观察到sense和antisense结合有显著的激活或抑制差异 (图5B)。在613个心肌细胞表达的miR-320靶基因中,有62个基因被miR-320显著调控(图5C)。数据表明,miR-320结合链(正义或反义)的选择可能无法决定miR-320的激活或抑制作用。启动子RNA如果是从下游基因的同一条DNA链转录而来,则被归类为“sense”,对被miR-320显著调控的检测到启动子RNA的48个基因进行分类(图5D),启动子RNA大部分为antisense RNAs。
当检测到antisense启动子RNA时,miR320处理导致了12个基因的激活和14个基因的抑制。然而,当存在sense启动子RNA时,7/8和12/14基因被miR-320下调(图5E)。以Cep57和Fscn2为例,Cep57 sense启动子RNA比其antisense启动子RNA丰富,而Fscn2启动子antisense启动子RNA丰富(图5G)。在功能上,Cep57的mRNA随着Cep57启动子RNA kd的升高而升高,而Fscn2的mRNA随着Fscn2启动子RNA kd的升高而降低(图5H和5I)。miR-320作为Cep57和Fscn2的启动子RNA特异性小干扰RNA (siRNA),对Cep57和Fscn2 mRNA显示了类似的作用(图5H和5I)。
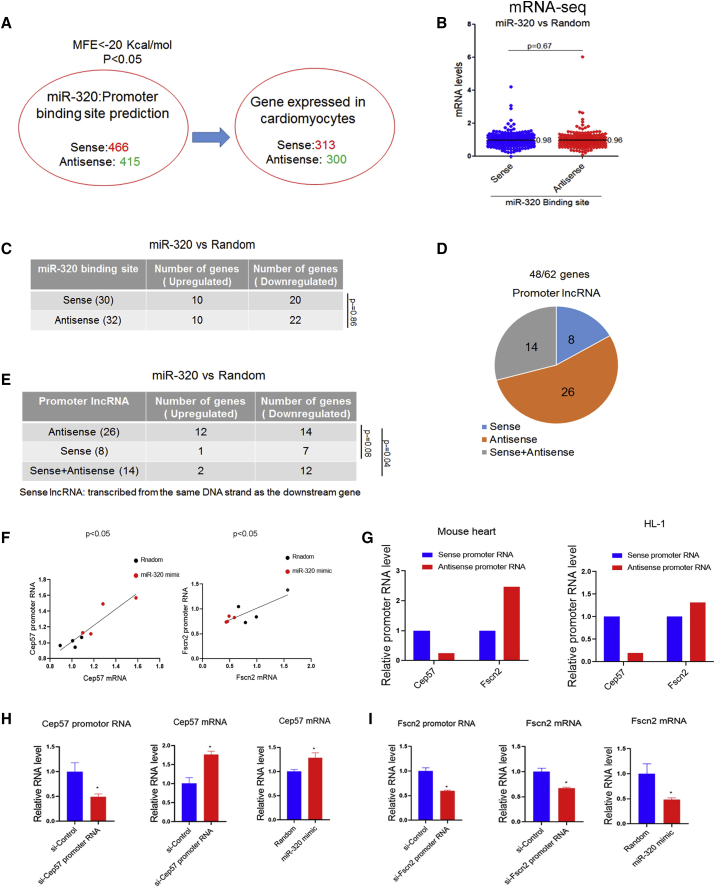
图5 miR-320的激活/抑制作用可能取决于ncRNA
不同的启动子RNA可能具有非常不同的调控模式。mir -320介导的基因激活(Cep57)或抑制(Fscn2)似乎依赖于启动子RNA本身的功能特性(激活或抑制)(图6)
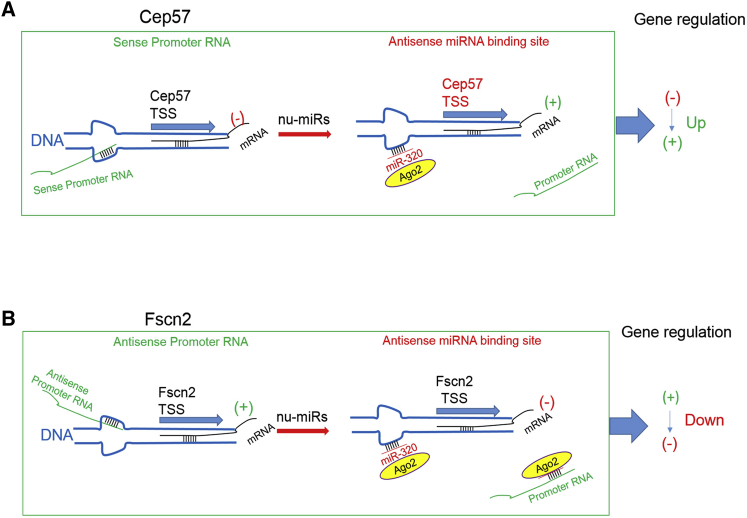
图6 核miR-320工作模型
结论
本研究基于Ago2- chip -seq、RIP-seq和全转录组seq数据的研究,带来了以下一些见解:
1、miR-320介导的转录控制是核Ago2/miR-320依赖的;
2、Ylpm1和Ssbp1与核Ago2密切相关,可能共同参与了核miRNA介导的转录重构;
3、miR-320靶向的正义或反义启动子的选择可能不能决定其激活或抑制作用;
4、Ago2与启动子DNA的结合似乎需要启动子RNA的存在,但不一定直接与启动子RNA结合;
5、对于sense启动子RNA的基因,大部分被miR-320下调。对于antisense启动子RNA,miR-320上调了一半基因,下调了一半基因;
6、具体来说,mir320介导的基因激活(Cep57)或抑制(Fscn2)似乎依赖于启动子RNA本身的功能特性(激活或抑制)。
参考文献:
Li H, Zhan J, Zhao Y, et al. Identification of ncRNA-Mediated Functions of Nucleus-Localized miR-320 in Cardiomyocytes. Mol Ther Nucleic Acids. 2020;19:132-143. doi:10.1016/j.omtn.2019.11.006