
2021-01-20

发表期刊:mBio
影响因子:6.8
文章题目:The Transcription Factor SomA Synchronously Regulates Biofilm Formation and Cell Wall Homeostasis in Aspergillus fumigatus
技术手段:RNA-Seq、ChIP-Seq
派森诺生物与南京师范大学携手合作,于近期在mBio上发表了烟曲霉生物被膜调控机制的研究成果。
研究背景
生物被膜(Biofilm)是嵌在聚合物细胞外基质中的表面相关微生物的有组织的群落。它们是自然界和人类感染过程中常见的微生物生长形式。有证据表明,病原真菌在感染过程中产生生物被膜增强了其耐药性,同时有助于病原菌逃避宿主免疫细胞的识别和杀伤。因此生物被膜被认为是导致病原微生物产生耐药性及慢性感染性疾病难以治愈的重要原因之一。
烟曲霉是一种常见的致病真菌,其感染宿主的一种策略是在肺组织内产生生物被膜。近年来的研究证实了胞外多糖半乳糖胺半乳糖聚糖(GAG)在烟曲霉生物被膜形成中的关键作用,而GAG的生物合成又受到转录因子SomA调控;也有研究表明GAG和其他细胞壁多糖生物合成途径之间存在联系。然而目前为止,SomA-GAG-生物被膜-细胞壁之间的生物学关系尚未有定论。
基于此,本实验利用RNA-seq和ChIP-seq进行生物学分析,旨在寻找SomA调节烟曲霉生物被膜形成和细胞壁稳态的生物学机制。
实验方法
由于SomA缺失的烟曲霉无法产生分生孢子,因此构建了一株Tet-somA菌株,将其启动子区替换为可诱导的Tet-On系统,在培养基中加入强力霉素后,可以有条件地表达SomA,在下文中以Tet-somA(ON)和Tet-somA(OFF)表示。对Tet-somA(ON)和Tet-somA(OFF)的烟曲霉做细胞壁压力处理(即加入CFW),并以正常处理作为对照组,进行RNA-seq与ChIP-seq。
研究结果
1、细胞壁压力促进GAG介导的生物被膜形成
用4种细胞壁应激源(CFW、CR、SDS和caspofungin)处理野生烟曲霉以测试细胞壁压力对其生物被膜形成的影响。在高浓度下,四种药剂均抑制烟曲霉的生长。然而,在低浓度下,CFW、CR和caspofungin导致生物被膜的形成增加(图1 A-D),说明细胞壁压力可促进生物被膜形成。
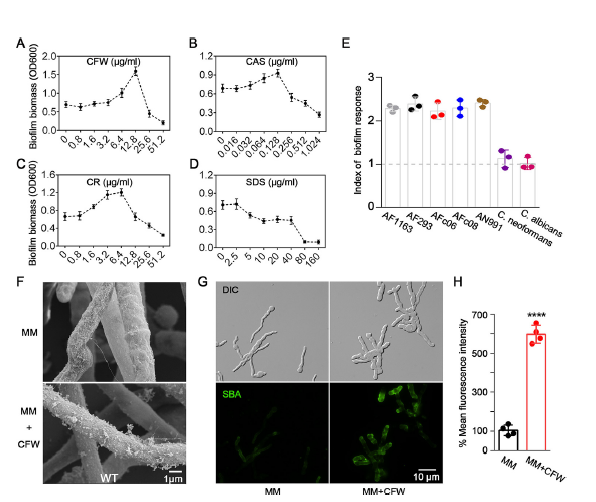
图1 细胞壁压力促进了GAG介导的曲霉生物膜的形成
2、SomA介导细胞壁压力导致的生物被膜的形成
正常情况下,ΔmedA、ΔstuA、ΔptaB、和Tet-somA(OFF)菌株在表现出严重的生物膜形成缺陷(图2A和B)。暴露于12.8μg/ml的CFW显著增强ΔstuA和ΔptaB的生物膜生产(图2A),但对由ΔmedA和Tet-somA(OFF)突变无影响(图2A和B)。这些发现表明,细胞壁压力诱导的生物膜的形成依赖于SomA和MedA。
此外,当暴露于CFW时,在Tet-somA(ON)菌株中,GAG生物合成簇上的5个基因中的4个上调表达(图2D),而Tet-somA(OFF)突变体中,只观察到2个相关基因表达量略微上升(图2D)。这些数据表明,在正常和细胞壁应力条件下,SomA是GAG产生的关键调节器。
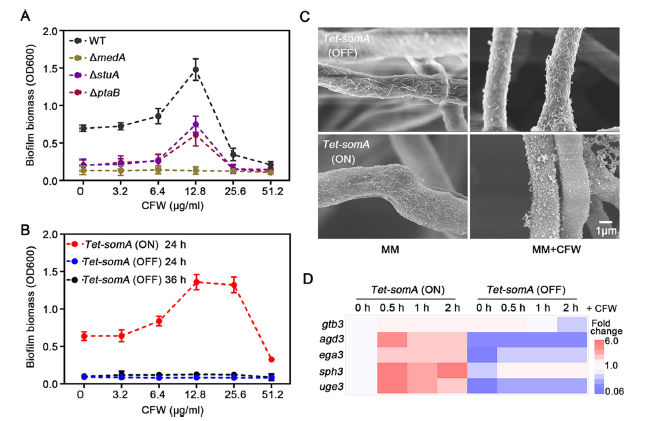
图2 SomA介导细胞壁压力诱导的生物膜形成
3、SomA可调节葡萄糖的摄取、利用以及氨基糖和核苷酸糖的代谢
对Tet-somA菌株在正常生长和细胞壁压力(CFW处理)条件下进行RNA-seq,结果表明,正常生长的Tet somA(OFF)菌株中,有873个基因表达上调,1432个基因表达下调;而在CFW的处理下,Tet-somA(OFF)菌株中有921个基因表达上调,1679个基因表达下调。
进一步对差异基因进行KEGG富集分析(图3A-D),发现在正常生长和CFW处理作用下,与SomA表达直接相关的下调转录本的丰度在氨基酸糖和核苷酸糖代谢功能基因中显著富集,反之,上调转录本则多富集于酪氨酸代谢和糖酵解/糖异生通路。这些发现表明SomA在控制碳通量和多糖合成前体的生产中起着关键作用。
此外,ChIP-Seq与RNA-Seq联合分析表明,许多依赖于SomA的基因可能间接地受其调控(图3 E和F),而从ChIP结果的直接靶点中鉴定到两个与葡萄糖摄取和利用相关的基因,在正常和细胞壁压力条件下,与Tet-somA (ON)菌株相比,Tet-somA (OFF)菌株中这两个基因的表达均显著降低(图3 G)。
综上这些数据可说明,SomA可以调节葡萄糖的摄取、利用以及氨基糖和核苷酸糖的代谢。
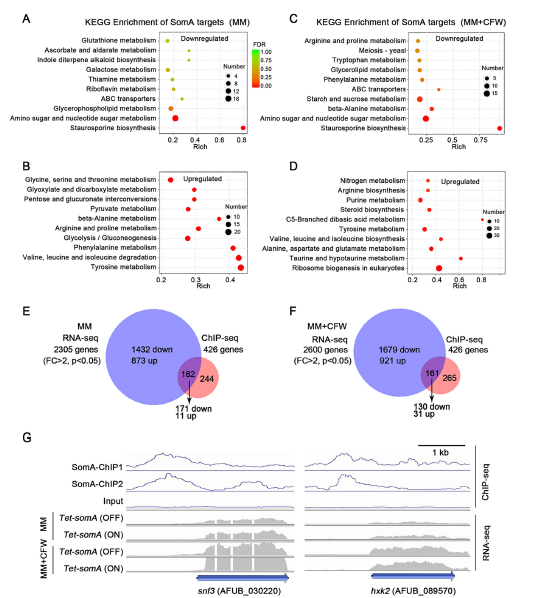
图3 对SomA靶基因进行ChIP-seq和RNA-seq分析
4、SomA与GAG生物合成相关基因的启动子结合
ChIP-seq结果表明(图4),在GAG生物合成簇内的基因附近发现了五个SomA结合峰。峰值强度图显示,SomA结合显著富集于agd3和gtb3之间的区域。结合RNA-seq结果,Tet-somA (ON)株中agd3的转录水平较高,而gtb3的转录水平不高,这些数据表明SomA直接调控agd3的表达;在ega3的上游区域发现了两个SomA结合位点,与agd3一样,RNA-seq结果也显示ega3的表达是由SomA正向调控的,说明SomA对ega3的表达起直接调节作用;在medA和stuA的上游发现了多个SomA结合位点,表明SomA直接调控这些因子。此外也发现SomA间接调控一些GAG相关基因。
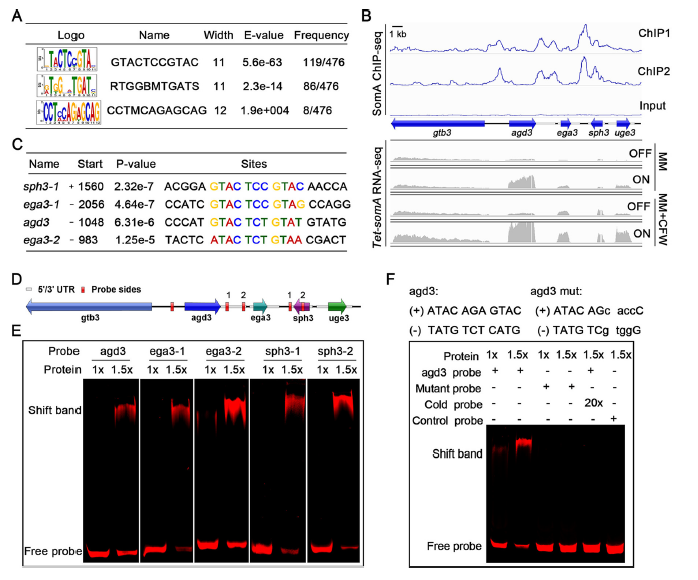
图4 SomA直接调节ega3和agd3
5、SomA正向调节与细胞壁相关的基因
对ChIP-seq结果进行GO富集分析发现,除了GAG相关基因,SomA结合基因也显著富集于甲壳素生物合成、细胞壁组织和细胞粘附的条目。相关基因可编码细胞壁压力传感器、几丁质合成酶及β-1,3-葡聚糖合成酶(图5 A)。热图显示,WT和Tet-somA(ON)菌株中,相关基因的表达量均随细胞壁压力(CFW处理)的积累而增加(图5 B)。后续实验也证明,Tet-somA菌株(OFF)对CR、CFW和caspofungin敏感,而Tet-somA(ON)恢复了对这些药物的正常抗性(图5 C)。
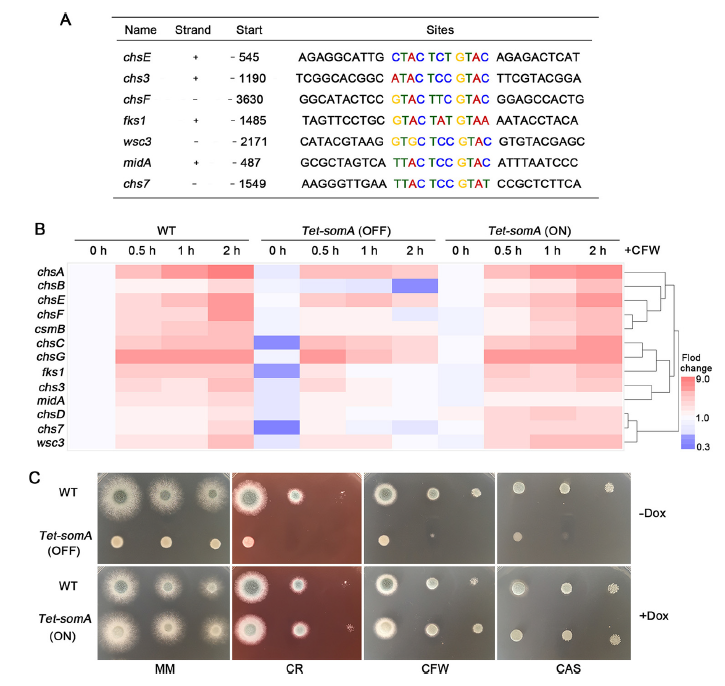
图5 SomA参与了细胞壁的压力反应
6、SomA调节细胞壁的结构和组成
采用透射电镜(TEM)对菌丝细胞壁进行观察发现,Tet-somA(OFF)中菌丝细胞壁厚度是Tet-somA(ON)的2倍(图6 A);另外从糖类物质组成来看(图6 B-E),与Tet-somA(ON)和野生型相比,Tet-somA(OFF)的细胞壁糖总量显著减少,细胞壁葡萄糖含量比Tet-somA(ON)下降了50%,总β-1, 3-葡聚糖含量显著下降。其余几种细胞壁糖类含量未有明显差异。
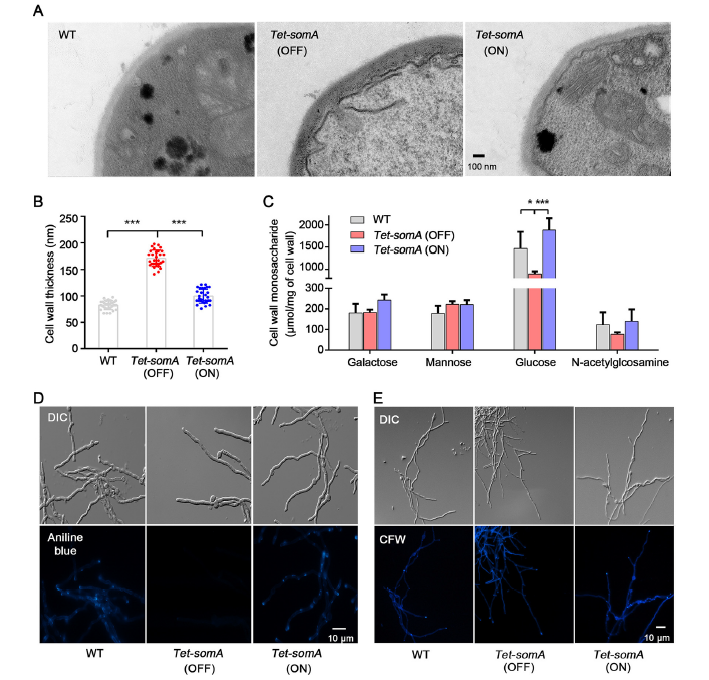
图6 SomA调节细胞壁的结构和组成
小 结
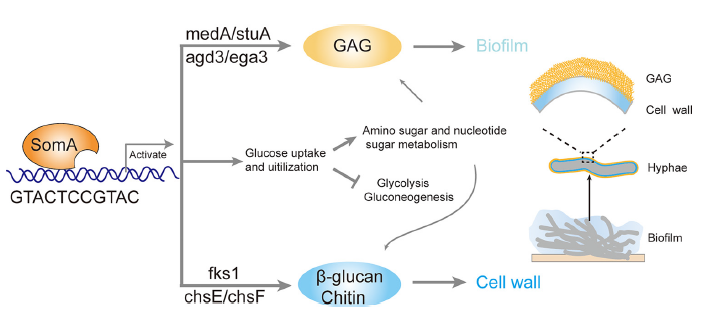
本研究表明,细胞壁压力可诱导胞外多糖半乳糖胺半乳糖聚糖(GAG)的产生,从而促进生物被膜的产生,而转录因子SomA在介导这一过程中发挥了关键作用。通过RNA-seq和ChIP-seq确定了一组核心的体细胞靶基因。在GAG生物合成基因agd3和ega3的启动子区发现了一个新的SomA结合位点,以及它的调控因子medA和stuA。此外,SomA也被发现调节细胞壁压力传感器、几丁质合成酶及β-1,3-葡聚糖合成酶相关基因。因此,SomA可直接调控GAG和细胞壁多糖的生物合成。此外,SomA被发现可总体调节调节葡萄糖的摄取和利用,以及氨基糖和核苷酸糖的代谢,为多糖的合成提供前体。下图为转录因子SomA同步调节生物被膜形成和细胞壁稳态的工作模型。
意义
本研究进一步确认了SomA是一种主转录因子,在生物被膜形成和细胞壁稳态中发挥双重作用。这一发现揭示了一种整合生物被膜形成和细胞壁稳态的转录控制途径。更重要的是,由于SomA在人中没有同源基因,它可能成为抗真菌药物开发的一个有吸引力的靶点。
本研究的转录组测序和数据分析工作由上海派森诺生物科技有限公司完成。
原文链接:http://mbio.asm.org/content/11/6/e02329-20.long