
2021-03-10

派森诺生物与南昌大学第一附属医院携手合作于近期在Applied Microbiology and Biotechnology杂志发表了题为Helicobacter pylori infection worsens impaired glucose regulation in high-fat diet mice in association with an altered gut microbiome and metabolome的文章。
技术手段:16S rRNA测序;LC-MS/MS代谢组学检测
研究背景
幽门螺杆菌感染首先引起慢性胃炎,并导致胃溃疡和胃萎缩,严重者则发展为胃癌。除了胃肠疾病,幽门螺旋杆菌感染还增加了包括糖尿病、代谢综合征和非酒精性脂肪性肝病在内的代谢性疾病的发病率。此外,有研究表明,杀灭幽门螺杆菌可改善代谢指标,包括降低胰岛素抵抗和甘油三酯的含量。
越来越多的研究表明,肠道菌群在肥胖、代谢综合征和糖尿病等代谢紊乱疾病中发挥着重要作用。除了遗传背景和环境因素,饮食和抗生素的使用也会严重影响肠道微生物群的结构。长时间摄入高脂食物(HFD)会导致优势肠道菌群多样性的改变,并提高脂多糖(LPS)的含量,从而导致糖代谢失调。然而,研究发现,抗生素治疗对肠道菌群的调节作用可提高HFD小鼠的糖耐量,可能是通过降低细菌数量和脂多糖水平来实现的。研究前期发现,幽门螺旋杆菌感染会加重HFD诱导的代谢紊乱,并导致肠道菌群的一个剧烈变化。但是在HFD组小鼠中,幽门螺杆菌与HFD共同处理引起的糖代谢紊乱是否可以被抗生素逆转,目前尚不清楚。
除了肠道微生物群,进一步研究发现,微生物的代谢产物还通过作用于消化道内的细胞或进入血液循环来参与宿主代谢的调节,影响机体的远端部位。然而,关于幽门螺杆菌和HFD在肠道代谢组中的相互作用及其与代谢紊乱的关系目前知之甚少。
本研究的目的是研究幽门螺杆菌感染对HFD引起的代谢紊乱和肠道微生物群以及微生物代谢产物的影响。
研究思路
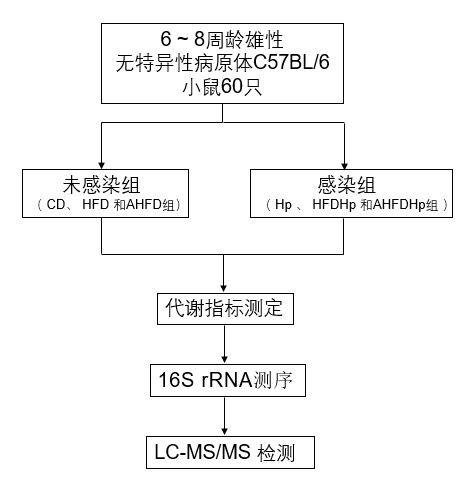
研究结果
1.感染幽门螺杆菌后,抗生素不能改善因高脂饮食引起的葡萄糖不耐受症
12周后HFD组小鼠体重明显高于CD组。有趣的是,抗生素治疗降低了HFD小鼠的体重,接近CD组体重水平。然而,无论是CD还是HFD组,幽门螺杆菌感染和非感染之间都没有差异(图1b)。与CD组相比,HFD组胰岛素抵抗和葡萄糖不耐受增加,但幽门螺杆菌感染组和未感染组没有差异 (图1 c-d)。此外,与HFD组相比,HFDHp组的空腹血糖水平明显升高(图1e)。与体重类似,抗生素治疗也改善了HFD组小鼠的胰岛素抵抗、葡萄糖不耐受和空腹血糖,达到与CD组小鼠相等或更低的水平。然而,由于受幽门螺杆菌感染的影响,导致抗生素对HFD引起的血糖失调的改善作用减弱,因此AHFDHp组的葡萄糖不耐受和血糖均高于CD组。
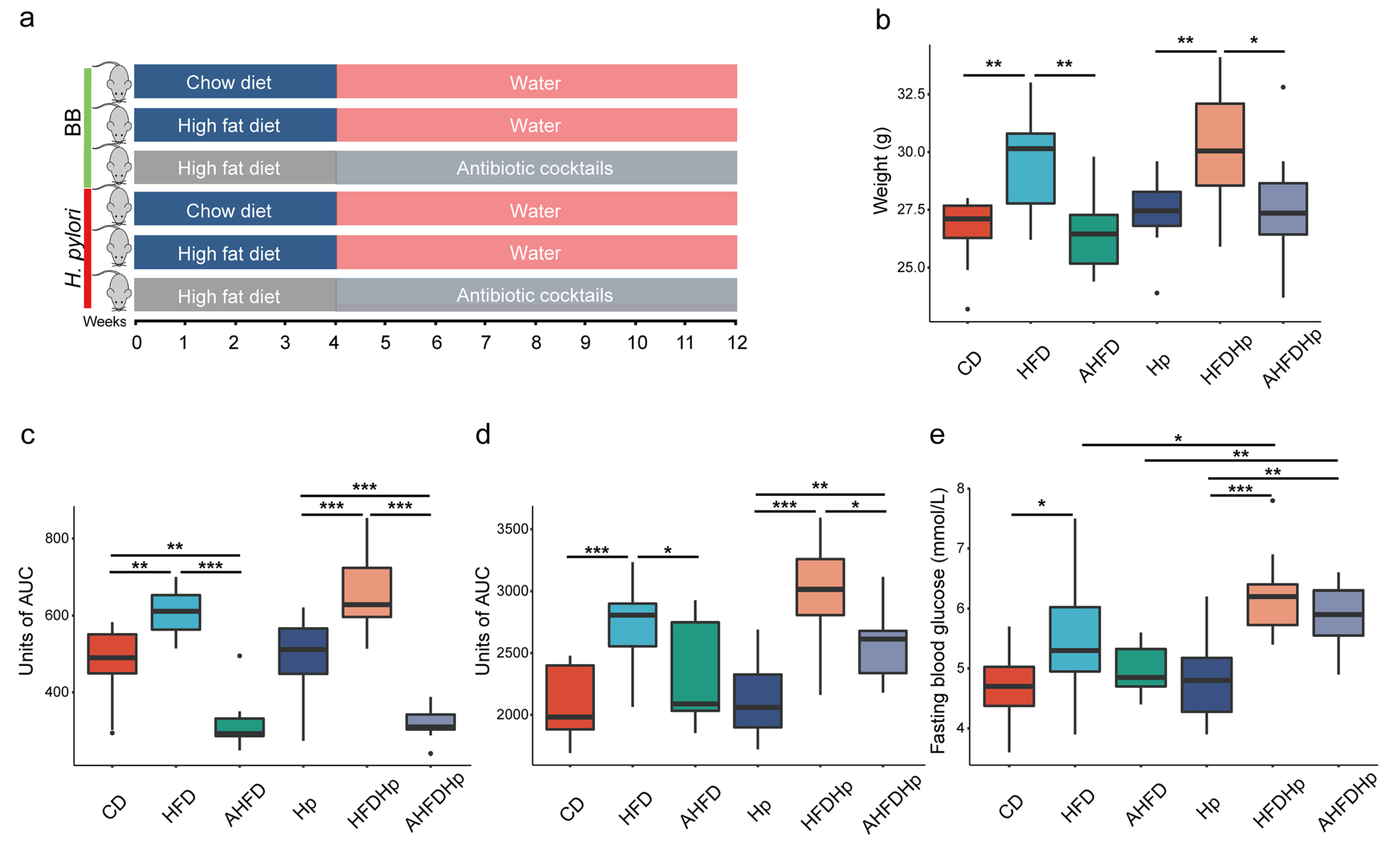
图1 抗生素处理降低了HFD小鼠的体重,与CD组相比,HFD组胰岛素抵抗和葡萄糖不耐受增加。此外, 与HFD组相比,HFDHp组的空腹血糖水平明显升高。
2.幽门螺杆菌感染与HFD对肠道微生物失调的协同作用
采用16S rRNA测序分析粪便样品的微生物组成。与HFD组相比,HFDHp组的alpha多样性指数(包括Chao1和Shannon指数)有所下降,而Hp组与CD组之间无差异(图2a-b)。beta多样性, 如NMDS图所示,不同组之间也有不同程度的差异(图2c-d)。结果还发现Hp组和HFD组的肠道菌群组成都与CD组不同(ANOSIM, Hp vs CD P=0.007, HFD vs CD P=0.003)。此外,HFDHp和CD组之间的分离比与Hp-或HFD-组之间的分离更明显。
如图3a所示,在不使用抗生素的小鼠中,肠道菌群主要由拟杆菌门和厚壁菌门组成。HFD组的厚壁菌门/拟杆菌门的比例增加,而幽门杆菌感染组与未感染组之间无差异。在科水平上微生物的相对丰度在感染组和非感染组也存在差异,尤其是在给予高脂饮食诱导时(图3b)。
此外,我们进行了LEfSe分析,有趣的是,与幽门螺杆菌感染相关的鉴别特征在CD和HFD两组中有所不同,这表明幽门螺杆菌和HFD对肠道菌群组成存在相互作用 (图3c-d)。
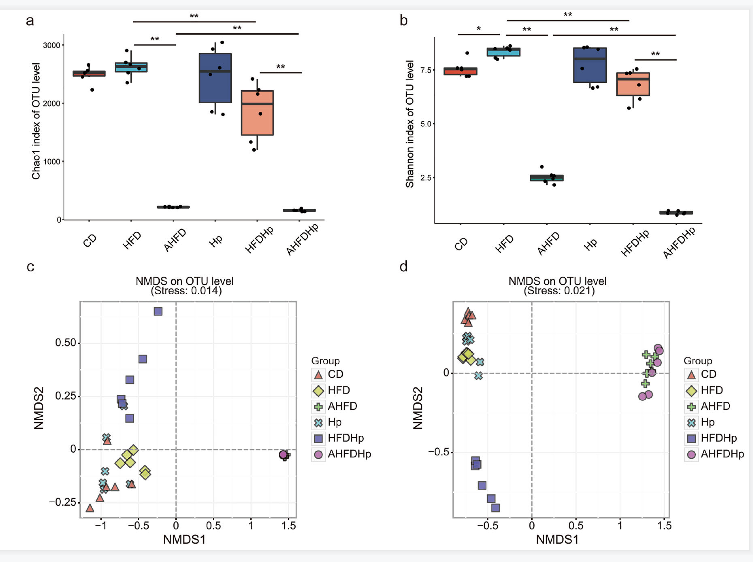
图2 与HFD组相比,HFDHp组的alpha多样性指数有所下降,而Hp组与CD组之间无差异;对于beta多样性,不同组之间也有不同程度的差异。
3. 幽门螺杆菌感染和高脂饮食后小鼠肠道菌群对抗生素的不同反应
使用抗生素后,肠道菌群的多样性和丰富度降低 (图2a-b)。值得注意的是,在AHFDHp组alpha多样性进一步降低。使用抗生素后肠道菌群的组成发生了很大的变化,变形菌门占很大比例,拟杆菌门和厚壁菌门几乎消失(图3a)。
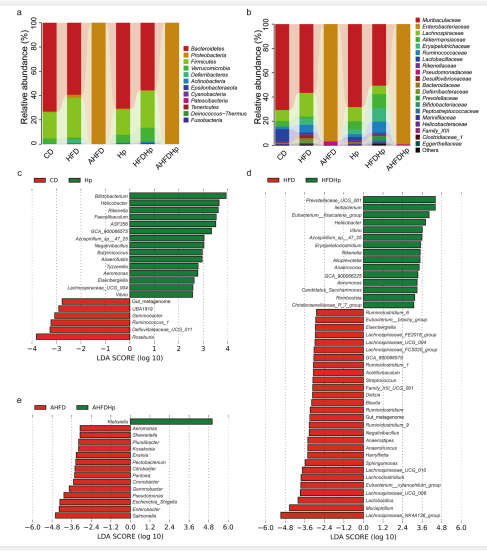
图3幽门螺杆菌感染与HFD的协同作用共同影响小鼠肠道微生物的组成
与AHFD组相比,AHFDHp组的某些功能也发生了变化,包括代谢疾病、感染病以及多糖生物合成和代谢的增加 (图4c)。结果还发现,AHFDHp组的粪便微生物中与LPS生物合成相关的微生物基因功能明显更高,而与碳水化合物代谢相关的基因功能较低(图4d)。因此,幽门螺杆菌和HFD共同处理引起的肠道菌群失调对抗生素的破坏更为敏感,可能会削弱其对代谢紊乱的改善作用。

图4 幽门螺杆菌感染组和未感染组在level 2和 level 3层级上的差异富集通路
4. 幽门螺杆菌感染对不同组别的小鼠粪便代谢物的影响
为确定感染幽门螺杆菌后代谢物的变化,对感染组和对照组的粪便样本做LC-MS非靶向代谢分析。经过数据处理之后,正离子模式下检测到148,907个峰,负离子模式下检测到48,966个峰,共鉴定出1343个代谢产物。OPLS-DA分析表明组内样本重复性以及组间区分效果都比较好(图5 a-c)。而且在不同的处理组中,幽门螺杆菌感染引起的代谢产物的变化是不同的。如图5d-f所示,对3个比较组中差异的代谢物绘制热图(差异代谢物的筛选标准为VIP值>2和P值<0.05)。
差异主要表现在脂肪酸、胆汁酸、氨基酸、肽及其类似物、维生素D及其衍生物、二萜类化合物等代谢物中(图6)。
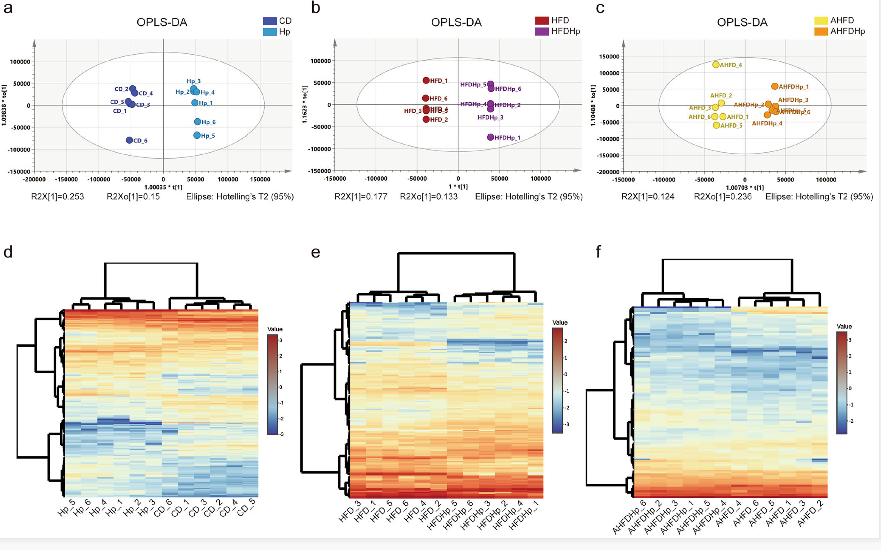
图5 OPLS-DA分析以及差异代谢物热图分析
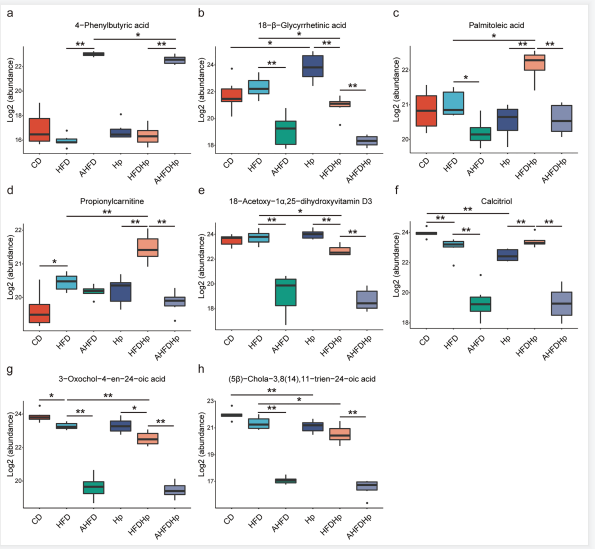
图6 差异代谢物的箱线图
为了进一步确定幽门螺杆菌感染后影响的通路,我们对差异代谢物进行KEGG通路富集分析。如图7a所示,在CD组中,被幽门螺杆菌感染后脂肪消化吸收和不饱和脂肪酸的生物合成通路受到影响。与HFD组相比,在HFDHp组中上调的L-phenylalanine被富集在苯丙氨酸代谢通路上(图7b)。抗生素处理后,发现HFDHp和HFD比较组中有8个差异代谢物包括胆碱、肌酸、L-3-hydroxykynurenine和维生素D3参与到代谢通路中 (图7c)。同时,胆碱和肌酸也富集在甘氨酸、丝氨酸和苏氨酸的代谢通路上,这表明在HFD和抗生素干预后,这两种代谢物在幽门螺杆菌引起的代谢紊乱中具有潜在的作用。
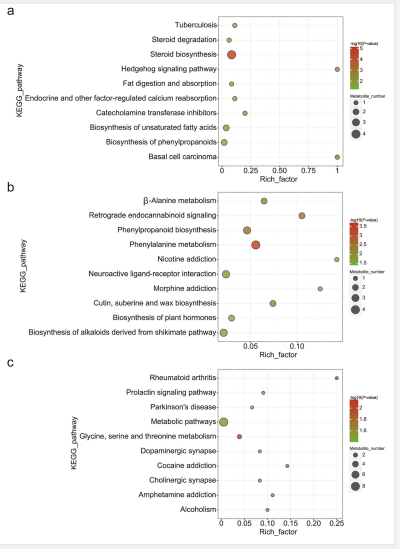
图7 差异代谢物的KEGG通路富集分析
总结
综上所述,本研究揭示了幽门螺杆菌、HFD和抗生素在葡萄糖代谢中的相互作用及其对肠道微生物群和代谢产物的影响。幽门螺杆菌感染削弱了抗生素对HFD诱导的代谢紊乱的调节作用,这可能是由于肠道微生物多样性低且克雷伯氏菌单一优势所致。研究还发现幽门螺杆菌感染后肠道代谢产物发生改变。结果表明,幽门螺杆菌感染削弱了抗生素的修复作用,加剧了食用高脂食物对肠道微环境稳态的影响。
本研究的微生物组测序和代谢组学检测以及数据分析工作由上海派森诺生物科技有限公司完成。