2021-03-24

文章题目:Regulation of circular RNAs act as ceRNA in a hypoxic pulmonary hypertension rat model
技术手段:全转录组测序
派森诺生物与昆明医科大学携手合作,于近期在《Genomics》上发表了构建大鼠缺氧性肺动脉高压的ceRNA调控网络相关研究成果,影响因子6.2。
研究背景
缺氧性肺动脉高压(HPH)是由于低氧引起血管内皮细胞损伤,血管内皮合成和分泌的各种血管舒张因子平衡失调导致早期的肺血管收缩以及后期的肺血管重建,是慢性缺氧性肺疾病的并发症,且HPH的发病率逐年上升,在高海拔地区尤为常见。目前HPH预后较差,因此,探索潜在的或新的靶向药物治疗具有重要意义。
环状RNA (circRNA)是一种特殊的非编码RNA,其特征是封闭的环状结构,因此比大多数传统的线性RNA更稳定。研究表明,circRNA包含多个miRNA结合位点,可以充当miRNA的海绵,从而通过抑制miRNA实现对其下游目标基因的表达调控。这个过程就是竞争性内源性RNA(ceRNA)机制。迄今为止已发现一些circRNA可通过circRNA-miRNA-mRNA的ceRNA网络在癌细胞的信号调控过程中发挥作用,但其在HPH中的作用和机制尚未得到详细探讨。
基于此,本实验构建HPH大鼠模型,通过全转录组测序技术,结合包括蛋白互作网络分析、基因功能富集分析等分析方法,构建了circRNA-miRNA-mRNA的ceRNA调控网络,以探索HPH的潜在关键基因。
研究方法
样本:HPH模型大鼠肺组织、对照组大鼠肺组织
实验方法:全转录组测序
测序平台:illumina Hiseq
技术路线图见下:
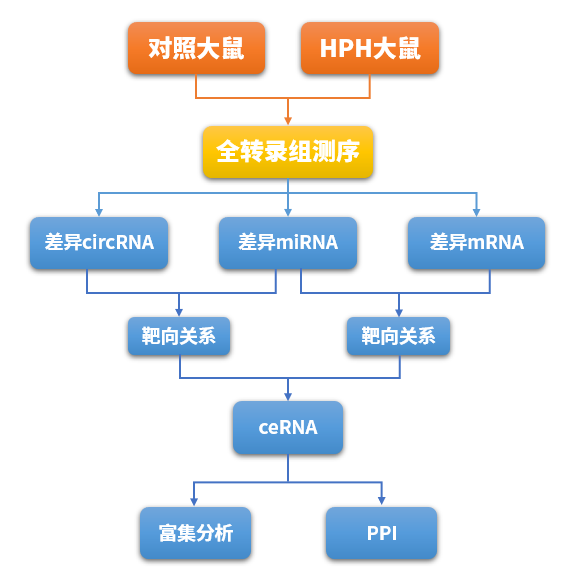
研究结果
1、全转录组测序结果初步分析
对来自HPH大鼠和对照大鼠肺部的6个样品进行全转录组测序。数据标准化后,六个样品的circRNA、miRNA、mRNA的数据集分布几乎相同(图1 A),差异分析结果显示,HPH组与对照组相比,共鉴定到15个差异circRNA(11个上调,4个下调)、9个差异miRNA(7个上调,2个下调)和212个差异mRNA(141个上调,71个下调)(图1 B、C)。
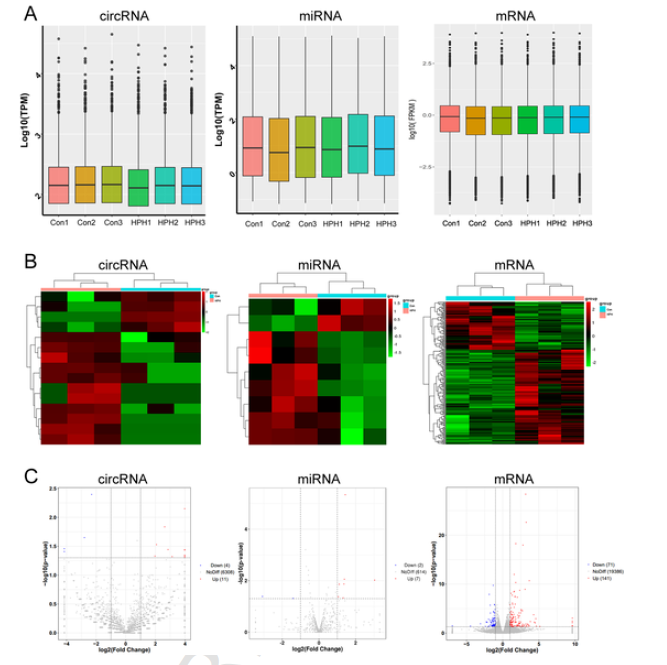
图1 HPH大鼠模型中RNAs显著表达变化的鉴定
2、ceRNA网络构建
接下来使用在线工具,对差异miRNA进行靶基因预测。8个差异circRNA(6个上调和2个下调)能够靶向9个差异miRNA(7个上调和2个下调),另外,这些差异miRNA可以结合46个差异mRNA(27个上调和19个下调)(表1)。根据预测的circRNA-miRNA和miRNA-mRNA关系对,构建了一个ceRNA网络(图2 A)。
表1 差异表达RNAs的靶基因
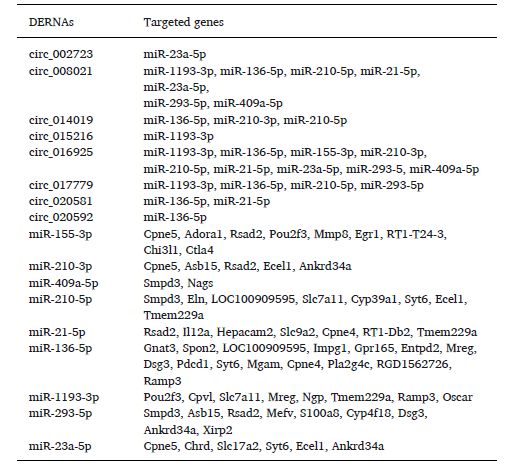
进一步分析该ceRNA网络发现,circ_002723、circ_008021和circ_016925(上调)与miR-23a(下调)结合,而miR-23a被证实参与了与先天性心脏病和缺氧诱导的人肺动脉平滑肌细胞相关的肺动脉高压的发展;此外,circ_020581(下调)与miR-21(上调)结合,而小鼠的体内实验表明,miR-21的基因缺失会导致肺组织中PDCD4/caspase-3轴的功能激活和内皮细胞凋亡的抑制,从而造成进行性HPH的发作。因此,可推测circ_002723、circ_008021、circ_016925和circ_020581具有特异性吸附miR-23a或miR-21,以控制HPH中下游靶基因表达的潜在功能。
3、功能富集分析和PPI分析
使用在线软件Metascape对ceRNA网络中的46个差异mRNA进行GO和KEGG富集分析,结果显示部分富集的条目及通路与HPH相关(图2 B):
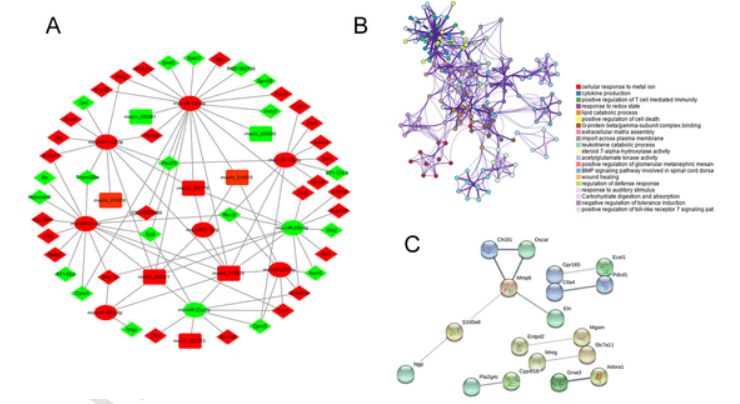
图2 ceRNA网络图、富集分析网络图和PPI网络图
A、GO富集显示,差异基因显著富集于呼吸系统过程、细胞对高氧的反应、炎症反应的调节,此外KEGG富集分析显示,差异基因显著富集血管平滑肌收缩。已有研究表明,肺动脉平滑肌细胞的异常增殖和迁移会导致肺血管重塑,这是肺动脉高压病理学的一个重要特征。另外慢性缺氧和炎症反应可诱导肺动脉平滑肌细胞的增殖和迁移,这被认为是促进HPH的重要因素。
B、同时,差异基因也显著富集于GO的NIK/NF-κB信号调节、MAPK级联反应及Toll样受体条目下,而这三者已被多次报道与HPH密切相关。
C、此外,GO富集分析结果中出现细胞对氧化还原的反应条目,已知氧化剂和氧化还原信号可介导肺动脉缺氧性血管收缩和体循环动脉缺氧性血管舒张,进而参与肺动脉高压的发展。
D、最后,KEGG富集分析结果中出现BMP信号通路。临床数据表明,大约11%-40%的特发性肺动脉高压(PH)的BMPR2基因突变,另外也有报道,抑制BMP蛋白信号通路可以促进HPH的内皮-间质转化。
另外对ceRNA网络中的46个差异mRNA进行蛋白网络互作分析(PPI),发现18个中枢基因(hub-gene),其中MMP8的连接程度最高(图2 C)。MMP8的富集功能包括细胞因子生成、NIK/NF-κB信号传导、ROS合成、炎症反应、MAPK级联、IL-10产生及肿瘤坏死因子的分泌,且MMP在肿瘤发展中起着复杂且重要的作用,因此MMP8在HPH中扮演的角色有进一步研究的价值。
总 结
本实验通过对HPH大鼠模型进行全转录组测序,构建了一个由8个circRNA、9个miRNA和46个mRNA的组成的ceRNA调控网络,功能富集表明,炎症反应、NF-κB信号传导、MAPK级联反应和Toll样受体或与HPH相关。进一步的评估证实,circ_002723、circ_008021、circ_016925和circ_020581可能作为海绵吸附miR-23a或miR-21从而控制下游靶基因,并参与HPH的病理生理学。这些结果可能为临床提供新的见解和潜在的靶向治疗建议。
本研究的测序和数据分析工作由上海派森诺生物科技股份有限公司完成。
原文链接:https://doi.org/10.1016/j.ygeno.2020.11.021


