
2021-04-14

期刊:Nature Communications
影响因子:12.121
近期,派森诺生物与复旦大学基础医学院合作,在Nature子刊Nature communications上,发表了题为《β-arrestin 2 as an activator of cGAS-STING
signaling and target of viral immune evasion》的文章,该文章揭示了病毒免疫逃逸的新机制,影响因子12.121分。
研究背景
病毒是威胁人类健康的世界性问题,造成巨大的经济损失和社会问题。人体免疫反应包括固有免疫和适应性免疫。固有免疫作为免疫反应的第一线,是通过一套模式识别受体(PRRs)识别病原体相关分子模式(PAMPs)而激活的,PAMPs随后可调节适应性免疫,共同消灭病毒。
固有免疫抗病毒主要发挥作用的是Ⅰ型干扰素及其调控的信号通路。IFNβ可以激活JAK-STAT通路,促进TNFα、IL-6等大量炎症因子的表达,从而启动机体抗病毒免疫反应。
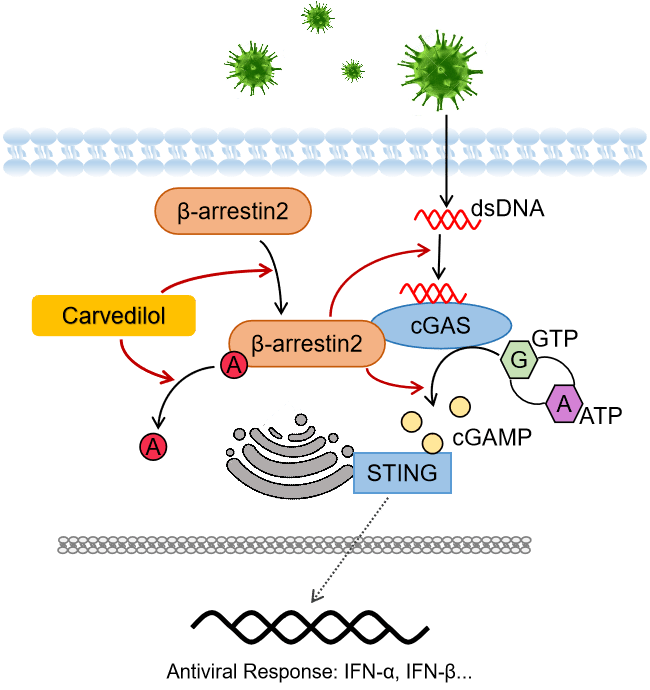
该文章研究结果表明,β-arrestin 2通过cGAS调节Ⅰ型干扰素通路的分子机制,而病毒通过降解β-arrestin 2实现其免疫逃逸的目的。
研究思路
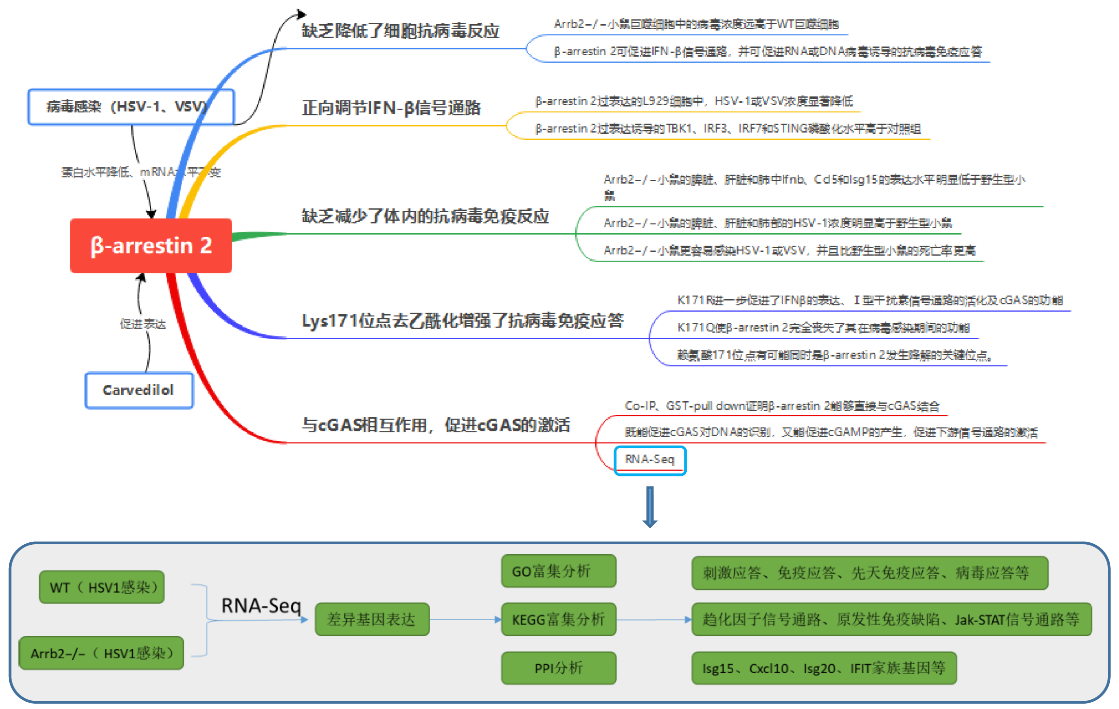
研究内容
1、β-arrestin 2的缺乏降低了细胞抗病毒反应
β-抑制素2的缺乏降低了细胞抗病毒反应
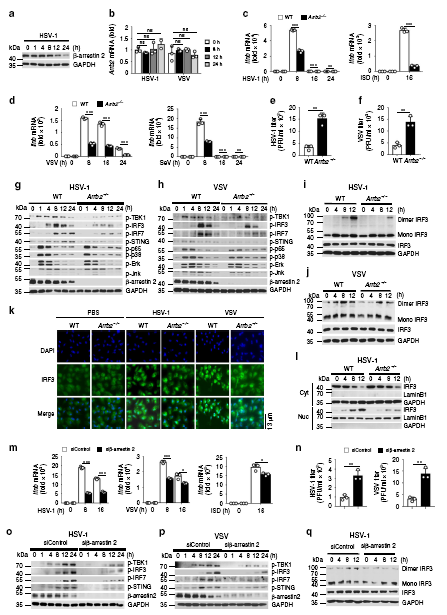
HSV-1、VSV病毒感染后,β-arrestin 2蛋白水平降低,而mRNA表达丰度不受病毒感染的影响,这表明β-arrestin 2可能在翻译后被病毒降解。病毒感染后,Arrb2−/−小鼠巨噬细胞中的病毒浓度远高于WT巨噬细胞。信号传导通路关键基因含量检测等实验结果显示,β-arrestin 2可促进IFN-β信号通路,并可促进RNA或DNA病毒诱导的抗病毒免疫应答。
2、β-arrestin 2正向调节IFN-β信号通路
β-arrestin 2正向调节IFN-β信号通路
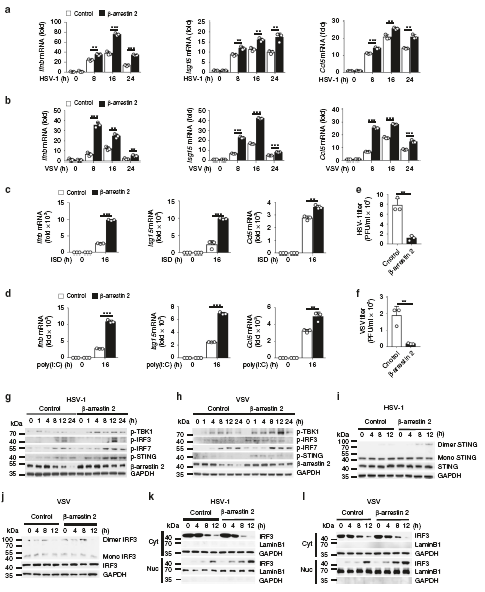
接下来,为了研究β-arrestin 2过表达是否对IFN-β信号通路有实质性影响,作者做了过表达实验。我们观察到,在β-arrestin 2过表达的L929细胞中,HSV-1或VSV浓度降低。而L929细胞中β-arrestin 2过表达诱导的TBK1、IRF3、IRF7和STING磷酸化水平高于对照组。异位β-arrestin 2表达的细胞在HSV-1或VSV刺激后,STING二聚化和IRF3二聚化显著升高,IRF3移位到细胞核。这些结果表明,β-arrestin 2通过促进STING和IRF3二聚体的形成,增强了IRF3从细胞质向核的转运和IFN-β信号转导。
3、 β-arrestin 2的缺乏减少了体内的抗病毒免疫反应
β-arrestin 2的缺乏减少了体内的抗病毒免疫反应
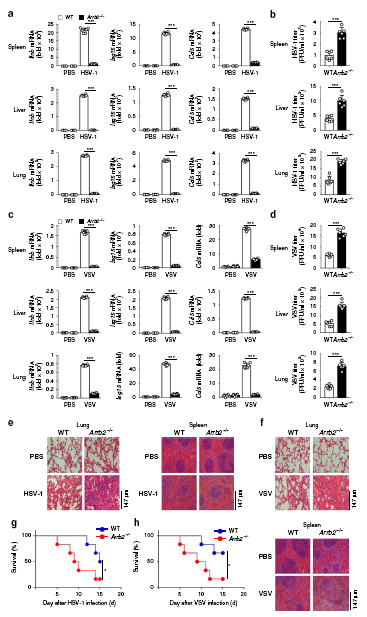
为了研究β-arrestin 2在体内抗病毒先天免疫应答中的作用,我们用HSV-1或VSV感染6周龄纯合子Arrb2−/−小鼠和野生型Arrb2−/−小鼠,并评估Ifnb、Isg15和Ccl5在不同组织中的表达水平。用HSV-1感染小鼠后,Arrb2−/−小鼠的脾脏、肝脏和肺中Ifnb、Ccl5和Isg15的表达水平明显低于野生型小鼠。与此结果一致的是,我们观察到Arrb2−/−小鼠的脾脏、肝脏和肺部的HSV-1浓度明显高于野生型小鼠。当使用VSV作为刺激时,也得到了类似的结果。与这些结果一致的是,我们观察到Arrb2−/−小鼠的肺和脾脏损伤比WT小鼠更多。我们进一步比较了野生型和Arrb2−/−小鼠在感染HSV-1或VSV后的存活率,发现Arrb2−/−小鼠更容易感染HSV-1或VSV,并且比野生型小鼠的死亡率更高。
所有这些体内实验结果都表明,β-arrestin 2是一种关键的对RNA和DNA病毒的抗病毒免疫应答的正向调节因子。
4、β-arrestin 2与cGAS相互作用,促进cGAS的激活
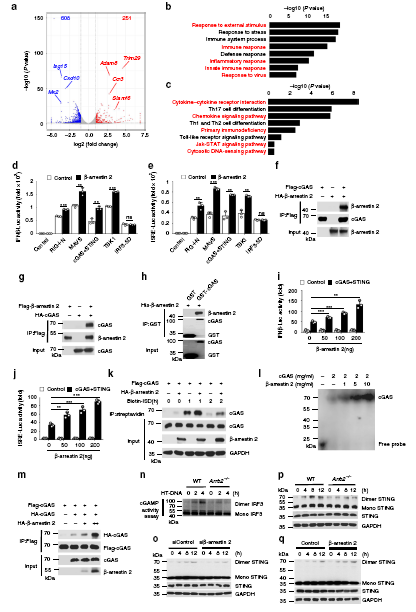
β-arrestin 2与cGAS相互作用,促进cGAS的激活
为了进一步研究β-arrestin 2在宿主抗病毒免疫中对病毒感染的作用,我们对HSV1感染的WT和Arrb2−/−进行了RNA-seq分析。与WT组相比,Arrb2−/−有859个基因的表达量发送显著变化(251个上调,608个下调)。基于差异基因的PPI分析显示,宿主抗病毒基因之间存在密切的相互作用网络,如Isg15、Cxcl10、Isg20、IFIT家族基因等。
GO富集分析显示,Arrb2−/−组下调了与外界刺激应答、免疫应答、炎症应答、先天免疫应答、病毒应答等相关的多个基因的表达。同样,KEGG富集分析显示在细胞因子-细胞因子受体相互作用、趋化因子信号通路、原发性免疫缺陷、Jak-STAT信号通路、胞质DNA传感通路等方面差异基因富集显著。
且研究者通过免疫共沉淀及GST-pull down实验发现,β-arrestin 2能够直接与cGAS结合。cGAS作为信号感受器,在病毒感染期间,能够识别双链DNA使得自身构象发生改变,从而促进AMP和GMP合成为cGAMP,而cGAMP能够被STING识别,从而激活下游信号通路。研究者们发现β-arrestin 2既能促进cGAS对DNA的识别,又能促进cGAMP的产生,促进下游信号通路的激活。
5、β-arrestin 2的Lys171位点去乙酰化增强了抗病毒免疫应答

β-arrestin 2的Lys171位点去乙酰化增强了抗病毒免疫应答
研究表明,病毒感染能够降解β-arrestin 2。且研究者通过质谱筛选得到了一个结合关键位点赖氨酸171(Lys171)。研究者构建了两种点突变K171R(不发生乙酰化也不发生泛素化)和K171Q(模拟持续性乙酰化状态)来研究乙酰化和泛素化对β-arrestin 2功能的影响,结果显示,β-arrestin 2赖氨酸171位点的去乙酰化是其发挥功能的先决条件。且有另外的研究显示,β-arrestin 2的点突变K171R和K171Q在感染期间均不发生降解,这说明赖氨酸171位点有可能同时是β-arrestin 2发生降解的关键位点。
6、卡维地洛通过β-arrestin 2促进抗病毒免疫
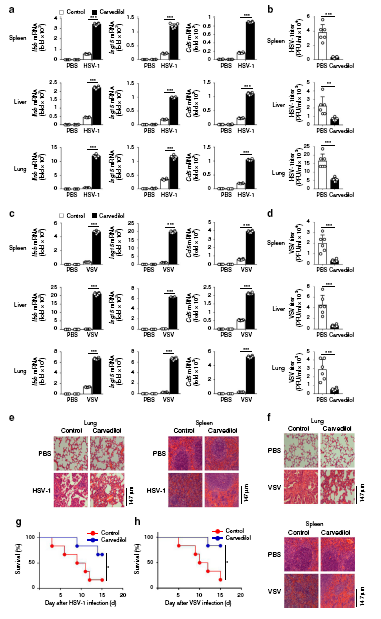
卡维地洛促进体内抗病毒免疫
有研究表明,卡维地洛(Carvedilol)作为β受体阻断剂,可增加大鼠急性心肌梗死模型中β-抑制素2的表达,调节β1AR信号。作者据此将其运用到病毒感染模型中,发现Carvedilol能够促进Ⅰ型干扰素信号通路的活化和小鼠的抗病毒免疫,然而其在β-arrestin 2缺失的细胞和小鼠中失去了相应的功能。因此,卡维地洛通过阻止β-arrestin 2的降解和促进β-arrestin 2的Lys171去乙酰化,正向调节IFN-β信号通路和抗病毒免疫。这提示,卡维地洛(Carvedilol)在将来有可能成为有效的抗病毒药物,当然这还需要进一步的研究及临床数据的支持。
总结
研究结果表明,β-arrestin 2与cGAS直接结合并促进cGAS和DNA的结合及cGAMP的产生,而β-arrestin 2在感染中发生的去乙酰化是其发挥抗感染功能的基础。在病毒感染早期,β-arrestin 2迅速发生去乙酰化而活化,发挥其抗感染功能;而在感染晚期,β-arrestin 2却能被病毒诱导,发生泛素化而被降解,帮助病毒实现免疫逃逸。
进一步的研究发现,抗心衰药物Carvedilol能够促进β-arrestin 2的去乙酰化及抑制β-arrestin 2的降解,通过稳定β-arrestin 2调控Ⅰ型干扰素信号通路及小鼠的抗病毒免疫,提示其可作为潜在的抗病毒药物。
本研究的转录组测序和数据分析工作由上海派森诺生物科技有限公司完成。
原文索引:
Zhang Y, Li M, Li L, Qian G, Wang Y, Chen Z, Liu J, Fang C, Huang F, Guo D, Zou Q, Chu Y, Yan D. β-arrestin 2 as an activator of cGAS-STING signaling and target of viral immune evasion. Nat Commun. 2020 Nov 26;11(1):6000. doi: 10.1038/s41467-020-19849-9. PMID: 33243993; PMCID: PMC7691508.