
2021-04-28

期刊:Blood
影响因子:17.573
派森诺生物与广州医科大学携手合作,于近期在期刊Blood上发表Otub1/c-Maf轴可能是多发性骨髓瘤的潜在治疗靶点的研究成果,影响因子17.573。
文章题目:Targeting the Otub1/c-Maf axis for the treatment of multiple myeloma
多发性骨髓瘤(MM)是一种克隆性浆细胞的恶性肿瘤,由未定性的单克隆免疫球蛋白病(MGUS)和闷燃型(无症状)骨髓瘤演变而来(smoldering MM)。c-Maf是一种致癌转录因子,与MM患者预后不良的高风险相关。致癌转录因子c-Maf被认为是多发性骨髓瘤(MM)的理想治疗靶点,但如何实现它仍是一个难题。在本研究中发现,Otub1为c-Maf的一种新的去泛素酶,并提示Otub1/c-Maf轴可能是MM潜在的治疗靶点。
名词解释
Multiple myeloma (MM) :多发性骨髓瘤
Lanatoside C (LanC):毛花苷C
Deubiquitinases(Dubs):去泛素化酶
关键点
Otub1是c-Maf的一个新的Dub,并促进其致癌转录活性。
Otub1/c-Maf轴是MM潜在的治疗靶点
技术路线
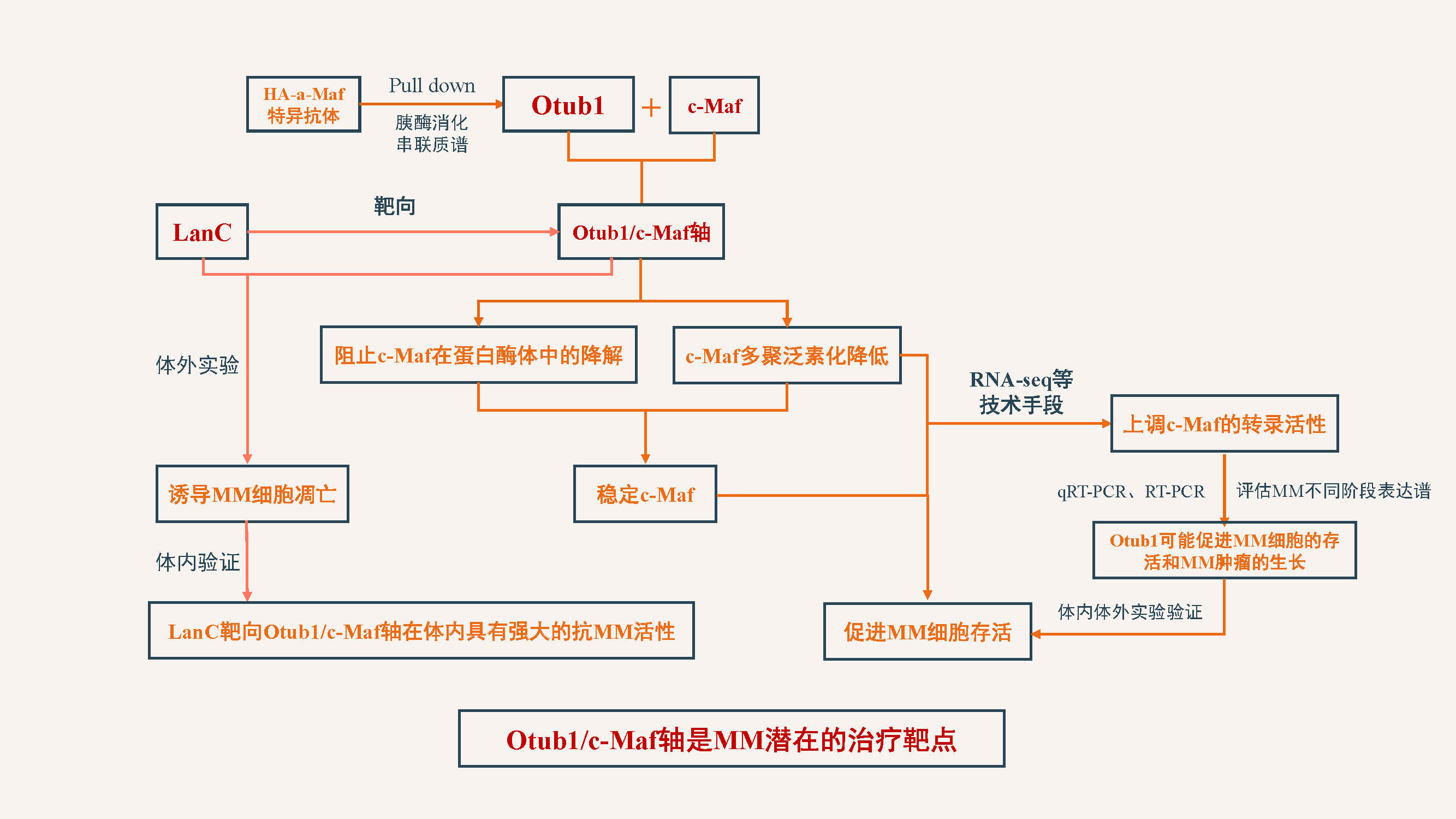
研究结果
Otub1与c-Maf相互作用并降低其k48连接的多聚泛素化
通过AP-MS测定c-Maf(图1A)识别出Dub Otub1,实验验证c-Maf-Otub1的相互作用(图1B-D)。慢病毒Otub1感染细胞,降低c-Maf多聚泛素化(图1E-F)。此外,Otub1降低了c-Maf在K48-上的泛素化,而不是k63连接的泛素化(图1G-H)。此外,当Otub1被其特异的sgRNA敲除后,c-Maf泛素化明显增加(图1I)。多个实验结果显示,Otub1与c-Maf相互作用,降低了其多聚泛素化。
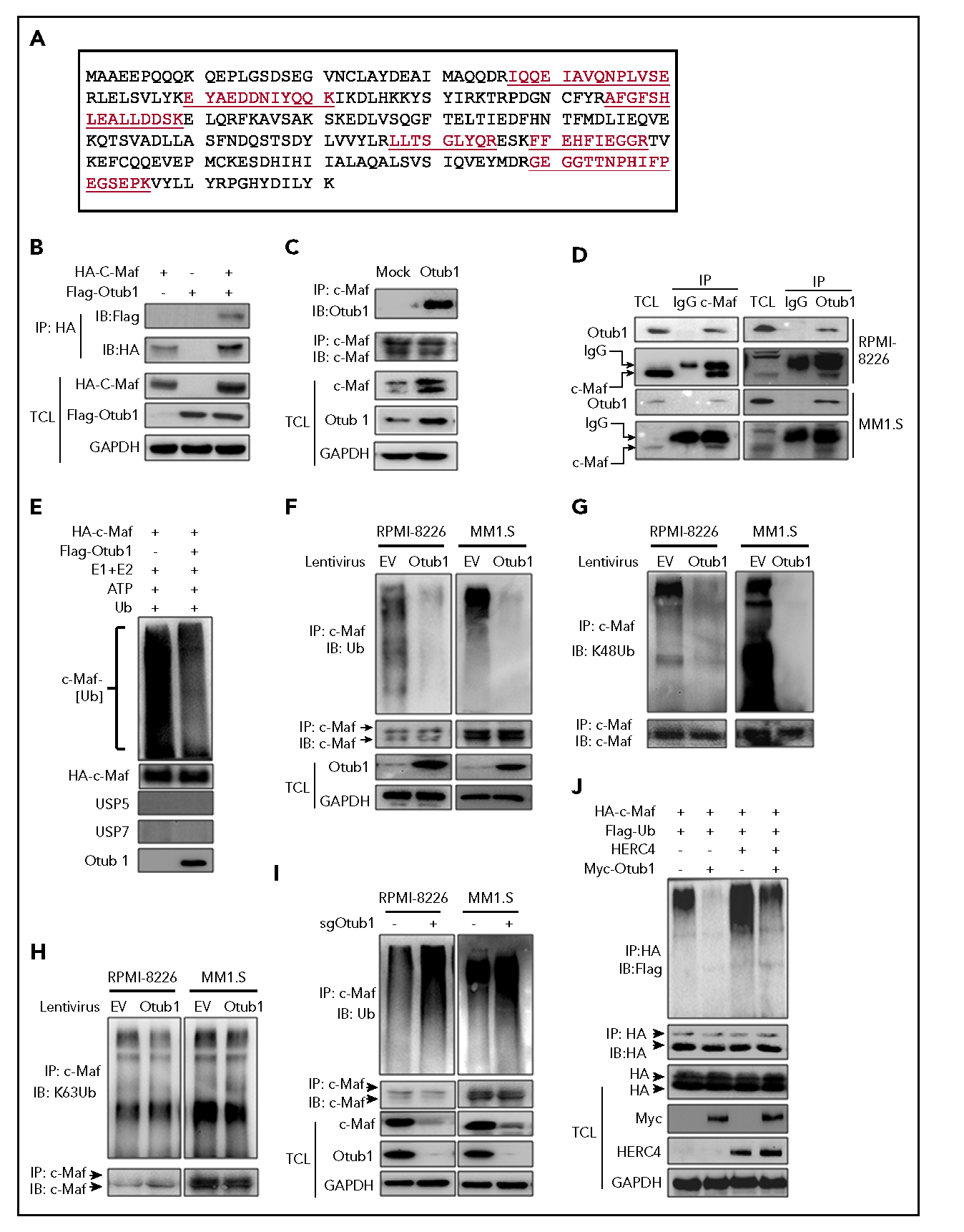
图1 Otub1与c-Maf相互作用并抑制其k48连接的多聚泛素化
Otub1稳定c-Maf蛋白
实验发现Otub1需要多聚泛素化来稳定c-Maf,Otub1以时间和浓度依赖的方式增加了c-Maf的稳定性,此外,蛋白酶体抑制剂MG132可以消除siOtub1诱导的c-Maf降解。并通过一系列实验结果表明,Otub1通过降低c-Maf的多聚泛素化并阻止其在蛋白酶体中的降解来稳定c-Maf。
Otub1促进c-Maf转录活性
通过与c-Maf和Maf识别元件驱动的荧光素酶报告基因共转染,Otub1显著提高了荧光素酶活性(图2G,2H)。Otub1显著上调了c-Maf调节的CCND2、ITGB7和ARK5这3个典型基因的表达(图2I)。此外,当敲除Otub1时,这些基因则显著下调,c-Maf降解(图2I)。此外,通过转录组测序验证了Otub1诱导的CCND2在RPMI-8226细胞中的表达。因此,所有这些发现都表明,Otub1通过降低c-Maf的多聚泛素化,增加其稳定性,从而上调c-Maf的转录活性。

图2 Otub1稳定c-Maf并促进其转录活性
Otub1不与UBE2O相互作用,但通过标准和非标准途径降低c-Maf泛素化
为了找出Otub1在c-Maf泛素化中起重要作用的机制,通过突变体共转染、环己酰亚胺追踪实验、IP/IB等实验结果得出,Otub1不与UBE2O相互作用,可能通过典型过程和非典型过程对c-Maf多聚泛素化和稳定性具有较强的作用。
Otub1促进MM细胞存活,与MM患者预后不良相关
通过评估在MM不同阶段的Otub1表达谱(图3A-B)、qRT-PCR(图3C)和常规RT-PCR,结果表明Otub1可能促进MM细胞的存活和MM肿瘤的生长。通过分析数据集,并对慢病毒GFP-Otub1稳定感染的MM细胞系注射的小鼠存活分析进行验证(图3F-G),结果显示,Otub1与c-Maf共同预测MM患者预后不良。慢病毒Otub1感染细胞,敲除Otub1来检测细胞凋亡等研究显示,Otub1通过去泛素化和稳定c-Maf促进MM细胞存活。
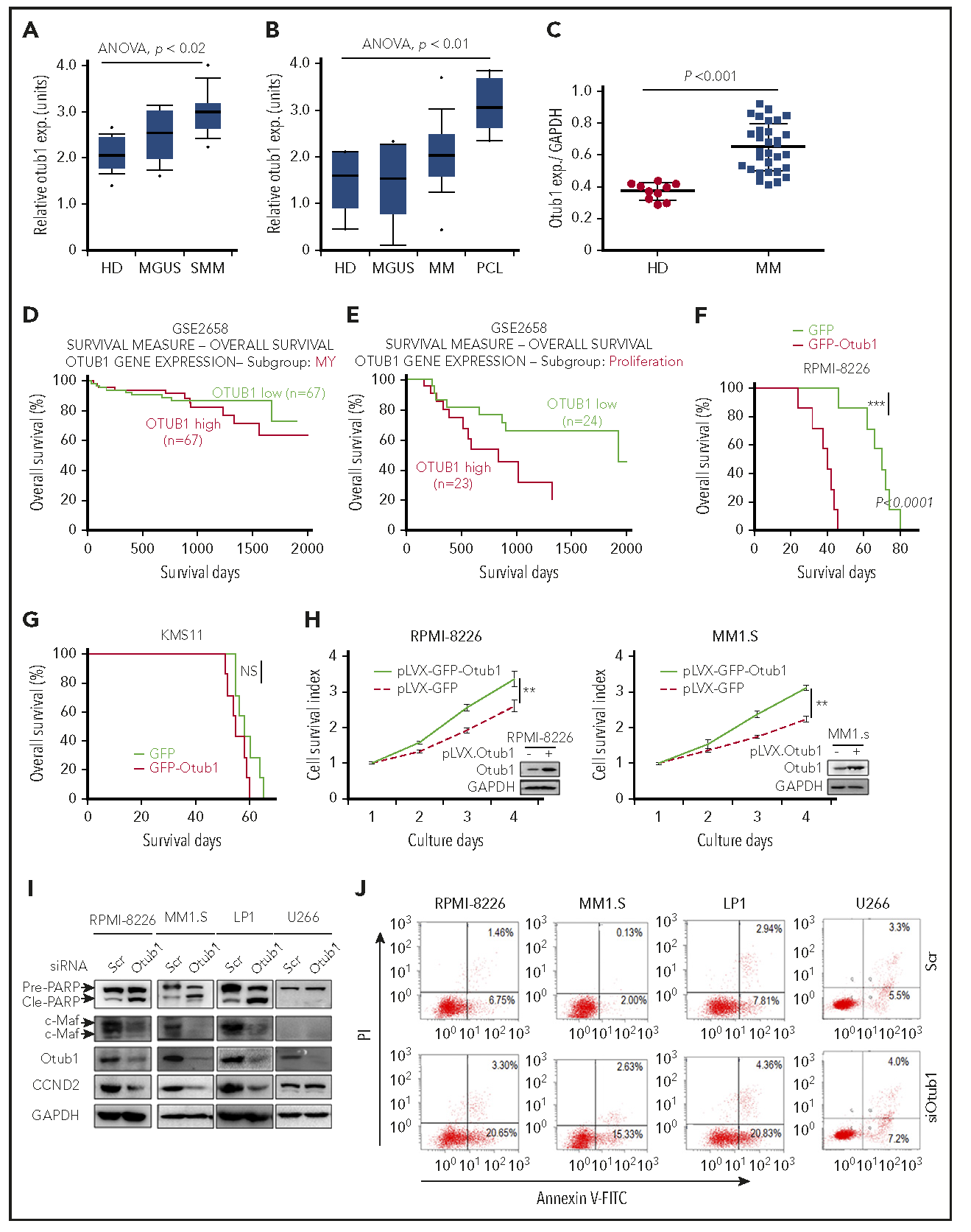
图3 Otub1在MM中过表达,导致MM患者预后不良
LanC是Otub1/c-Maf轴的抑制剂
以上结果表明,Otub1/c-Maf轴促进MM的存活和生长,而抑制Otub1/c-Maf则导致MM细胞凋亡;因此,靶向Otub1/c-Maf轴可能是治疗MM的潜在策略。为了探索这一概念,作者在表达MARE的HEK293T细胞中建立了药物筛选系统。实验证明LanC是通过靶向c-Maf蛋白的稳定性来抑制其转录活性的,此外,LanC还破坏了c-Maf与Otub1之间的相互作用,这可能是LanC抑制Otub1/c-Maf轴从而降低MM细胞活力的机制。
LanC靶向Otub1/c-Maf轴导致MM细胞凋亡
实验检测了LanC诱导的MM细胞凋亡,研究进一步表明LanC作用于Otub1/c-Maf轴。集落形成单位试验显示LanC显著抑制了MM患者骨髓细胞集落的形成,但没有抑制hd患者的集落形成(图4E),同时c-Maf对于LanC诱导的菌落形成减少至关重要(图4F)。此外,c-Maf的强制表达显著消除了LanC诱导的PARP在典型MM细胞中的裂解(图4G-H),与凋亡分析结果一致(图4D)。这些结果表明LanC通过靶向Otub1/ c-Maf轴诱导MM细胞凋亡。

图4 LanC抑制Otub1/c-Maf轴可诱导MM细胞凋亡
靶向Otub1/c-Maf轴的LanC在体内显示出强大的抗骨髓瘤活性
以上结果表明LanC在体外通过Otub1/c-Maf轴诱导MM细胞凋亡。为了在体内验证这一效应,本研究在小鼠身上检测了2个MM模型。通过将LP1和RPMI-8226细胞皮下注射到严重联合免疫缺陷裸鼠体内建立皮下模型,与裸鼠尾静脉注射gfp标记的KMS11或RPMI-8226建立弥散性MM模型,所有实验结果共同表明,LanC靶向Otub1/c-Maf轴在体内具有强大的抗MM活性。
本研究的RNA测序和数据分析工作由上海派森诺生物科技有限公司完成。
原文索引:
Xu Y, Xu M, Tong J, Tang X, Chen J, Chen X, Zhang Z, Cao B, Stewart AK, Moran MF, Wu D, Mao X. Targeting the Otub1/c-Maf axis for the treatment of multiple myeloma. Blood. 2021 Mar 18;137(11):1478-1490. doi: 10.1182/blood.2020005199.
文章链接:
https://ashpublications.org/blood/article-abstract/137/11/1478/463463/Targeting-the-Otub1-c-Maf-axis-for-the-treatment?redirectedFrom=fulltext