
2022-04-19

《ADVANCED FUNCTIONAL MATERIALS》
影响因子:18.808
文章题目:Ultrasound-Augmented Nanocatalytic Ferroptosis Reverses Chemotherapeutic Resistance and Induces Synergistic Tumor Nanotherapy
技术手段:RNA-seq等
派森诺生物与上海市第一人民医院携手合作,在国际著名期刊《ADVANCED FUNCTIONAL MATERIALS》上发表超声增强纳米催化铁死亡,逆转化疗耐药性和诱导协同肿瘤纳米治疗的研究成果,影响因子18.808。
多重耐药(Multiple drug resistance, MDR)是导致化疗疗效不理想甚至失败的重要原因之一,如何克服肿瘤耐药的挑战已成为临床抗肿瘤化疗的关键问题。诱导铁死亡已被公认为是一种新兴的杀死耐药肿瘤细胞的策略,但如何在肿瘤部位有效诱导铁死亡并提高其治疗效果仍具有很高的挑战性。
二、技术路线

三、研究内容
GDL的设计、制备与表征
首先研究合成GA-Fe(II)纳米复合物,实验验证了GA-Fe(II)作为Fenton催化剂的性能,在MB降解实验的基础上,GA-Fe(II)纳米催化剂保持了长达28天的Fenton催化活性。其催化稳定性来源于Fe3+与Fe2+的配位转化,而不像游离Fe2+容易被溶解氧氧化(图1g),保证了Fenton反应长期催化生成•OH。采用膜分散法制备GDL(图1b),采用类似方法合成DOX@liposome (DL)或GA-Fe(II)@脂质体(GL)。实验证实了DOX和GA-Fe(II)的包封。
本研究采用紫外-可见-近红外光谱(UV-vis - NIR)评价US控制DOX的释放;US能够有效促进脂质体中游离GA-Fe(II)和GA-Fe(II)的Fenton反应也得到了实验支持。
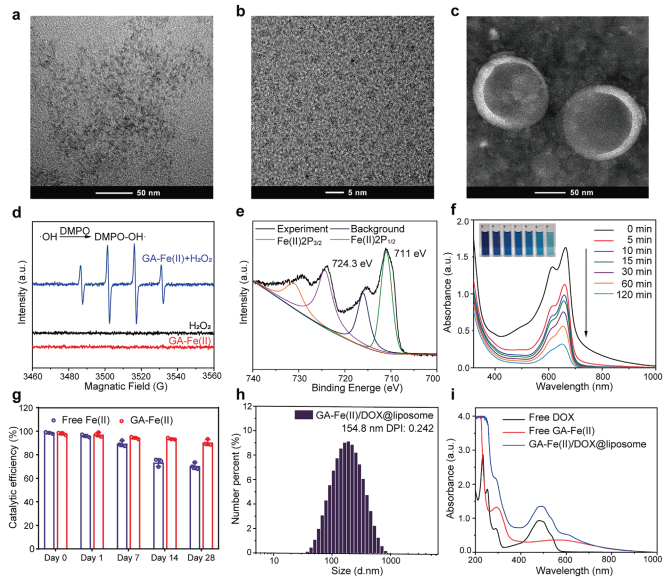
图1 GA-Fe(II)和GDL的表征
US对细胞摄取和细胞毒性的协同作用
CF-7/ADR乳腺癌细胞株为实验对象,评价超声照射对纳米脂质体吸收的促进作用。结果显示,超声照射组在指示时间点的Fe积累显著高于未超声照射组(p < 0.05),进一步说明了超声增强GDL细胞摄取的作用。
通过升高浓度的GDL孵育MCF-7/ADR细胞,评价GDL的细胞毒能力。如图2e所示,GDL对细胞的杀伤能力表现出显著的浓度依赖性。细胞活力的降低与超声时间和功率呈正相关(图2g),这进一步证实了US照射的协同抗癌作用。以上研究结果均证明, GDL+US治疗可显著逆转MCF-7/ADR乳腺癌细胞的耐药。在其他人类癌细胞株,CCK-8试验结果显示其具有强大的细胞杀伤作用。
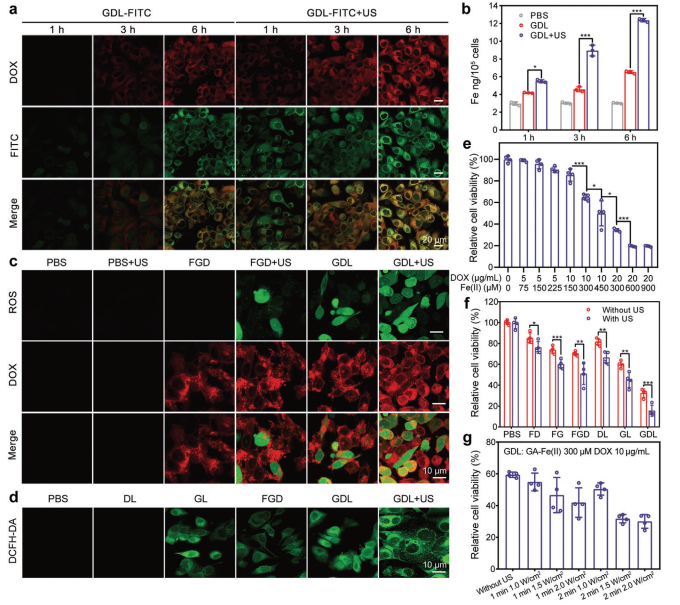
图2 US对细胞摄取和细胞毒性的协同作用
被GDL支持的US-增强纳米催化铁死亡
研究证实US照射可有效增强铁死亡,并对MCF-7/ADR癌细胞产生显著的细胞毒性。为进一步探讨GDL+US治疗的潜在抗肿瘤作用机制,PBS、DL或GDL+US分别孵育24 h后,收集不同治疗组的癌细胞进行转录组分析。
实验对差异基因进行聚类分析(图3a)。Venn图(图3b)显示,与control vs DL相比,control vs GDL+US组有149个共有差异基因和507个特有的差异表达基因。与DL组比较,GDL+US组上调基因189个,下调基因226个(fold change≥2,p < 0.05)(图3c)。为了进一步研究,我们通过KEGG富集分析,研究GDL+US处理的MCF-7/ADR细胞的铁死亡诱导情况。与DL组相比,GDL+US组差异表达基因富集于铁死亡相关通路,包括“丙氨酸、天冬氨酸、谷氨酸代谢”通路(与GSH合成相关)、“铁死亡”通路、以及“谷胱甘肽代谢”通路(与GSH代谢相关)(图3d),直接证实了GDL+US治疗可有效诱导MCF-7/ADR癌细胞发生铁死亡。随后研究进一步证实了GDL+US能有效诱发MCF-7/ADR细胞的纳米催化铁死亡。
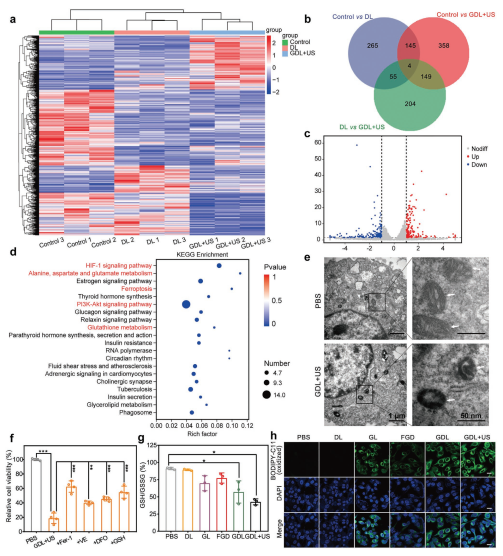
图3被GDL支持的US-增强纳米催化铁死亡
超声增强纳米催化铁死亡逆转癌细胞耐药研究
采用流式细胞仪进一步考察其对MCF-7/ADR细胞的杀伤作用,结果表明GDL+US可以有效地杀死dox耐药的MCF-7癌细胞。此外,根据之前的转录组测序结果,GDL+US处理组和DL处理组的差异表达基因不仅在铁死亡相关通路中富集,而且在HIF-1α signaling pathway中,AMPK signaling pathway,PI3K-Akt signaling pathway 上富集(图3d和图4a,b)。研究还探索了细胞周期相关基因的GO功能富集分析,以证实细胞增殖在组间的差异(图4 e,f,g)。在GDL+US组,筛选出了相对下调的CREB、PGC-1α和Bcl-2基因。
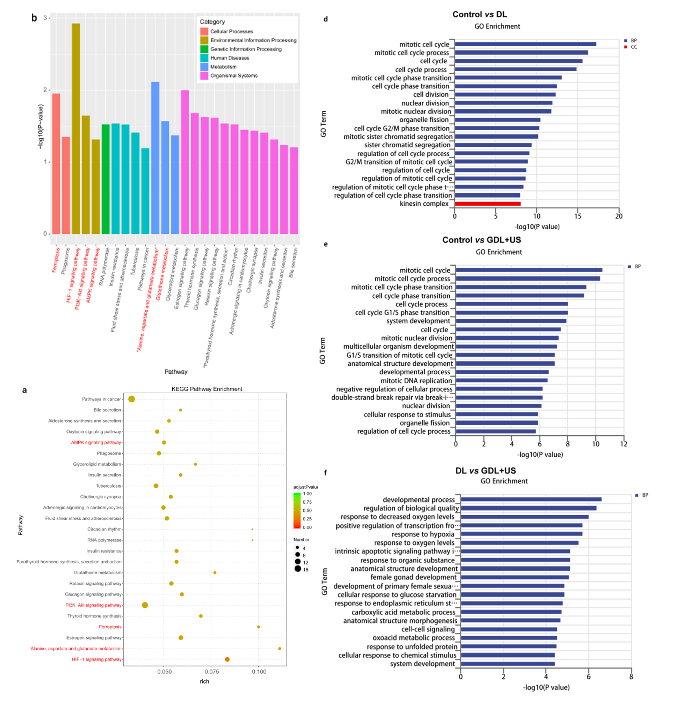
图4 转录组分析
研究进一步揭示了GDL+US治疗使耐药细胞对肿瘤化疗敏感的分子机制:GDL+US在逆转肿瘤细胞DOX耐药方面的高疗效归因于GDL联合US照射的高效内化和细胞内积累。导致线粒体损伤,调节细胞增殖,使DOX耐药的MCF-7/ADR细胞处于凋亡敏感状态,最终触发DOX诱导的癌细胞凋亡。因此,这种协同凋亡和铁细胞下垂策略可以提高DOX耐药癌细胞的杀伤效率。
基于铁死亡的体内抗肿瘤治疗逆转癌细胞耐药的研究
研究发现由于肿瘤细胞固有的铁死亡已知作用导致了化疗耐药,而超声增强的纳米催化下的铁死亡能有效阻断这种耐药机制,最终诱导出以上铁/细胞凋亡为基础的协同作用抗肿瘤治疗。进而实验证明GDL+US在体内获得了最佳的抗肿瘤效率,克服甚至逆转化疗耐药性;而 GA-Fe(II)诱导的Fenton反应与US协同作用可显著增强肿瘤内氧化。
四、研究结论
在此,本文报道了一种基于Fenton催化和GA-Fe(II)诱导铁死亡功能的复合脂质体纳米系统,该系统可双重诱导铁死亡/肿瘤细胞的凋亡途径。在构建的脂质体系统中,GA-Fe(II)复合物可不断催化•OH的生成,导致GSH的消耗,细胞内铁元素的积累,LPO的生成增强,主动触发肿瘤细胞内铁依赖的铁死亡途径。此外,协同US照射可有效提高纳米药物的内吞作用,增强/加速肿瘤内Fenton反应,控制药物在肿瘤部位的被动释放,增强纳米催化抑瘤作用。深入分析mRNA测序结果发现,超声增强的Fenton反应通过下调PGC-1α和Bcl-2的表达,可导致线粒体功能障碍和细胞增殖抑制,使DOX耐药的MCF-7/ADR细胞处于凋亡敏感状态。实现逆转化疗耐药性。超声增强纳米催化疗法通过双铁活化/细胞凋亡触发策略,重塑DOX耐药肿瘤的敏感性,有效抑制肿瘤生长,这对于探索其他以铁死亡为靶点的协同纳米治疗方案来杀死耐药肿瘤具有重要意义。
本研究的RNA测序和数据分析工作由上海派森诺生物科技有限公司完成。
原文索引:Yi Zheng, Xin Li, Caihong Dong, Li Ding, Hui Huang, Tianhu Zhang, Yu Chen,Rong Wu. Ultrasound-Augmented Nanocatalytic Ferroptosis Reverses Chemotherapeutic Resistance and Induces Synergistic Tumor Nanotherapy. 2022 Jan 19:34(4). doi: 10.1002/adfm.202107529.