
2022-04-28
随着测序技术的发展,想要更加全面深层次的剖析生物学问题,越来越多的科学家会选择多种组学搭配,联合解析具体机制。今天我们就对一篇经典的《Cell》多组学文章进行解析,看单细胞数据如何和其他组学数据进行关联。

研究背景
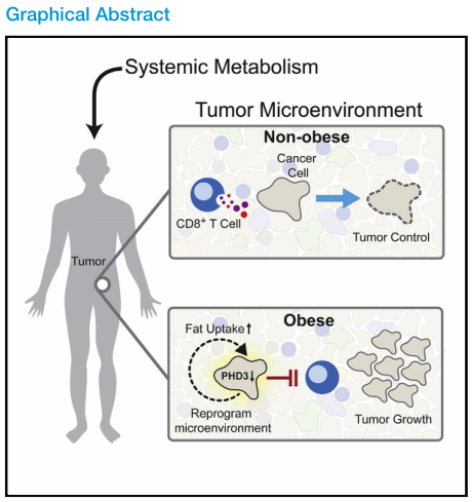
肥胖在西方比较常见,是至少13种癌症的风险因素(Lauby-Secretan et al., 2016)。肥胖可以引起机体代谢的系统性紊乱,导致血脂异常、高胆固醇血症、胰岛素抵抗、激素水平改变和炎症基线改变(Deng et al.,2016)。以往关于肥胖和癌症的研究主要集中在肿瘤的内在效应或肿瘤细胞的内分泌调节轴上。肥胖诱导的全身代谢变化如何影响局部肿瘤微环境(TME)中的免疫细胞尚未见报道。
肿瘤细胞代谢的一个显著特征是增加营养消耗,以满足能量、合成代谢和促生存的需求。活化的T细胞是高度增殖的,并依赖于特定的代谢途径来维持T细胞效应功能。由于实体肿瘤的血液供应有限,肿瘤细胞的高营养消耗可能会对肿瘤内T细胞的代谢需求构成障碍。众所周知,肿瘤细胞代谢会以抑制抗肿瘤免疫的方式改变局部代谢景观的许多方面。然而,系统代谢如何影响TME内的局部代谢以及肥胖如何影响肿瘤和免疫细胞之间的相互作用尚不清楚(Drijvers et al.,2020)。
本文旨在研究肥胖如何改变TME的代谢,以抑制T细胞功能和促进肿瘤生长。主要利用代谢、蛋白质组学和基因组学方法,以及多重组织成像,利用小鼠肿瘤模型系统地剖析了饮食诱导的肥胖如何重塑TME中的代谢。并结合单细胞RNA测序来描述TME中免疫亚群对肥胖的代谢反应。这些多组学数据揭示了单细胞分辨率下肿瘤免疫细胞与高脂肪饮食诱导的肥胖相互作用的动态图景,并得出结论,在肥胖相关的肿瘤中,适应性的代谢可塑性会引发肿瘤细胞和CD8+T细胞对有益脂肪酸的争夺,提示对代谢的干预能改善肿瘤免疫治疗。
研究思路
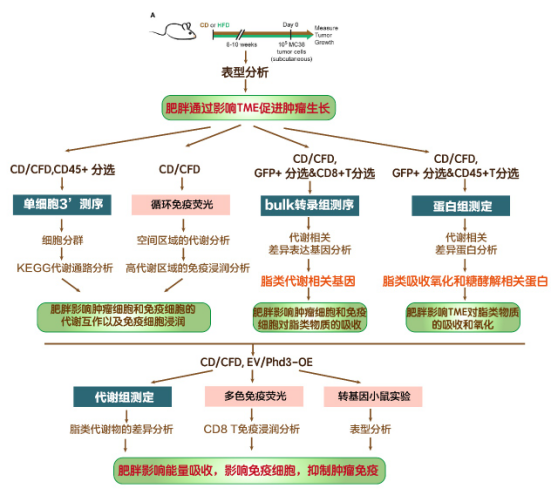
研究结果
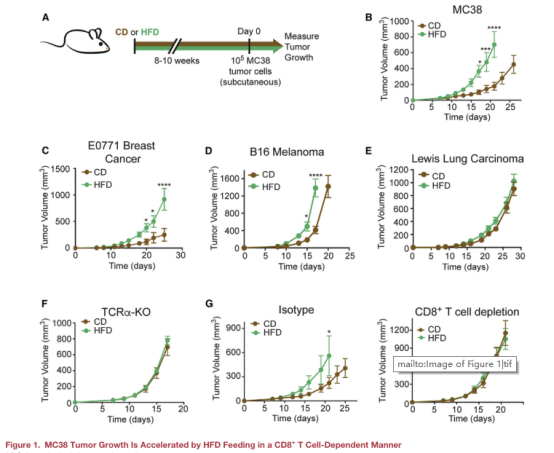
一、高脂饮食(HFD)通过CD8+ T细胞依赖性促进MC38肿瘤生长
本文使用C57BL/6J小鼠建立肥胖模型,模型随机分为正常饮食组(CD)与高脂饮食组(HFD),随着小鼠生长时间变长,HFD组的小鼠体重明显增长更多,并出现了一系列肥胖相关的代谢变化(图A)。对模型注射MC38 结直肠腺癌细胞,发现肿瘤在HFD组生长更快(图B)。此外,注射三种不同免疫原性水平的肿瘤的模型进行比较,发现免疫原性会影响肿瘤生长(图CDE)。
为了探究CD动物肿瘤生长速度的降低是否由于T细胞控制的,本文将MC38肿瘤植入T细胞受体a链敲除(TCRa-KO)小鼠中。结果发现TCRa-KO小鼠在HFD条件下的体重增加与野生型(WT)小鼠相似,CD和HFD组TCRa-KO小鼠的MC38肿瘤生长速度没有差异(图F)。同样,在缺乏CD8+T细胞的小鼠中,肿瘤生长速度也没有发生饮食依赖的变化(图G)。在这两种情况下,CD8+ T细胞减少均会加速肿瘤的生长,以上证明HFD诱导的代谢变化通过限制抗肿瘤CD8+T细胞的反应来增加MC38肿瘤的生长。
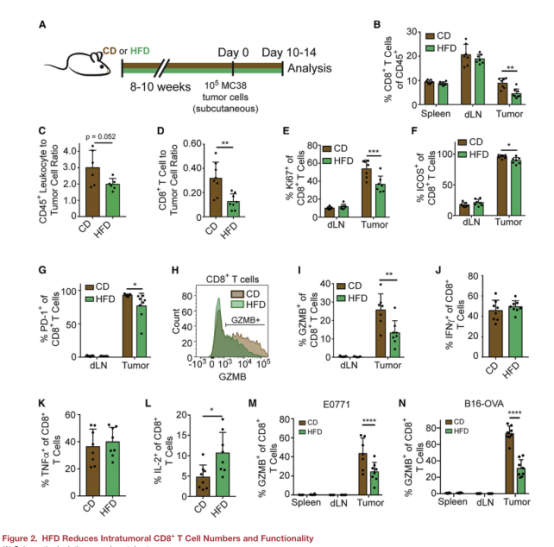
二、高脂饮食(HFD)降低肿瘤内CD8+ T细胞的数量和功能
为了了解HFD如何改变MC38肿瘤的免疫景观,文章使用流式细胞技术分析了植入10-14天的肿瘤浸润免疫细胞群(图A)。发现HFD组的MC38肿瘤中CD8+T细胞数量更少,但在脾脏和引流淋巴结中并没有减少(图B),且HFD组白细胞/肿瘤细胞比更低(图C),CD8+T细胞/肿瘤细胞比也更低(图D)。为了研究HFD对肿瘤中CD8+ T细胞活性和功能的影响,文章检测了反映T细胞功能的一些标志的情况(图E-N))。最终发现HFD在许多饮食敏感的肿瘤模型中导致肿瘤内T细胞功能降低。通过体外实验发现,CD8+T细胞增殖和状态的变化是针对体内HFD环境的,似乎不涉及T细胞激活的内在缺陷。
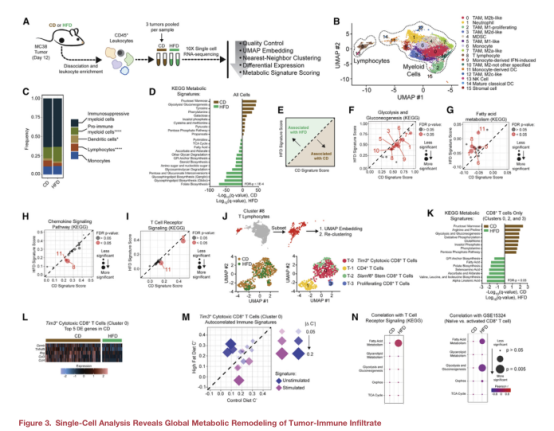
三、单细胞RNA测序提示饮食诱导肿瘤浸润免疫细胞群的改变
使用来自CD和HFD MC38肿瘤浸润CD45+白细胞进行单细胞RNA-seq,绘制肿瘤免疫转录图谱(图A),确定了16个不同的细胞簇(图B)。结果显示HFD组淋巴细胞显著减少,而免疫抑制髓系细胞群的相对比例未发生变化(图C)。为了在单细胞分辨率上绘制与肥胖相关的代谢改变,将61个KEGG代谢基因标记到所有细胞,发现CD组肿瘤的白细胞富集糖代谢及氧化还原途径,而HFD组则富集脂肪胆固醇代谢、叶酸合成、戊糖与葡糖醛酸转换相关途径(图D),且与单核细胞、T细胞和M2 TAMs相对应的聚类#6、#8和#10对HFD特别敏感(图E-G)。
对参与代谢调节和免疫活性的KEGG信号特征进行分析后,发现在T淋巴细胞(簇8)中,HFD显著降低趋化因子信号和T细胞受体信号(图H,I)。之后的T细胞亚群分类分析,发现了与T细胞活化相关的CD富集的代谢特征(图K)。由于T-2和T-3细胞群中细胞数量较少,随后文章重点分析了T-0 Tim3+细胞毒性CD8+ T细胞群。差异分析表明CD组CD8+T细胞中富集的前5个基因参与了T细胞效应功能(图L)。与未受刺激的或未受刺激的T细胞相关的信号倾向于在HFD富集,而与受刺激的T细胞对应的信号倾向于在CD富集(图M)。对T细胞刺激信号与CD组和HFD组内 CD8+T细胞的一组核心KEGG代谢途径之间的相关性进行计算发现代谢途径与HFD 组内TME中的T细胞活化更显著相关(图N)。
单细胞的分析显示,TME中的免疫细胞在响应HFD时经历了独特的代谢适应,并且这种差异在T细胞中是独特的,T细胞显示了主要中心碳代谢途径的表达改变。
四、HFD重塑TME中的肿瘤免疫景观
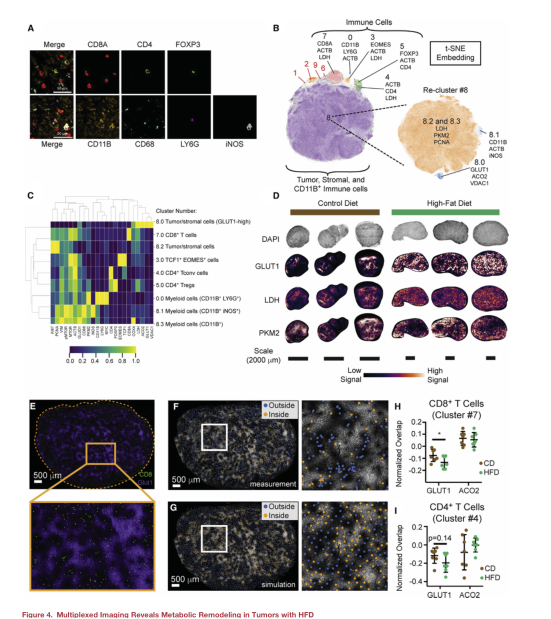
CD8+T细胞杀伤肿瘤细胞需要细胞与细胞的直接接触和足够的代谢资源。因此,为了了解肥胖是否会影响TME中TILs的位置,以及T细胞在肿瘤中的位置是否与肿瘤内代谢生态位的变化有关,使用循环免疫荧光(CyCIF)绘制了TME中细胞的位置和状态,从而实现了多路组织成像。通过对标记的表达模式和代谢特征评分计算来判定细胞群(图A-B),共识别出9个不同的细胞型(图C)。结果显示细胞类型和跨TME的代谢和细胞状态标记的表达有实质性的变化。值得注意的是,糖酵解标志物(GLUT1、PKM2和LDH)的表达在肿瘤中是不均匀的,有亮染色区域和暗染色区域(图D)。为了确定肿瘤间代谢状态的变化是否与免疫细胞的位置在空间上相关,本文测量了免疫细胞群体和肿瘤中GLUT1或ACO2高表达区域之间的重叠,将位于肿瘤内高GLUT1或高ACO2区域的CD8+T细胞的比例(图E,F)与涉及相同数量CD8+T细胞的模拟零分布进行了比较(图G),发现CD4+和CD8+ T细胞在glut1高区域的丰度明显低于预期。为了确定饮食是否会改变T细胞避免glut1高区域的倾向,将CD8+T细胞和glut1高区域的重叠百分比归一化到相应的模拟分布来控制每种组织的细胞密度差异。在HFD肿瘤中,CD8+和CD4+T细胞与GLUT1的归一化重叠减少(图H,I)。这些数据表明,HFD的摄入改变了肿瘤内的代谢生态位相互作用,并影响了局部T细胞浸润模式。
五、HFD导致CD8+T细胞和肿瘤细胞的相反代谢变化
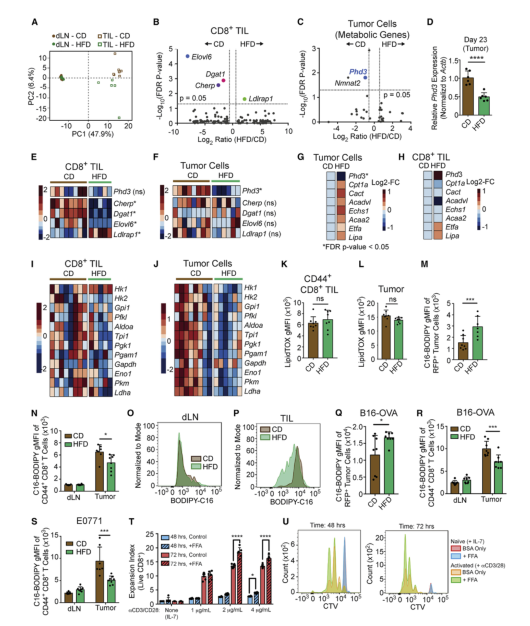
CD8+T细胞依赖许多与肿瘤细胞相同的燃料来源和代谢途径以支持增殖、生存和效应功能。为了研究饮食如何影响肿瘤中不同类型细胞的代谢重编程,使用bulk RNA-seq对GFP+ MC38肿瘤细胞、CD8+ TILs和CD8+ T细胞进行筛选。主成分分析发现,来自于肿瘤和dLN的T细胞,以及CD组和HFD组TILs发生分离(图A),提示肥胖所致的CD8+T细胞改变为TME特有。为了理解CD8+T细胞的TME特异适应性反应,对CD8+TILs转录水平的变化进行研究,发现在HFD组有4个基因的表达显著不同,其中3个与脂肪合成或胆固醇代谢有关(图B)。CD8+TILs转录水平变化与肿瘤细胞不重叠(图C-F),为HFD的独特代谢适应提供了证据。此外,还发现HFD肿瘤细胞在基因表达上和CD+TILs有差异(图G-I)。这些数据揭示了肿瘤细胞和CD8+ TILs对HFD系统应激的代谢适应,包括脂肪代谢的变化都不同。
六、HFD重新编程TME中的脂肪利用率(同五图)
中性脂质积累检测发现在两种饮食中,CD8+ TILs和MC38肿瘤细胞都含有类似水平的中性脂质(图K,L)。体外棕榈酸内流检测发现,来自HFD小鼠肿瘤细胞比CD组的摄取更多的脂肪酸(图M)。在相同的微环境中,肿瘤固有脂肪利用的改变可能会影响CD8+T细胞对脂肪的摄取。虽然饮食没有改变dLN中CD8+T细胞对棕榈酸盐的基线摄取(图N和O),但从HFD喂养的小鼠中CD44+ CD8+ TILs从培养基中获得的棕榈酸盐少于CD对照组(图N和P)。在B16-OVA-RFP和E0771肿瘤中也是如此(图Q-S)。因此,肿瘤和CD8+T细胞似乎以不同的方式重新连接它们的代谢:肿瘤细胞适应并增加脂肪酸的利用,而CD8+ T细胞没有。肿瘤细胞脂肪酸摄取增强可能导致在TME中的T细胞缺少脂肪酸,在含有少量脂肪酸的含血清的炭剥离培养基中体外激活的幼稚CD8+T细胞,在脂肪酸的补充下增殖更好(图T-U)。这些发现表明,ME中单个细胞群对系统性代谢紊乱(肥胖)产生不同的反应,导致免疫细胞和肿瘤细胞之间脂肪酸利用的差异。
七、蛋白质组学分析揭示HFD肿瘤细胞的脂肪酸摄取和氧化特征
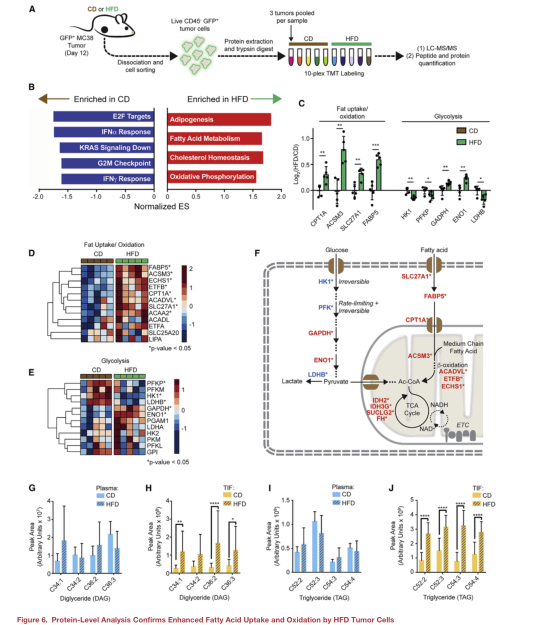
为了从分子上更深入地了解肿瘤细胞对HFD的适应,使用TMT蛋白组技术对从CD或HFD肿瘤中筛选的GFP+肿瘤细胞的蛋白质组进行了比较(图A)。发现脂肪酸代谢和氧化磷酸化是HFD肿瘤细胞中最富集的途径之一(图B)。HFD通过转运蛋白、脂肪酸结合蛋白和参与线粒体β-氧化的蛋白的诱导,支持肿瘤中的脂肪利用(图C、D和F)。相反,催化不可逆和/或速率限制步骤的糖酵解酶被HFD下调(图C-F)。
八、HFD改变TME中性脂质组成(同结果七图)
由于脂肪氧化信号在HFD的肿瘤细胞中高度富集,本文进行了靶向脂质组学,以测量HFD对循环和TME中脂质水平的影响。分析了血浆和GFP+MC38肿瘤细胞、肿瘤间质液(TIF)两个瘤内腔室的脂质组成。发现HFD组和CD组所有脂质的TIF/血浆比成正相关,甘油三酯(TAG)和甘油二酯(DAG)在对角线外,在去除了这两类脂后HFD组和CD组相关性更好,表明DAG和TAG水平是饲喂HFD小鼠TME的主要差异。TAG和DAG中的前四名(按峰值计)在HFD的TIF中显著富集,但在血浆中没有富集(图G-J)。
九、肿瘤细胞PHD3表达控制HFD的TME中脂肪酸的可用性
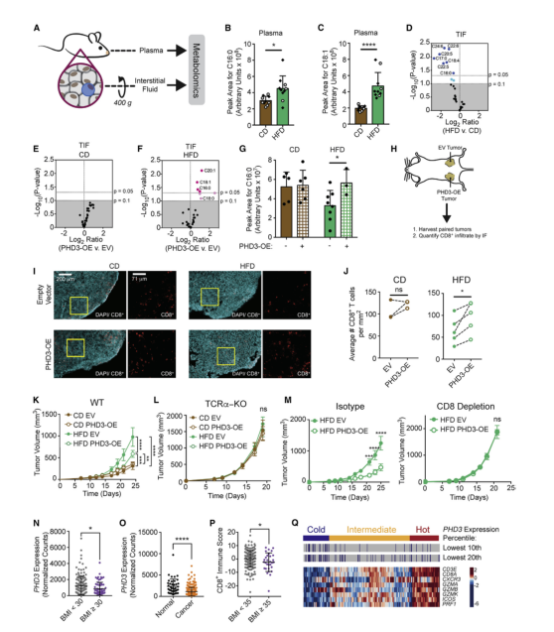
由于前面发现HFD通过重编程TME来增强肿瘤中脂肪的摄取,因此推测HFD诱导的肿瘤细胞脂肪代谢的改变可能会影响TME中FFA的有效性和CD8+ T细胞的功能。且预防HFD诱导的代谢重组可以恢复CD8+ T细胞的反应,并防止肿瘤在HFD上的增长。为了验证以上推论,在MC38细胞中过表达了PHD3。为了进一步验证肿瘤细胞中PHD3的表达调节FFAs的局部有效性的假设,文章使用靶向代谢组学测量MC38肿瘤血浆中的FFAs和TIF(图A)。发现HFD增加了许多FFAs的循环水平,包括棕榈酸和油酸(C16:0和C18:1)(图B、C)。相比之下,与CD相比,HFD组动物TIF中局部FFA水平降低(图D)。比较MC38 PHD3-OE和空载体对照肿瘤中TIF中FFA的相对水平发现PHD3过表达对CD TIF中FFA水平没有显著影响(图E),但在HFD中,一些FFA在PHD3-OE TIF中增加(7F)。循环中构成主要脂质碳源的FFAs,包括棕榈酸盐和油酸盐(C16:0和18:1),是变化显著的脂肪酸之一(图F)。值得注意的是,肿瘤细胞PHD3过表达足以恢复TME中棕榈酸的可用性(图G)。因此,恢复肿瘤细胞中PHD3表达能改变TME中的营养可用性。
此外文章测试了改变MC38细胞中PHD3的表达是否会影响CD8+T细胞对肿瘤的控制。将ev-转导和PHD3-OE MC38肿瘤细胞注射到饲喂CD或HFD的小鼠的相反侧,并测量肿瘤内CD8+ T细胞的数量和定位(图H)。MC38肿瘤切片用DAPI染色显示整体结构,然后用CD8染色显示CD8+T细胞浸润(图I)。定量图像显示HFD中CD8+T细胞减少,肿瘤周围或内部的CD8+ T细胞定位未发生重大变化(图J)。PHD3在肿瘤细胞中的过表达显著增加了HFD动物中CD8+T细胞的浸润(图J),这证明改变肿瘤细胞中的代谢途径可以通过非细胞自主机制影响肿瘤控制。
为了探索肥胖是否会改变人类患者的肿瘤代谢状况,文章分析了TCGA中可获得的结肠腺癌(COAD) RNA-seq数据集和相应的BMI数据。在BMI为R30 kg/m2的肥胖患者的肿瘤中,PHD3的表达显著降低,而PHD1或PHD2的表达则没有降低(图N)。且发现与COAD患者的正常组织相比,肿瘤组织中PHD3的表达降低(图O)。此外,严重肥胖(BMI≥35kg/m2)患者肿瘤中CD8+T细胞浸润减少(图P)。以PHD3表达为10%或20%作为切割点,将患者样本分为高PHD3或低PHD3组。然后,根据CD8+基因特征得分,将患者样本分为免疫学上的“热”、“中间”或“冷”类别(图Q)。这些数据表明,PHD3的下调发生在人类癌症中,并与免疫力的降低有关。
研究结论
肥胖是一个主要的癌症危险因素,但系统代谢的差异如何改变肿瘤微环境(TME)和影响抗肿瘤免疫尚不清楚。本文证明了高脂饮食(HFD)诱导的肥胖损害小鼠TME中的CD8+T细胞功能,加速肿瘤生长。文章生成了TME中细胞代谢的单细胞分辨率图谱,详细描述了它如何随着饮食诱导的肥胖而变化。并发现肿瘤细胞和CD8+ T细胞对肥胖表现出不同的代谢适应。肿瘤细胞通过HFD增加脂肪摄取,而浸润肿瘤的CD8+T细胞则不会。这些不同的适应导致HFD肿瘤中脂肪酸分配的改变,损害CD8+T细胞浸润和功能。阻断肥胖小鼠肿瘤细胞的代谢重编程可以提高抗肿瘤免疫。对人类癌症的分析显示在CD8+T细胞标记物中有类似的转录变化,这表明可以考虑利用代谢干预来改善癌症免疫治疗。
原文索引:
Ringel AE, Drijvers JM, Baker GJ, Catozzi A, García-Cañaveras JC, Gassaway BM, Miller BC, Juneja VR, Nguyen TH, Joshi S, Yao CH, Yoon H, Sage PT, LaFleur MW, Trombley JD, Jacobson CA, Maliga Z, Gygi SP, Sorger PK, Rabinowitz JD, Sharpe AH, Haigis MC. Obesity Shapes Metabolism in the Tumor Microenvironment to Suppress Anti-Tumor Immunity. Cell. 2020 Dec 7:S0092-8674(20)31526-9. doi: 10.1016/j.cell.2020.11.009. Epub ahead of print. PMID: 33301708.