
2022-05-31

期刊:Nucleic Acids Research
影响因子:16.97
近期,派森诺生物与华东理工大学合作,在Nucleic Acids Research上发表了题为《Xenogeneic nucleoid-associated EnrR thwarts H-NS silencing of bacterial virulence with unique DNA binding》的研究成果。文章证实了EnrR是一种能拮抗H-NS的毒力激活剂,并揭示了细菌异种基因调控因子识别和调控外源DNA的独特机制。
研究背景
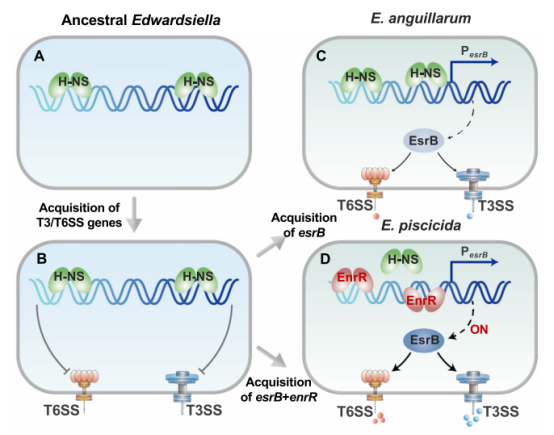
移动基因元件(MGEs)的水平基因转移是影响细菌基因组进化的主要动力。对于革兰氏阴性细菌病原体,III型和VI型分泌系统(T3/T6SS)以及其他各种毒力决定因素编码水平在基因组岛(GIs)中获得。在这里,我们鉴定了一种新的调节因子,EnrR,它位于含有MGE相关基因的GI中。EnrR通过在esrB启动子中与H-NS竞争并抑制其表达来控制T3/T6SS。EnrR以NAP的形式与细菌类核共定位。结构分析显示EnrR具有独特的DNA结合模式。
最后,我们证明了EnrR是一个独特的NAP,发挥了H-NS拮抗毒性激活剂的作用,为研究EnrR识别AT-rich DNA的机制提供了新的思路。
研究路线
研究成果
1、EnrR控制T3/T6SS在体外和体内的表达
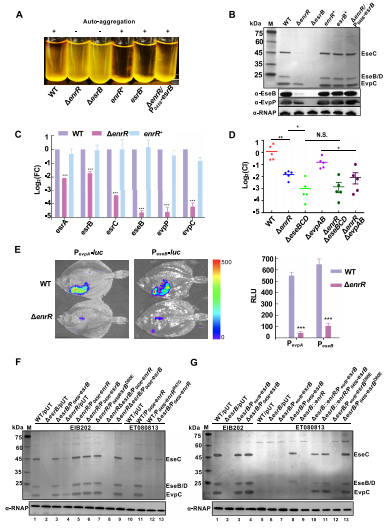
为了阐明EnrR在细菌毒力中的作用,我们研究了EnrR对细菌毒力的控制是否与T3/T6SS的表达有关。我们使用抗T3SS蛋白EseB和T6SS蛋白EvpP的血清对T3/T6SS分泌进行Western blot分析,qRT-PCR等实验进一步证实EnrR正向调控T3/T6SS的产生。接下来,利用活体生物发光成像技术研究了EnrR对大比目鱼感染过程中T3/T6SS的调控作用。实验结果均表明,EnrR控制了感染过程中T3/T6SS的体外和体内表达。
2、EnrR与esrB启动子中的H-NS竞争,激活毒力基因表达
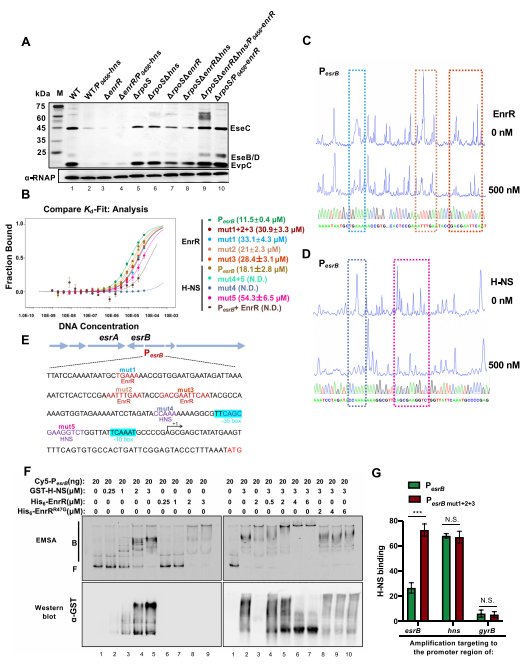
H-NS抑制爱德华氏菌T6SS基因的转录。在这里,我们证实了在wt和enrR突变株中,H-NS过表达抑制T3/T6SS蛋白和EsrB的产生。值得注意的是,H-NS是爱德华氏菌的必需基因,其缺失突变只能由另一个抑制突变产生。研究结果表明,尽管我们不能排除EnrR作为转录激活因子的活性,但EnrR在克服H-NS抑制esrB表达方面依然有很大作用。我们进一步研究了在T3/T6SS诱导条件下生长的细胞中H-NS占用对esrB启动子的影响。结果表明,EnrR 拮抗 H-NS 与 esrB 启动子区域的结合,减轻 H-NS 对主调节因子 EsrB 的抑制,从而促进毒力基因表达。
3、在体内和体外,EnrR以NAP蛋白与DNA结合为特征
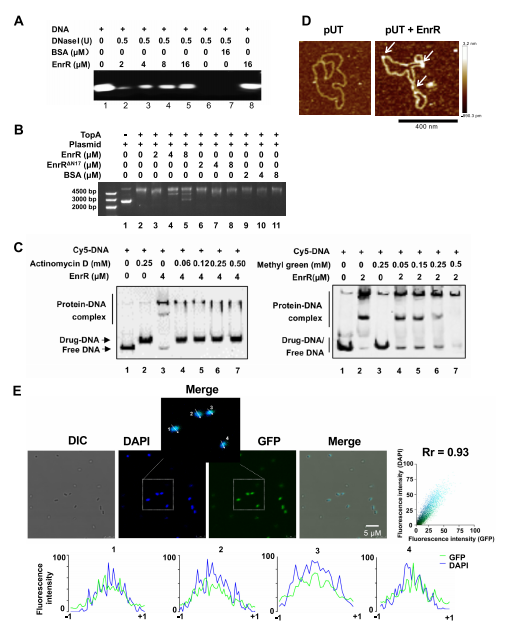
EnrR是一个小的、基础的(PI=11.4)、高表达的DNA结合蛋白,估计每个细胞约有29000个拷贝,可与H-NS丰度相媲美,并被假设为NAP。为了验证这一假设,我们做了一系列的实验。在DNA结合竞争实验中,EnrR-DNA复合物的数量随着放线菌素D和甲基绿的浓度的增加而减少,分别是特定的小槽和大槽结合药物,强烈表明EnrR可以结合DNA小槽和大槽。为了进一步研究该问题,我们做了原子力显微镜(AFM)分析、共定位实验、DAPI染色等实验,结果进一步证实了EnrR可以广泛结合到DNA、质粒和类核的不同区域。因此,我们认为EnrR代表了一个新描述的NAP。
4、EnrR靶向于含有富集AT共识序列的DNA区域
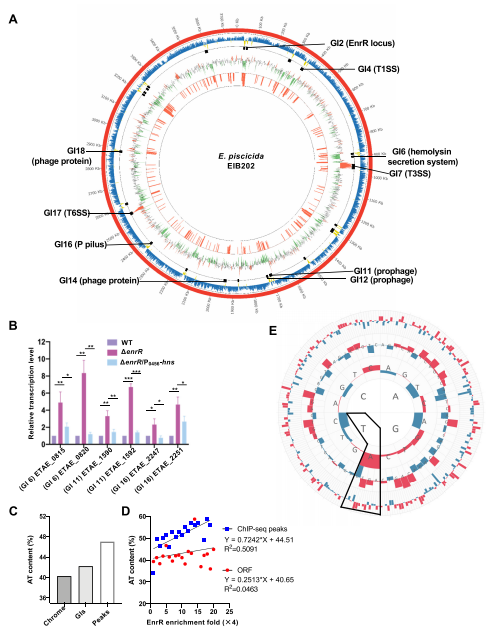
ChIP-seq和MST分析评估分析结果显示,EnrR靶向的DNA片段具有AT富集序列。重叠的ChIP-seq和RNA-seq富集区域/基因广泛分布在所有GIs对应的低G+C含量区域。qRT-PCR分析证实,EnrR株中GI6、GI11和GI16所选基因的转录水平均显著高于WT株,而在过表达H-NS的enrR/P0456-hns株中,所选基因的转录水平均降低至WT水平。
此外,对chip富集DNA序列的统计分析证实,与其他区域相比,EnrR被更密集地招募到A + T含量较高的区域,包括GI区域。以上这些结果表明EnrR是一个全局调控因子,倾向于靶向和抑制水平获得的外源富含AT基因的表达。
5、EnrR介导DNA相互作用过程中的构象变化
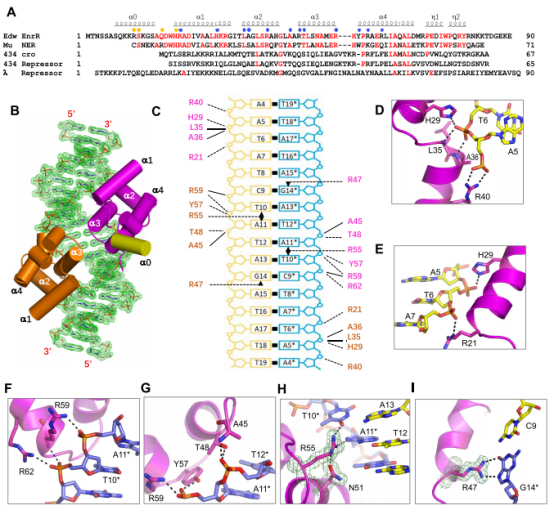
噬菌体λ和cro的抑制子和噬菌体434的抑制子的晶体结构已被报道过。EnrR和这些噬菌体蛋白都含有一个HTH基序。然而,可能由于它们的序列相似性低,EnrR的整体折叠与这些蛋白显著不同。我们发现,EnrR结合后,DNA1双链严重扭曲。除了DNA复合物,我们还解决了EnrR的一个载脂蛋白结构。虽然EnrR的载脂蛋白结构和复合物结构的整体折叠相似,但结构叠加可以揭示EnrR的一些细微构象变化。许多DNA相互作用的残基在EnrR和NER中是保守的,这表明后者在靶DNA结合方面可能遵循类似的方式。
研究结论
III型和VI型分泌系统(T3/T6SS)编码于水平获得基因组岛(GIs)中,在细菌病原体的进化和毒性中起着至关重要的作用。T3/T6SS的表达受到宿主异种消音器H-NS的严格控制,但如何抵消这一机制尚不清楚。在这里,我们报道了编码在GI中的异种核相关蛋白EnrR对病原细菌爱德华氏菌和沙门氏菌的毒力至关重要。我们发现EnrR在这些细菌中对T3/T6SS的表达起着关键作用。多种生化和遗传分析表明,EnrR结合并抑制T3/T6SS的关键调控因子esrB的启动子,通过与H-NS竞争促进其表达。
此外,EnrR靶向AT富集区,全局调节约363个基因的表达,并参与各种细胞过程。与特定的AT-rich回文DNA复合的EnrR晶体结构揭示了一种新的DNA结合模式,包括保守的hthp介导的与主槽的相互作用,以及与对称相关的双链中n端延伸到小槽的接触。综上所述,这些数据表明EnrR是一种能拮抗H-NS的毒力激活剂,突出了细菌异种基因调控因子识别和调控外源DNA的独特机制。
本研究的RNA测序工作由上海派森诺生物科技有限公司完成。
原文索引:
Ruiqing Ma, Yabo Liu, Jianhua Gan, Haoxian Qiao, Jiabao Ma, Yi Zhang, Yifan Bu, Shuai Shao, Yuanxing Zhang, Qiyao Wang, Xenogeneic nucleoid-associated EnrR thwarts H-NS silencing of bacterial virulence with unique DNA binding, Nucleic Acids Research, Volume 50, Issue 7, 22 April 2022, Pages 3777–3798, https://doi.org/10.1093/nar/gkac180