
2022-06-07

《Bioactive Materials》
影响因子:14.59
文章题目:Human bone marrow mesenchymal stem cell-derived extracellular vesicles inhibit shoulder stiffness via let-7a/Tgfbr1 axis
技术手段:外泌体smallRNA 测序等
派森诺与上海市第一人民医院携手合作,在国际著名期刊《Bioactive Materials》上发表人骨髓间充质干细胞来源的细胞外囊泡对纤维化治疗作用的研究成果。
研究背景
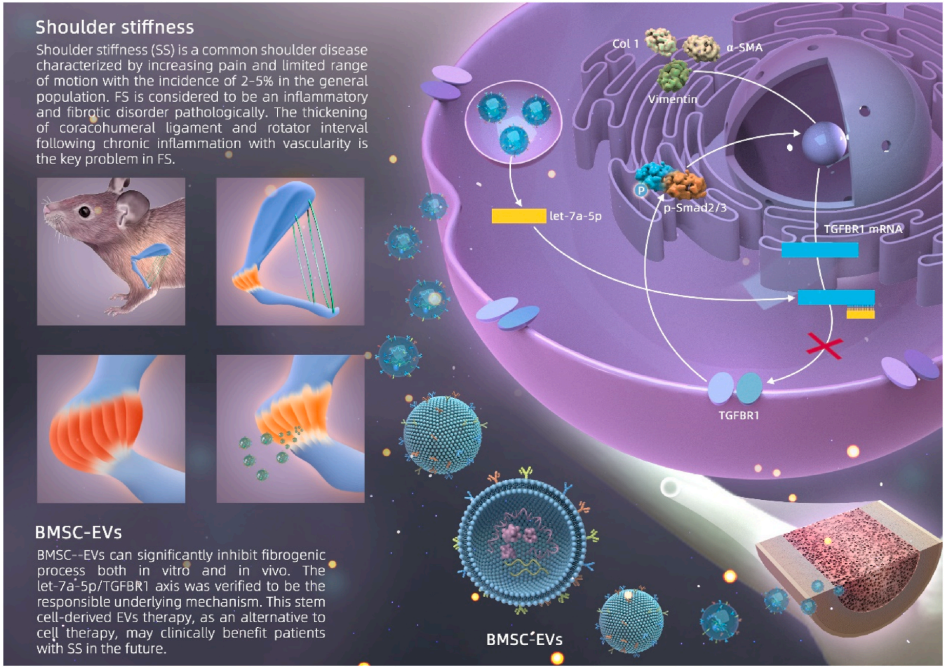
肩关节僵硬(SS)是一种常见的肩关节疾病,其特点是疼痛加重和活动范围受限。SS在病理上被认为是一种炎性和纤维化疾病。然而,对于纤维化最有效的保守治疗方法还没有达成共识。鉴于人骨髓间充质干细胞来源的细胞外囊泡(BMSC-EVs)对各种组织具有良好的治疗效果,研究通过小鼠固定模型和两种细胞模型研究了BMSC-EVs对纤维化的治疗作用。通过一系列实验发现,阐明了BMSC-EVs在肩关节纤维化中的抗纤维化作用。这项研究阐明了一种新的方法,使用干细胞来源的EV治疗作为细胞治疗的替代,这可能在未来临床受益SS患者。
技术路线
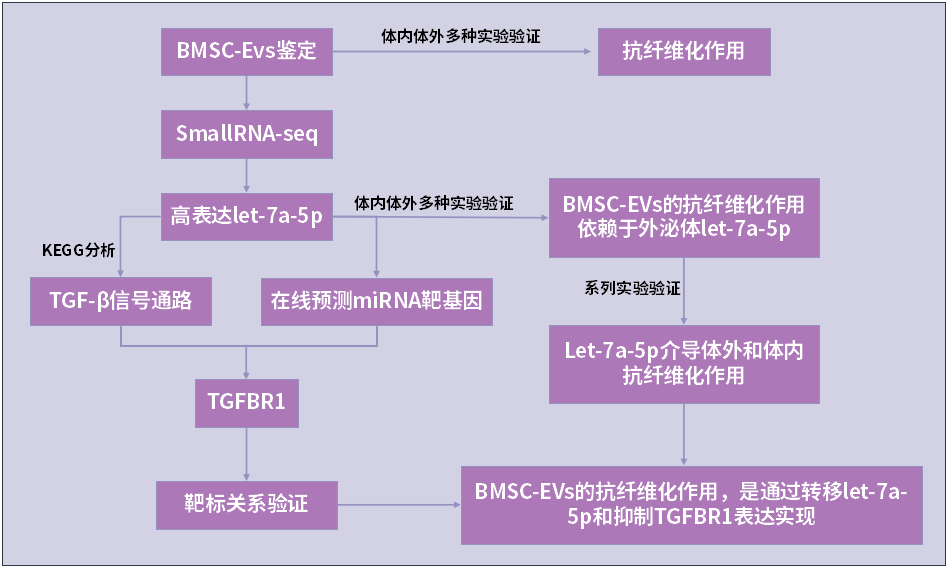
研究内容
BMSC-EVs鉴定与表征
首先,研究对骨髓干细胞诱导分化能力及生物学特性进行鉴定。进一步通过电镜、WB及NTA,对BMSC-EVs的形状、外泌体marker蛋白及外泌体直径、浓度等进行鉴定。
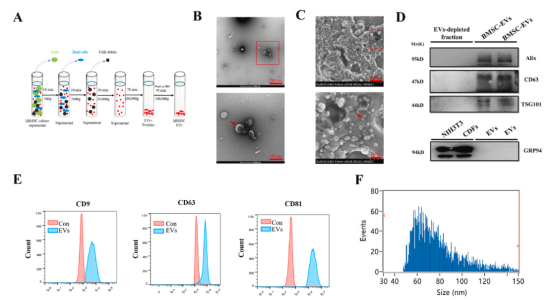
图1 骨髓间充质干细胞来源的细胞外囊泡
BMSC-EVs可抑制TGF-β诱导的体外纤维形成与小鼠模型冻结肩部
BMSC-EVs可以被来自RCT队列和NIH3T3的cdf内化。TGF-β是一种强大的促纤维化因子,存在于肩关节硬化的关节囊中,与RCT组相比,在SS组样本中高表达。因此,在体外实验中,本研究利用该因子来模拟体内纤维化的细胞外环境。通过BrdU染色、创面愈合实验和CCK-8实验(图2A至E),发现BMSC-EVs显著抑制TGF-β诱导的CDFs活性增强,且呈浓度依赖性。此外,胶原收缩分析进一步证明,BMSC-EVs抑制TGF-β干预下CDFs介导的胶原收缩(图2G, 2H定量)。同样,免疫荧光染色(图2F,图2I定量)和western blot(图2J,图2K定量)检测到TGF-β刺激CDFs中ev引起的Col 1、α-SMA和VIM蛋白表达显著降低,提示BMSC-EVs具有抗纤维化作用。实验进一步NIH3T3成纤维细胞来评价BMSC-EVs对纤维化表型的影响,使上述结果更有说服力。
随后,在SS小鼠模型上研究了BMSC-EVs对体内纤维化的影响,结果表明,BMSC-EVs在体外和体内均具有抗纤维化的潜能。
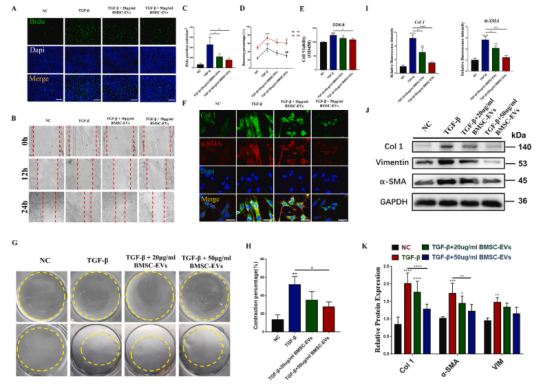
图2 BMSC-EVs可缓解TGF-β诱导的CDFs成纤维
Let-7a-5p在BMSC-EVs中高表达
为了发现具有抗纤维化作用的BMSC-外泌体miR,我们对三组BMSC-EVs进行了外泌体miRNA测序。检测出前10个表达miRNA,分别为let-7a-5p、let-7a-3p、let-7b-5p和let-7b-3p(图3A)。GO分析表明,各种生物学过程、分子功能和细胞成分都参与了mir相关功能(图3B和D,图4 G-L) 。此外,通过KEGG分析,确定了几种信号通路,其中TGF-β信号通路是著名的促纤维化信号通路,(图3C和E)。这些活动强调了抗纤维化过程中BMSC-EVs的作用。此外,PCR结果显示,不同浓度的BMSC-EVs处理后,let-7a-5p在CDFs中表达显著,而let-7a-3p、let-7b-5p和let-7b-3p的表达没有显著变化(图3I-L)。
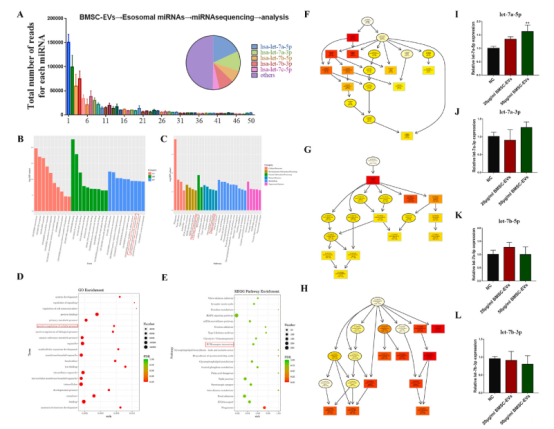
图3 SmallRNA-seq,GO/KEGG分析,验证miRNAs表达
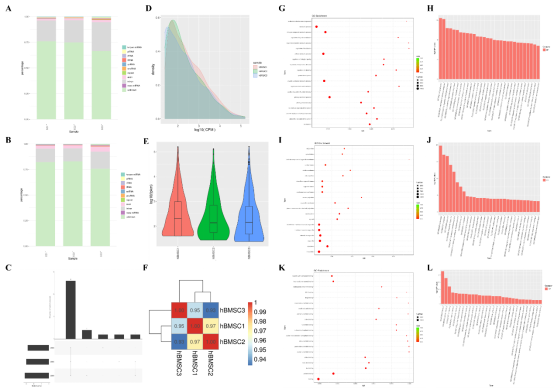
图4 测序质量和详细的GO分析信息
TGFBR1是let-7a-5p的靶标
通过miRNA在线预测网站(Targetminer, miRWalk, starBase, mirDIP)预测靶基因,然后使用DIANA工具选择KEGG预测的TGF-β信号通路中重叠的基因。最终确定TGF-β信号通路的重要受体TGFBR1为let-7a-5p的靶基因(图5A)。通过双荧光素酶报告基因检测验证靶标关系。PCR和western blot结果显示,let-7a-5p mimics明显抑制TGFBR1表达,而let-7a-5p inhibitor显著增强TGFBR1表达(图5D-F)。
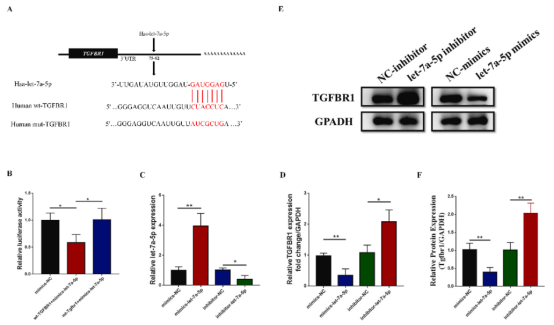
图5 TGFBR1是let-7a-5p的直接靶标
BMSC-EVs的抗纤维化作用依赖于外泌体let-7a-5p
通过系列实验发现,BMSC-EVs抑制TGF-β相关的纤维化表型。因此,实验将BMSC-EVs或BMSC-EVs let−7a−D注射到CDF中,研究发现let-7a-5p敲除显著抑制了BMSC-EVs的抗纤维化作用。在BMSC-EVs let−7a−D组中,CCK-8细胞活力、BrdU细胞增殖能力和创面愈合能力被BMSC-EVs抑制后重新上调。同时,western blot和免疫荧光结果显示,TGFBR1、p-Samd2/3、Col 1和α-SMA的表达被BMSC-EVs抑制,而在BMSC-EVs let−7a−D组中升高。进一步通过体内与体外实验验证上述实验结果。
随后,研究进行了一系列体内体外实验来验证let-7a-5p的抗纤维化潜能。这些结果表明,人类BMSC-EVs的抗纤维化作用依赖于靶向TGFBR1的外泌体let-7a-5p。
研究结论
研究阐明了BMSC-EVs的抗纤维化作用,这是通过转移let-7a-5p和抑制TGFBR1表达实现的。这项研究阐明了一种新的方法,使用干细胞来源的EV治疗作为细胞治疗的替代,这可能对未来的肩僵硬患者有临床益处。
本研究的外泌体SmallRNA测序和数据分析工作由上海派森诺生物科技有限公司完成。
原文索引:
Luo Z, Sun Y, Qi B, Lin J, Chen Y, Xu Y, Chen J. Human bone marrow mesenchymal stem cell-derived extracellular vesicles inhibit shoulder stiffness via let-7a/Tgfbr1 axis. Bioact Mater. 2022 Jan 23;17:344-359. doi: 10.1016/j.bioactmat.2022.01.016. PMID: 35386460; PMCID: PMC8965035.