
2022-06-20

《Cell Metabolism》
影响因子:27.287
近期,派森诺与复旦大学肿瘤医院以及复旦大学基础医学院合作,在Cell集团旗下的知名期刊《Cell Metabolism》(影响因子:27.287),发表重磅研究成果,可喜可贺!
本研究通过对三阴性乳腺癌患者乳腺肿瘤微环境中共生菌以及代谢产物氧化三甲胺(TMAO)进行检测,发现肿瘤共生菌借助TMAO作用于肿瘤细胞,诱导其焦亡(Pyroptosis),继而促进免疫细胞浸润,最终发挥抗肿瘤免疫治疗作用。因此,本研究提出了微生物组促进细胞微环境炎性浸润的一种新机制,为提升特异性免疫应答效率提供了全新的思路!
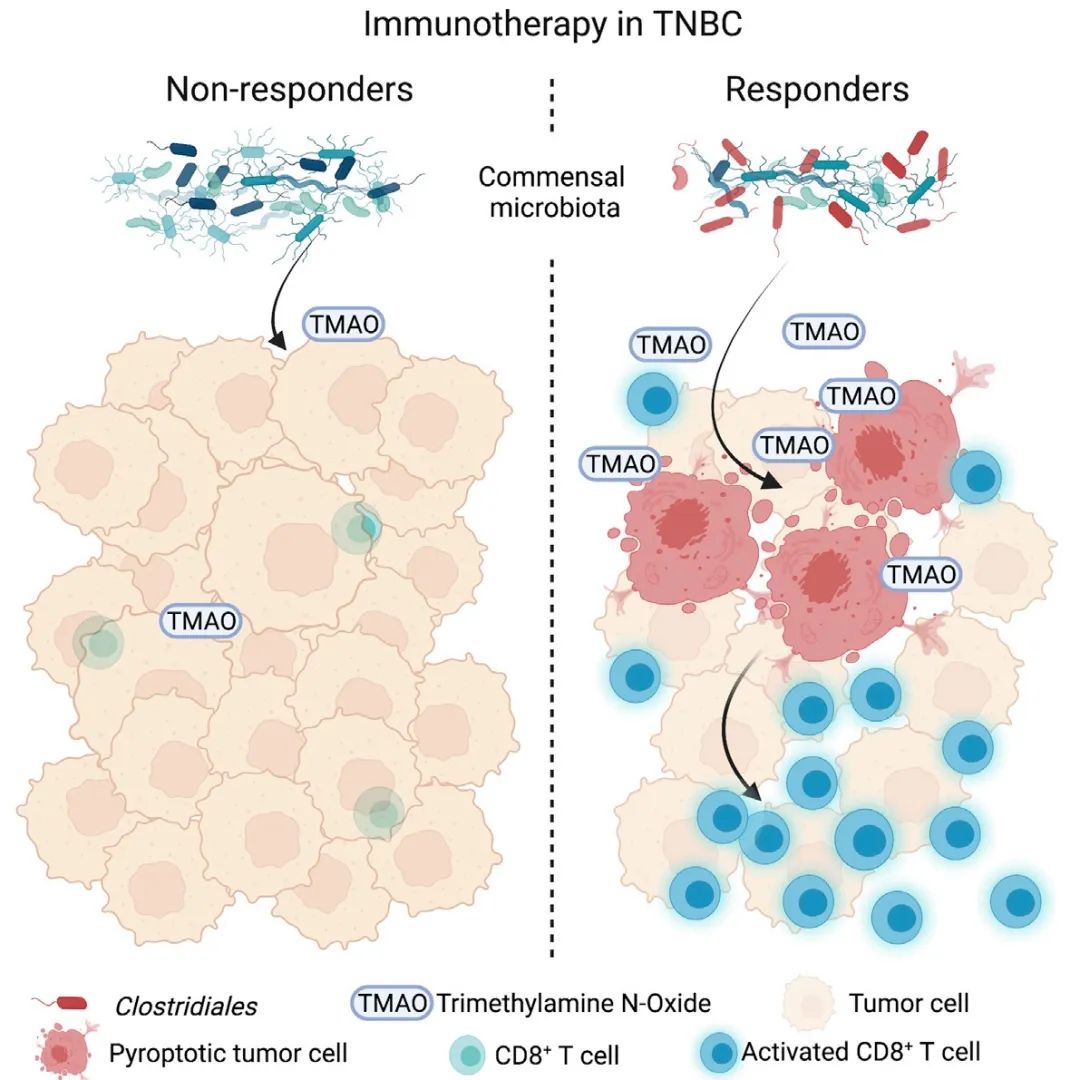
tmao通常被认为是能增加心血管等炎症相关疾病风险的“有害”代谢产物,但是对于三阴性乳腺癌而言,似乎具有积极的抗肿瘤免疫作用
研究背景
乳腺癌的发病率逐年增高,并成为中国女性发病率最高的恶性肿瘤,是名副其实的“红颜杀手”。其中,三阴性乳腺癌(TNBC)恶性程度较高,患者生存预后较差,易出现早期复发和转移,且既往缺乏有效的针对性治疗策略,素有最“毒”乳腺癌之称。
近年来,以PD-1抑制剂为代表的免疫治疗成为TNBC颇具前景的治疗手段。但即便如此,随着临床研究的不断深入,仍有相当一部分患者难以从免疫治疗中获益。前期研究发现,TNBC中有一类独特的免疫调节亚型(Immunomodulatory,IM),患者有较为活化的免疫微环境特征,有可能进一步提高精准治疗疗效,使患者从免疫治疗中获益。
本文与常见研究中报道的抗肿瘤激活剂直接作用于免疫细胞发挥功效不同,本研究从独特视角出发,发现特殊微生物群落借助代谢产物氧化三甲胺(Trimethylamine N-oxide,TMAO),能够直接作用于肿瘤细胞,诱导其焦亡,继而促进免疫细胞浸润,最终发挥抗肿瘤作用。
研究方法
本研究借助组学分析,检测了TNBC患者IM亚型和非IM亚型肿瘤的微生物组成。结合代谢数据探讨了梭菌相关代谢产物TMAO在IM亚型患者肿瘤中的含量以及与微环境内免疫细胞和免疫因子的相关性。同时,本研究后续结合大量体内、体外实验以及分子生物学实验探讨了TMAO能够抑制TNBC肿瘤生长,提高免疫治疗疗效的机制。最后,通过给小鼠喂食TMAO前体代谢产物胆碱证实补充胆碱摄入可以激活TNBC抗肿瘤免疫,提高免疫治疗疗效。
研究方法:小鼠粪便16S rRNA基因V3V4区测序+QIIME2分析流程;色谱和质谱检测分析
测序平台:Illumina MiSeq高通量测序平台
研究结果
太长不看版
对三阴性乳腺癌(TNBC)队列(n=360)的多组学分析发现,免疫调节亚型(肿瘤微环境免疫活化)患者的肿瘤组织中,Clostridiales目的多个菌属及相关代谢产物氧化三甲胺(TMAO)丰度升高,且较高的血浆TMAO水平与较好的免疫治疗应答相关;
细胞和TNBC小鼠实验表明,TMAO通过活化内质网应激激酶PERK来诱导GSDME介导的癌细胞焦亡,从而增强CD8+ T细胞介导的抗肿瘤免疫;
为TNBC小鼠补充膳食胆碱(TMAO前体)能提高肿瘤TMAO水平,增强免疫治疗应答。
结果详解
首先,染色实验发现,细菌在TNBC患者的肿瘤组织中定殖,并通过微生物组成和差异分析,发现TNBC的IM和非IM亚型之间,在测序数据总读数和菌群多个分类水平上存在差异。而LEfSe分析的结果表明,在属水平上,Clostridiales目的Blautia、Ruminococcus、Faecalibacterium、Dorea、Tyzzerella和Roseburia差异显著。这些微生物能产生TMAO的前体三甲胺(TMA)。进一步研究显示,TNBC的IM亚型中,厌氧微生物编码三甲胺裂解酶的cutC基因的相对丰度、TMAO浓度、CD8+ T细胞浓度和IFNG mRNA的表达都显著高于TNBC的其他亚型。这些结果表明,共生微生物群落的组成在不同亚型的TNBC微环境之间是不同的,并且微生物代谢产物TMAO和能够调节TNBC免疫微环境的物质之间,存在正相关性。
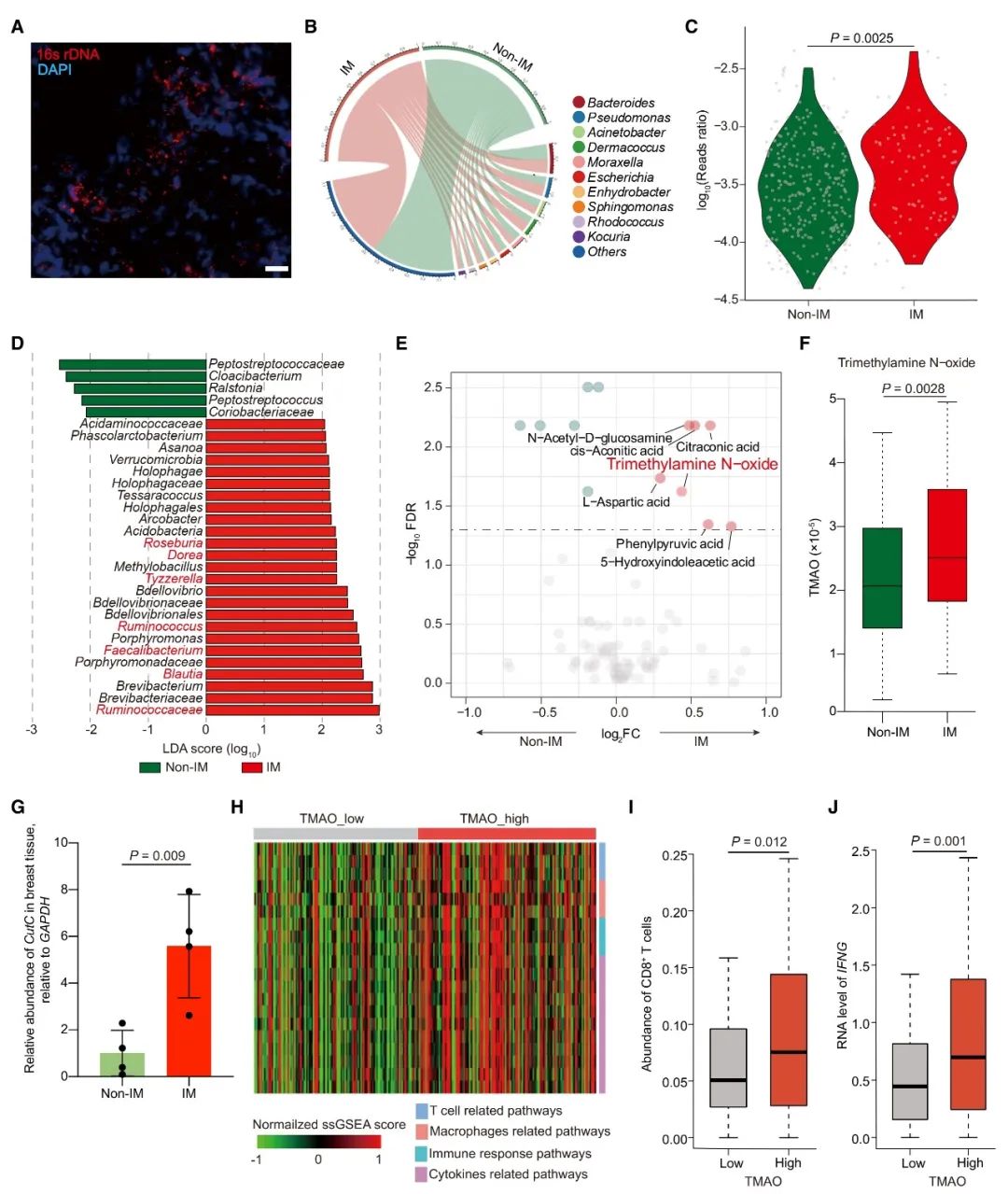
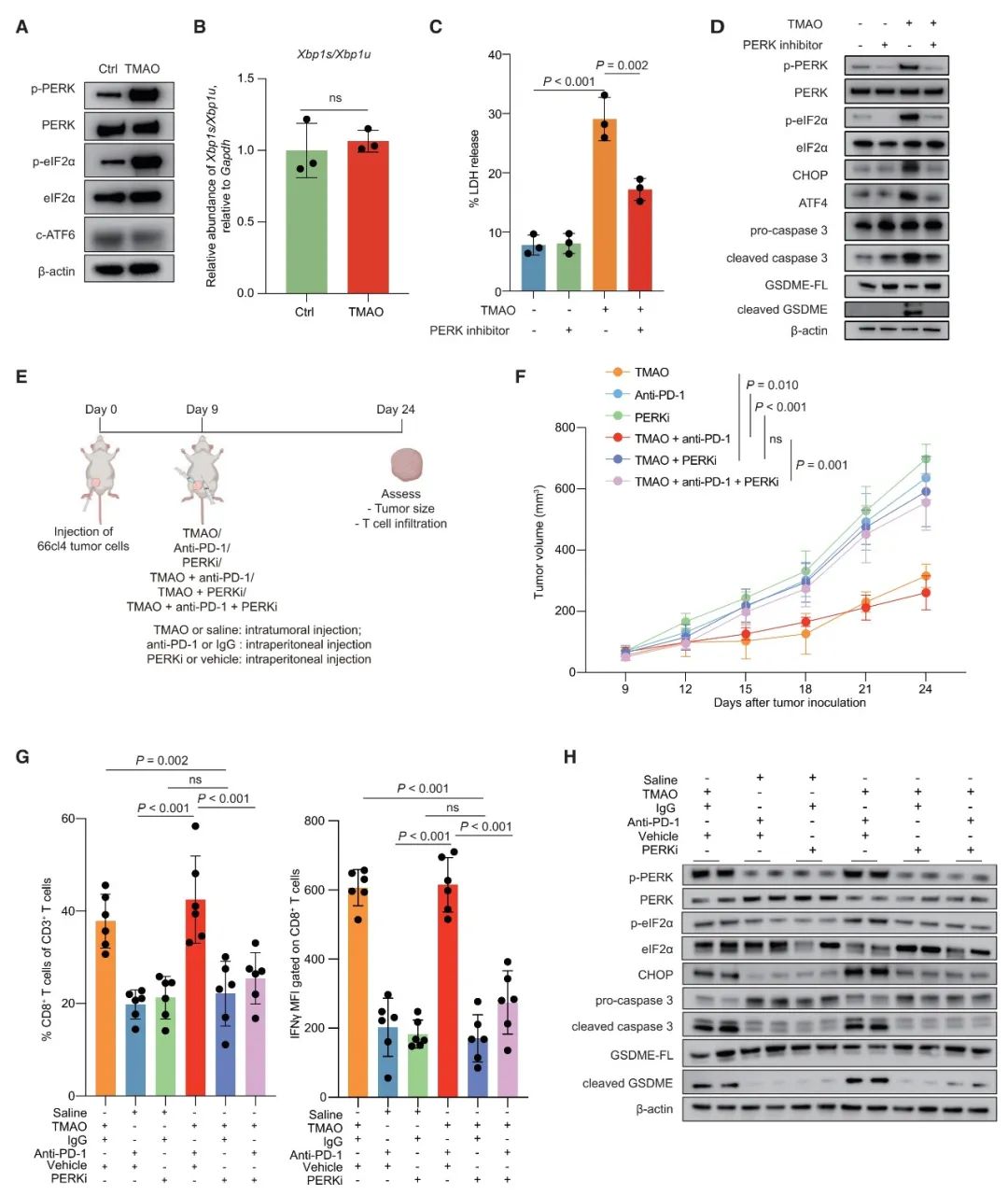
基于小鼠模型的体内研究结果表明,联合注射TMAO和PD-1抗体,比单独注射PD-1抗体更显著地抑制肿瘤生长。此外,肿瘤内注射TMAO显著促进CD8+ T细胞和M1巨噬细胞的浸润,并增强CD8+ T细胞的功能以及提高IFN-γ和TNF-α水平。同时,TMAO促进了TNBC小鼠模型的抗肿瘤免疫并增强了PD-1抗体的功效。这说明在肿瘤微环境中升高的TMAO水平,能有效地增强抗肿瘤免疫力并抑制了肿瘤的生长。为了确定TMAO是否在动物体内通过激活CD8+ T细胞调控的抗肿瘤免疫,从而抑制肿瘤生长,使用CD8+ T中和抗体耗尽了小鼠体内的CD8+ T细胞。结果发现,CD8+ T细胞的消耗减弱了TMAO的抗肿瘤作用。这也表明CD8+ T细胞在TMAO介导宿主抗肿瘤免疫的过程中发挥了重要作用。
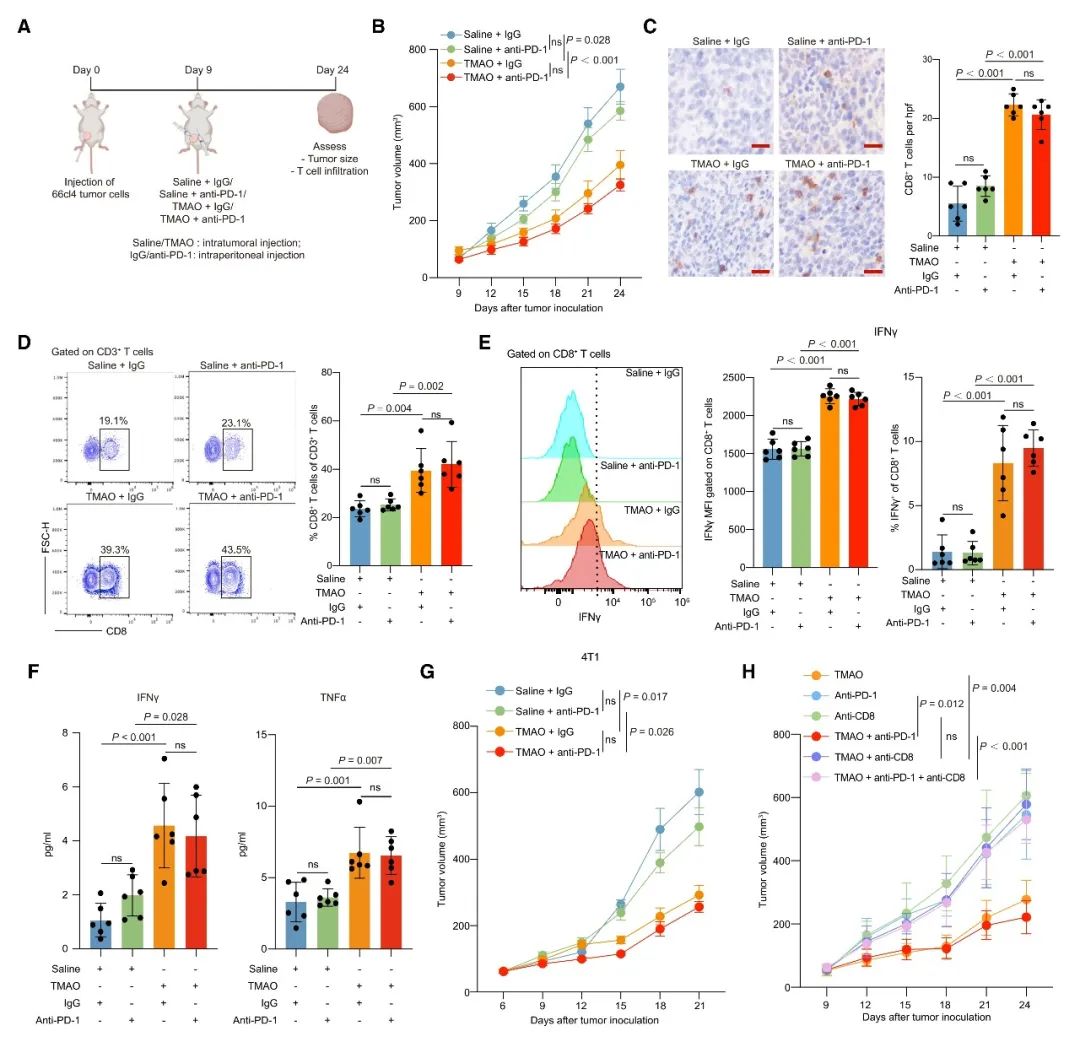
本研究进一步通过体外细胞实验,阐述了TMAO激活抗肿瘤免疫的机制。通过细胞形态学观察以及两种焦亡相关蛋白caspase和GSDME的检测,表明TMAO能诱导肿瘤细胞焦亡。为了评估GSDME是否在介导TMAO诱导的焦亡中起主要作用,本研究还同时进行了体内和体外的基因敲低实验。实验结果显示,TMAO增强了CD8+ T细胞的毒性功能,当敲低GSDME时减弱了TMAO诱导的抗肿瘤免疫力。此外,在注射TMAO的肿瘤中检测到IL-1β和IL-18水平升高,当敲低GSDME时减弱了肿瘤组织中IL-1β和IL-18的分泌。而这两种炎症因子在细胞焦亡过程中分泌并激活肿瘤微环境中的抗肿瘤免疫。这些结果都表明了TMAO可通过诱导GSDME介导的细胞焦亡来激活TNBC的抗肿瘤免疫。
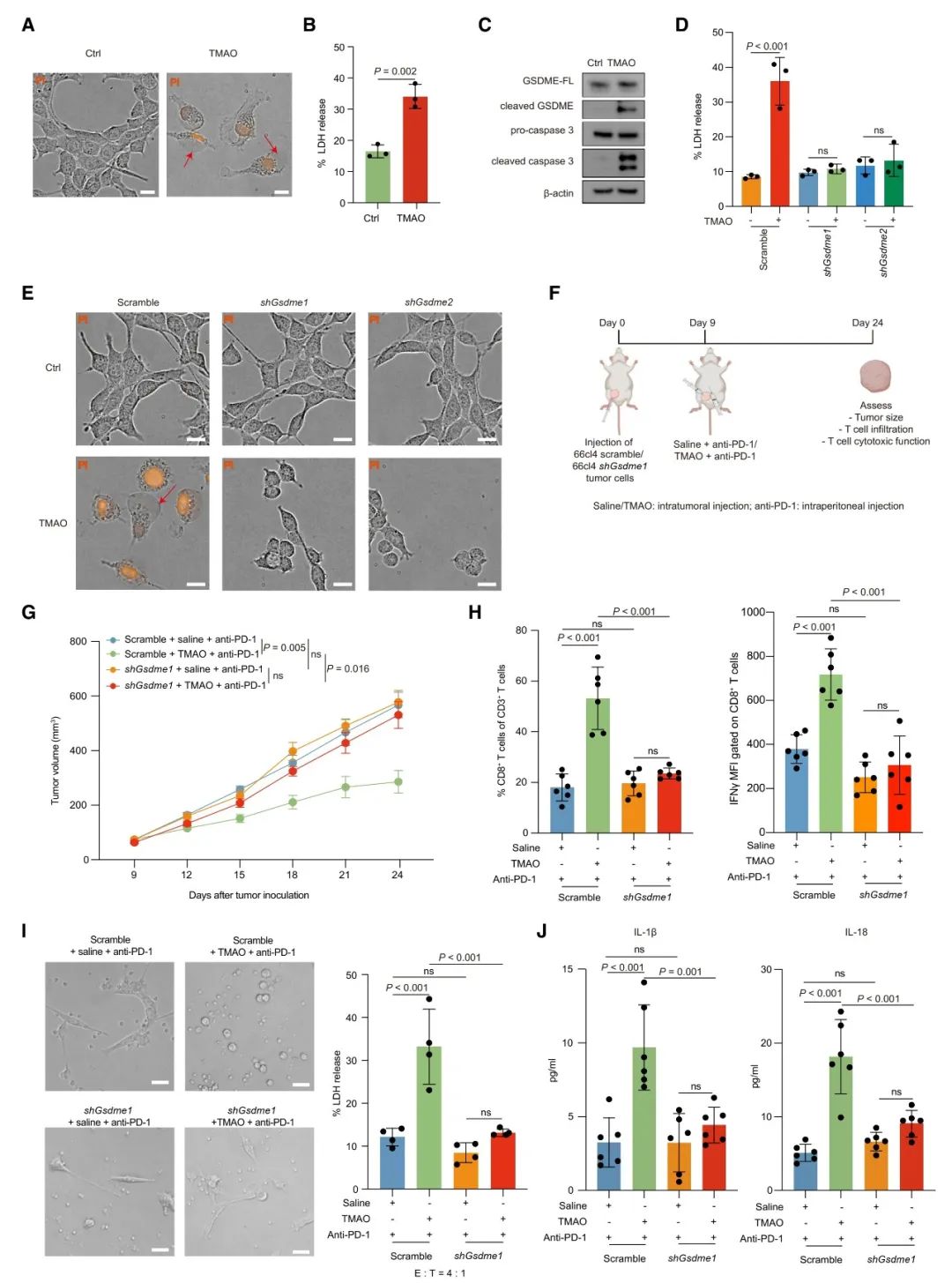
本研究结果也表明,TMAO通过GSDME介导细胞焦亡的机制是受内质网应激调控的。通过PERK抑制剂抑制PERK基因在体内和体外试验中的表达,发现与对照组相比,TMAO处理显著抑制肿瘤生长并促进CD8+ T细胞浸润,而PERK抑制剂减弱了TMAO诱导的抗肿瘤免疫。此外,对模型小鼠使用PERK抑制剂时,抑制了TMAO诱导的内质网应激以及GASDME介导的PERK依赖性途径的焦亡。由此可见,微生物代谢物TMAO能激活PERK介导的内质网应激,从而调控GASDME介导的焦亡在肿瘤细胞中的免疫作用。
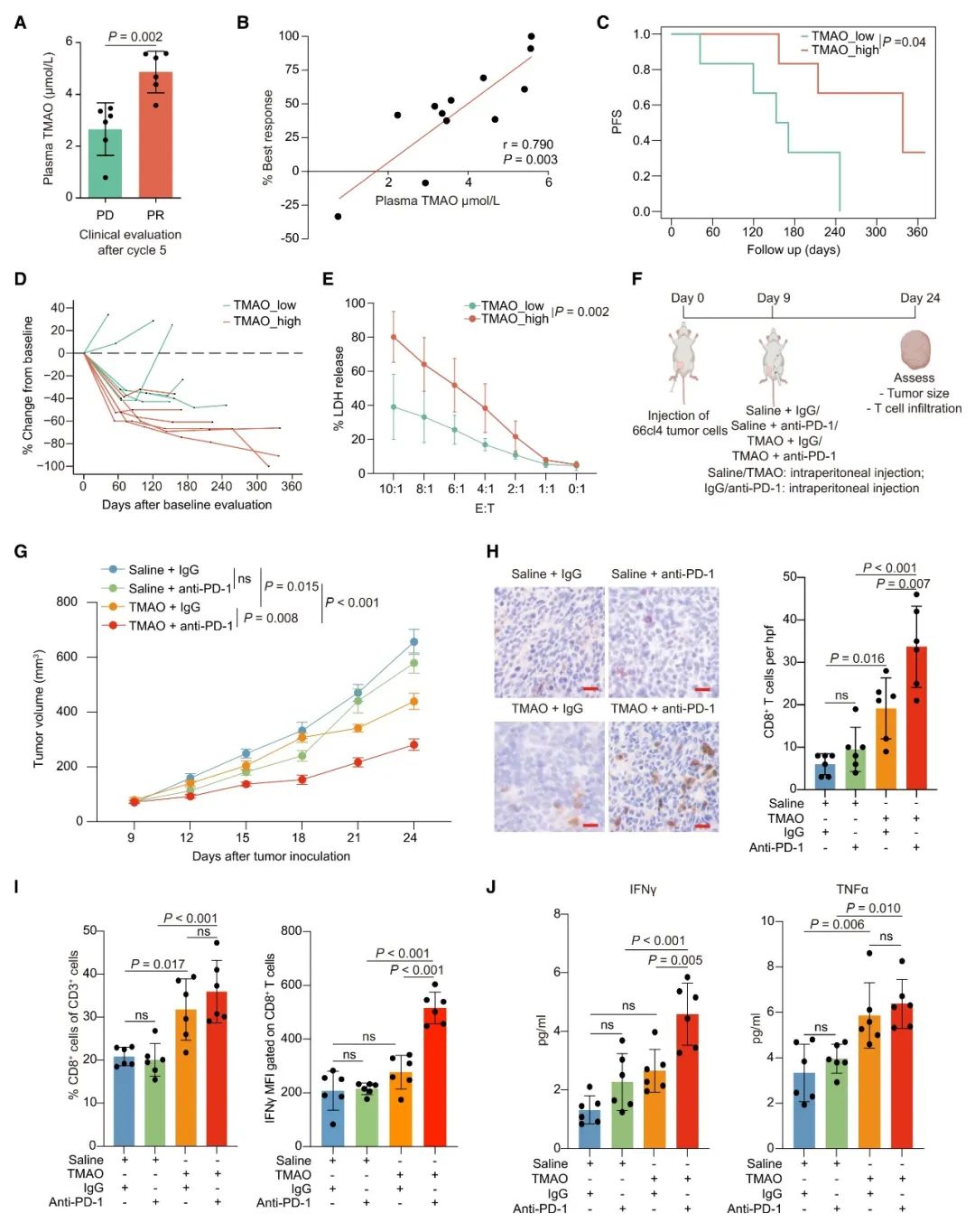
为了评价血液中的TMAO是否也能激活TNBC中的抗肿瘤免疫,本研究也收集了接受PD-1抑制剂治疗的患者血浆样本并检测其中的TMAO含量。结果表明,血浆TMAO浓度与免疫治疗的最佳反应呈正相关。此外,血浆TMAO浓度高的患者,有更长的生存期和更好的免疫治疗反应。而对血浆中分离的CD8+ T细胞的体外实验结果表明,血浆TMAO浓度更高的患者分离的CD8+ T细胞在共培养实验中,表现出更强的细胞毒性活性。这将更有利于患者的免疫治疗。
由于血浆TMAO含量高的患者对免疫治疗展现出更好的效果,本研究继续通过实验动物模型探讨了血浆TMAO升高是否可以激活抗肿瘤免疫并抑制体内肿瘤生长。结果显示,腹膜内共同注射TMAO和PD-1抗体的小鼠,比单独注射PD-1抗体的小鼠更显著地抑制体内肿瘤的生长。此外,与单独注射PD-1抗体的小鼠相比,在腹膜内共注射TMAO和PD-1抗体的小鼠观察到CD8+ T细胞浸润增加和IFN-γ水平升高。这些结果都表明,增加血液TMAO含量能够增强PD-1抗体对TNBC的抗肿瘤免疫,并抑制肿瘤的生长。
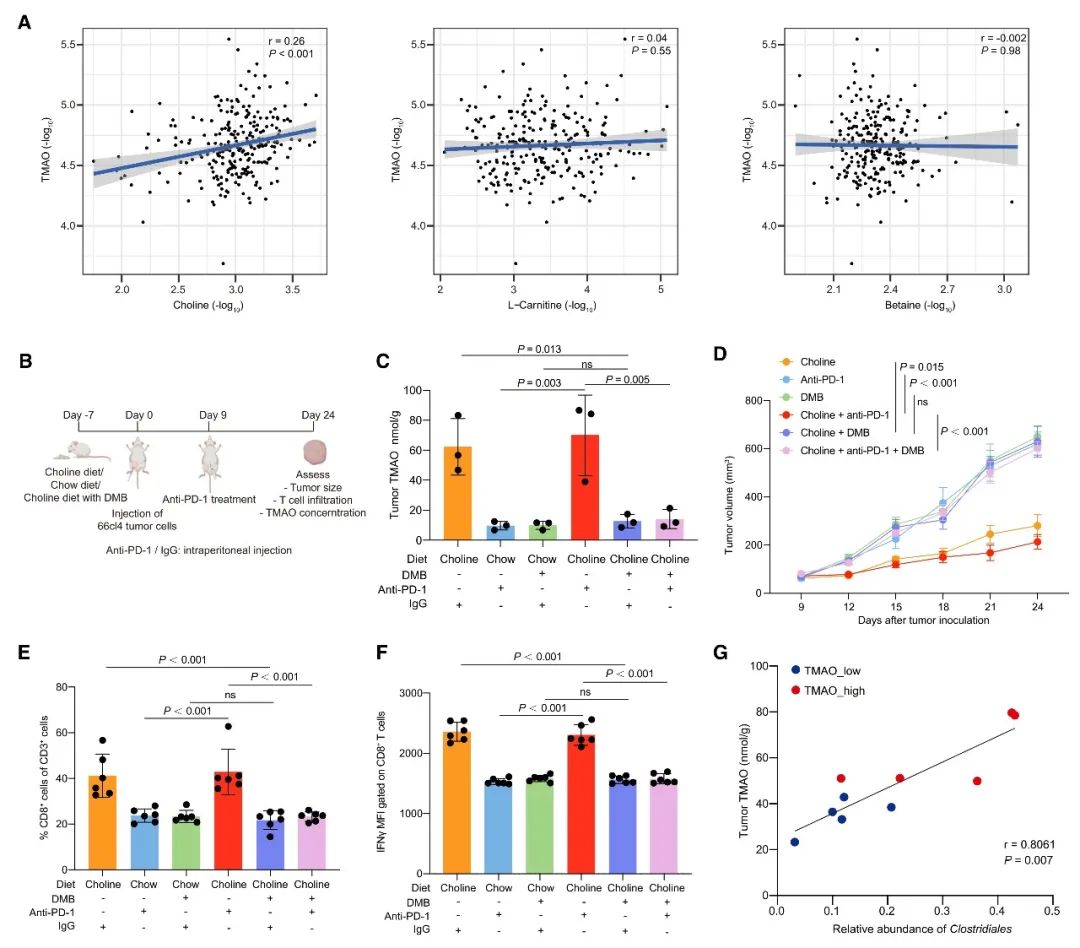
最后,本研究还发现,通过饲喂富含胆碱的饮食可上调小鼠肿瘤组织中的TMAO,并增强CD8+ T细胞浸润,从而抑制肿瘤生长。而通过对小鼠粪便进行16S rRNA基因测序,发现肿瘤TMAO含量较高的小鼠和肿瘤TMAO含量较低的小鼠的粪便菌群差异明显。肿瘤TMAO含量较高的小鼠粪便中,Clostridiales目的相对丰度显著升高,并与肿瘤TMAO浓度呈正相关。同时,小鼠粪便中差异微生物的变化与TNBC患者肿瘤中观察到的差异菌群的变化基本一致。由此表明,共生肠道微生物组可以调节肿瘤的TMAO水平,而富含胆碱的饮食可能是激活TNBC患者的抗肿瘤免疫的潜在可行的治疗方法。
研究结论
综上所述,本研究提供了共生菌群影响宿主肿瘤免疫能力的新视角。特定的微生物代谢产物及其前体分子可作为调节肿瘤免疫微环境,从而改善TNBC免疫治疗效果的潜在干预策略。因此,微生物代谢产物TMAO可能具有提高TNBC免疫治疗效果的临床潜力,为TNBC的精准免疫治疗提供了新的思路;
值得注意的是,TMAO被认为是能增加心血管等炎症相关疾病风险的“有害”代谢物,而本研究则再次提醒,菌群及其代谢物的好与坏不能一概而论,而是需要具体情况具体分析;
同时,本研究证实,补充胆碱摄入可以激活TNBC抗肿瘤免疫,提高免疫治疗疗效。胆碱是人体日常摄入的营养物质之一,常见于蛋白、鱼肉、牛肉中,安全性较好,在以往临床中常被用作营养补剂。因此,补充胆碱摄入有望成为提高TNBC免疫治疗疗效的临床潜在治疗策略。
本研究的测序和部分数据分析工作由上海派森诺生物科技有限公司完成。
文章索引:
Wang H, Rong X, Zhao G, Zhou Y, Xiao Y, Ma D, Jin X, Wu Y, Yan Y, Yang H, Zhou Y, Qian M, Niu C, Hu X, Li DQ, Liu Q, Wen Y, Jiang YZ, Zhao C, Shao ZM. The microbial metabolite trimethylamine N-oxide promotes antitumor immunity in triple-negative breast cancer. Cell Metab. 2022 Apr 5;34(4):581-594.e8. doi: 10.1016/j.cmet.2022.02.010. Epub 2022 Mar 11. PMID: 35278352.