
2022-07-22

《Journal of Advanced Research》
影响因子:12.822
最近,派森诺与上海交通大学医学院附属第九人民医院合作,在知名期刊《Journal of Advanced Research》发表论文,解析了高血压疾病条件下口腔-肠道微生物传播的影响与关联。运用16S和宏基因组研究方法,得到以下几个方面的重要成果:
本研究为支持口腔微生物群与高血压之间的强关联提供了全面的证据。本文发现在高血压患者中有14个唾液-属和15个龈下菌斑-属发生了显著改变。
首次发现有15个口腔微生物菌属与血压有关。口腔微生物群和其他临床参数之间也建立了新的联系。
本研究鉴定了唾液、龈下菌斑和粪便中共存的物种,并说明了口腔和肠道样本类型之间的共存物种之间的关联。
本研究确定了高血压患者中重要的口腔-肠道传播微生物。5个属水平下的16个物种被确定为口腔-肠道递质。特别是物种Veillonella被确定为在高血压参与者中稳定富集的口腔-肠道递质。
这项研究已经在动物研究中证明了口肠微生物传播和高血压之间的潜在因果关系——来自高血压参与者的唾液加剧了血管紧张素-II诱发的高血压。Veillonella可以在所有接受人类唾液的小鼠的肠道中定植,而在接受高血压参与者唾液的小鼠的肠道中更丰富。
研究背景
有相当多的证据表明牙周炎(Periodontitis,PD)与高血压(Hypertension,HTN)有关,但这种联系背后的机制尚不清楚。同时,口腔微生物群失调会加重不同的系统性疾病,但高血压患者中口腔微生物群的改变及其对血压的影响仍有待研究。因此,本文以此为切入点,旨在表征口腔和肠道微生物群的变化及其在高血压中的作用。
研究方法
本文通过HTN和no-HTN的比较,分析口腔和肠道微生物群在HTN中的作用。然后,对C57BL/6J小鼠进行抗生素预处理,以耗尽肠道微生物群,再通过灌胃移植人唾液,以检测口腔-肠道微生物异常传播对HTN的影响。
实验对象
唾液,龈下菌斑,粪便
测序区域
16S rRNA基因V3V4区测序+宏基因组测序
测序方法
Illumina NovaSeq
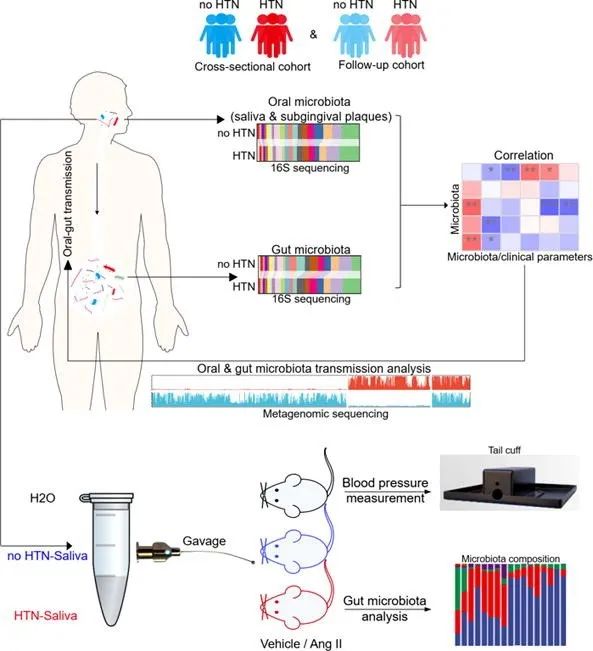
研究结果
①临床数据分析
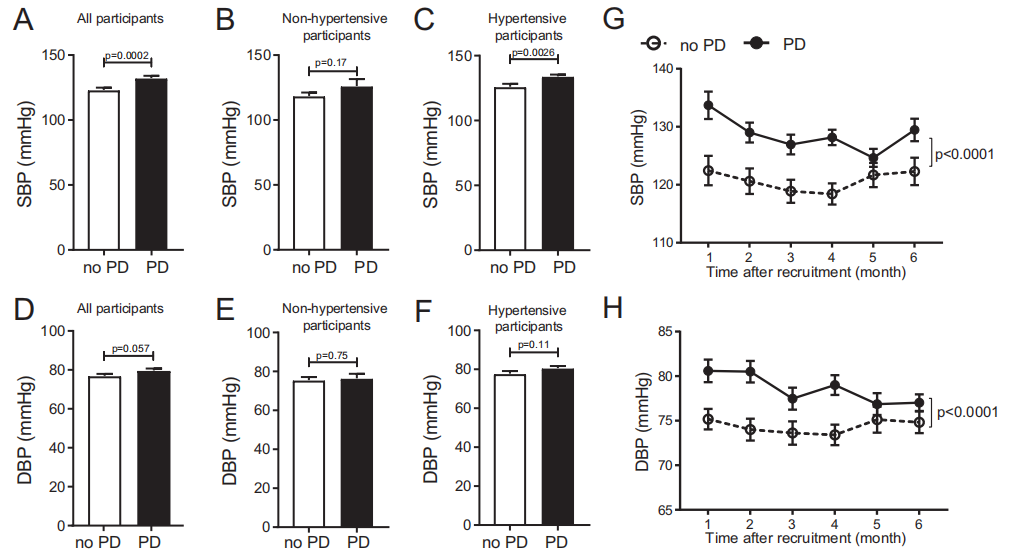
通过测定参与人群的收缩压和舒张压,发现牙周炎患者的血压更高,说明了牙周炎与血压升高相关。
②高血压患者的菌群组成和多样性变化
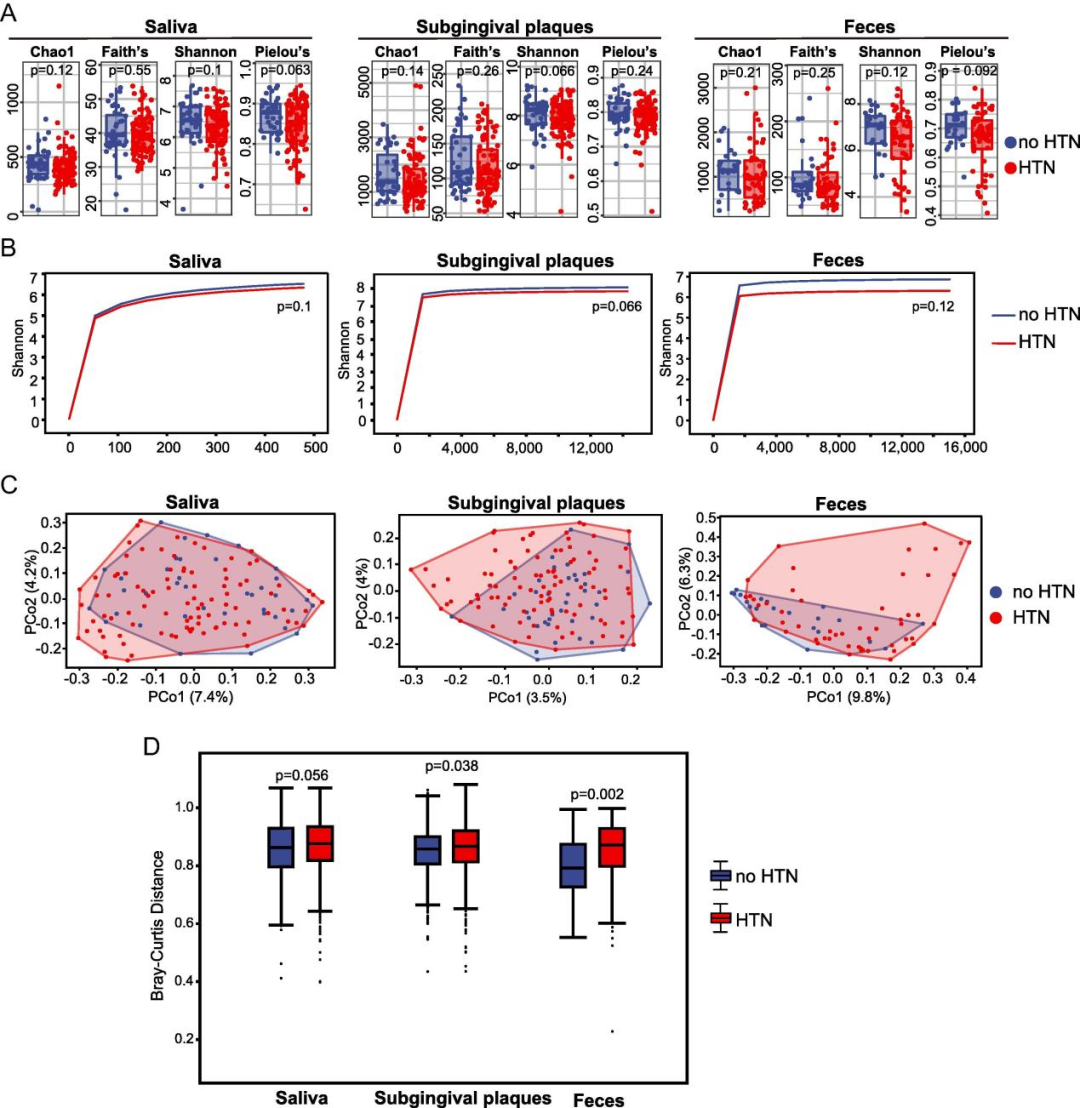
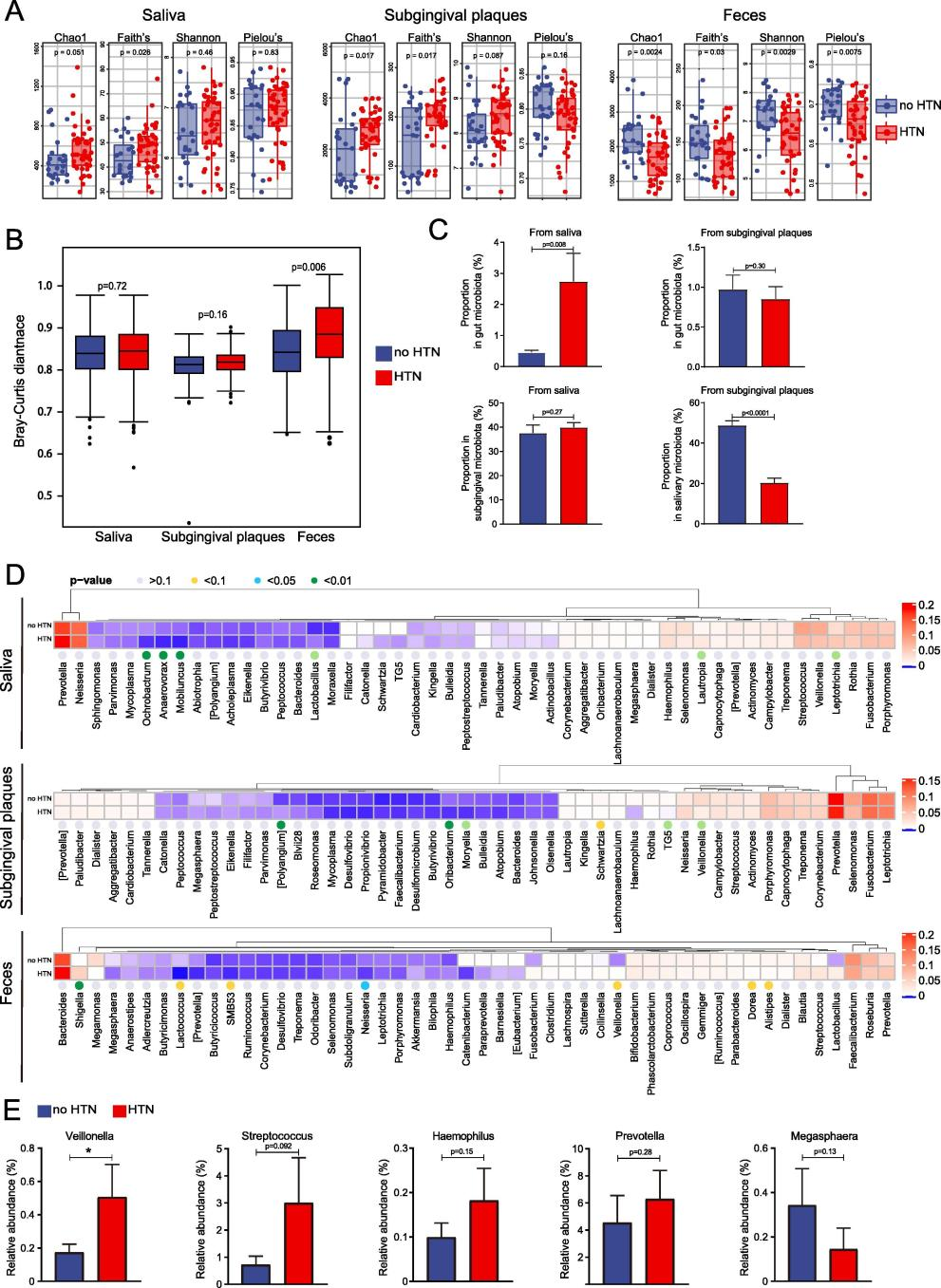
通过alpha多样性分析,发现, Chao1, Faith’s PD, Shannon 和 Pielou’s Evenness 指数,HTN组均低于no-HTN组,也就是高血压患者的口腔微生物和肠道微生物的alpha多样性指数都要比非高血压人群的低,虽然没有一个差异达到统计学意义。而PCoA分析表明,HTN组和no-HTN组的口腔微生物群和肠道微生物群都有显著差异。
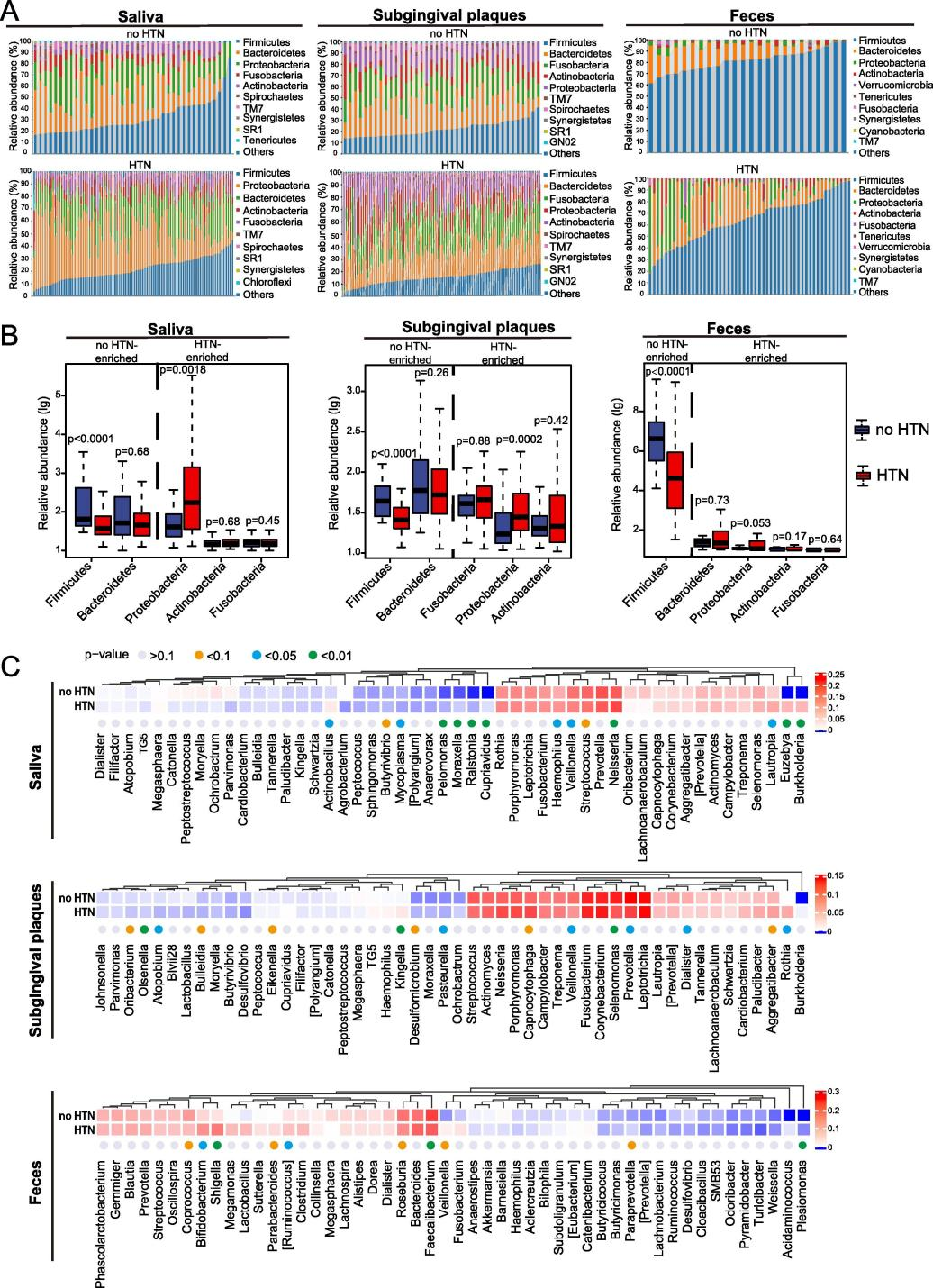
紧接着进行物种组成分析,其结果表明了HTN患者和no-HTN人群的口腔和肠道微生物群的组成差异。门水平上,唾液和龈下菌斑的优势门有厚壁菌门、拟杆菌门、变形菌门、放线菌门和梭菌门。粪便中是厚壁菌门和拟杆菌门。在所有 3 种类型的样品中,与no-HTN组相比,HTN中的厚壁菌门显著减少,并且HTN组的唾液和龈下菌斑中的变形菌门显着增加。同时,又在属水平上进一步分析了微生物群的组成,发现在前50个属中,唾液微生物群14个属,牙龈下微生物群15个属,肠道微生物群10个属,在HT组与no-HTN组之间存在显著差异。
③口腔/肠道微生物群与血压等临床参数的关联分析
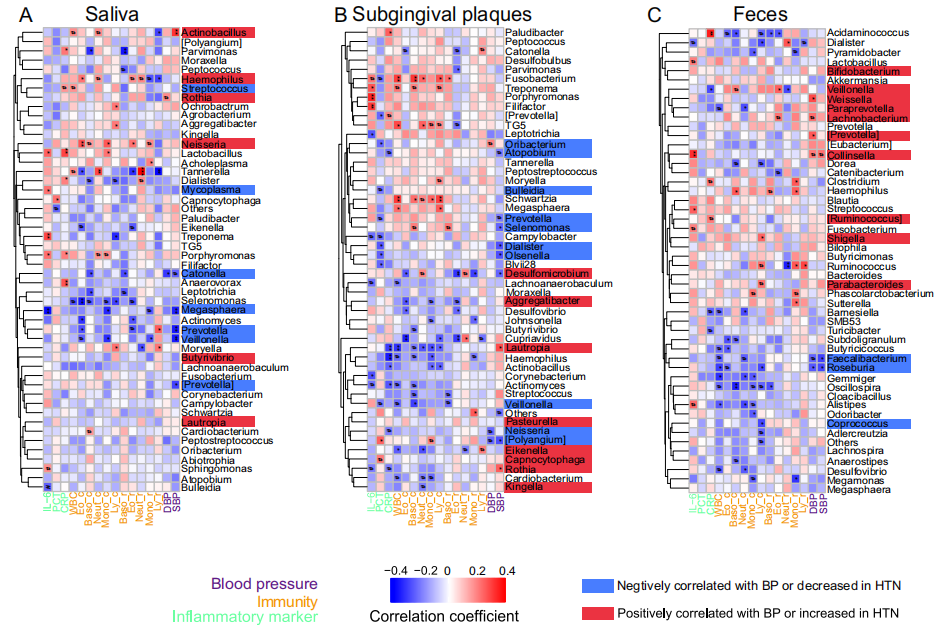
为了评估HTN患者中口腔和肠道微生物群改变的临床意义,本文采用斯皮尔曼相关分析来评估临床参数(血压、免疫力、炎症标志物)与唾液、龈下菌斑和粪便中前50个属的相对丰度之间的相关性。本文首先研究了菌群与BP之间的关系。所有与BP显著正相关或HTN显著升高的属用红色显示,所有与BP显著负相关或HTN显著降低的属用蓝色显示。具体表现为:
在唾液中,SBP与Actinobacillus呈正相关,与Catonella、Megasphaera、Prevotella、Veillonella和[Prevotella] 呈负相关;DBP与Rothia呈正相关,与Catonella呈负相关。
在龈下菌斑中,SBP与Lautropia 、Rothia呈正相关,与Atopobium、Prevotella、Selenomonas、Dialister、Olsenella、Desulfomicrobium和 [Polyangium]呈负相关;DBP与Oribacterium呈正相关,与[Polyangium] 和 Neisseria呈负相关。
在粪便中,SBP和DBP都与Collinsella呈显著正相关,与Faecalibacterium 和Roseburia呈负相关;同时,DBP与Weissella, Lachnobacterium, 和[Prevotella]呈显著正相关。
同时,鉴于炎症在HTN中的重要性,又分析了炎症标志物和微生物群之间的关系,发现牙周炎(PD)相关菌属,比如唾液中的Porphyromonas, 龈下菌斑中的Porphyromonas, Fusobacterium和Treponema 都与血浆IL-6呈显著正相关;
唾液中的Porphyromonas与血浆CRP呈显著正相关。随后进一步分析了免疫学参数和菌群之间的关系,重点是红色或蓝色高亮显示的微生物。白细胞计数和白细胞比值与口腔/肠道微生物群的丰度呈相似的相关性模式。有趣的是,每种样本类型中的Veillonella与至少一个白细胞计数/比值显著相关。
综上所述,这些结果显示口腔/肠道微生物群与血压/其他临床参数密切相关,提示微生物群会直接影响血压或通过调节与血压相关的临床参数间接影响血压。
④HTN中微生物群的口腔-肠道微生物群之间的通信
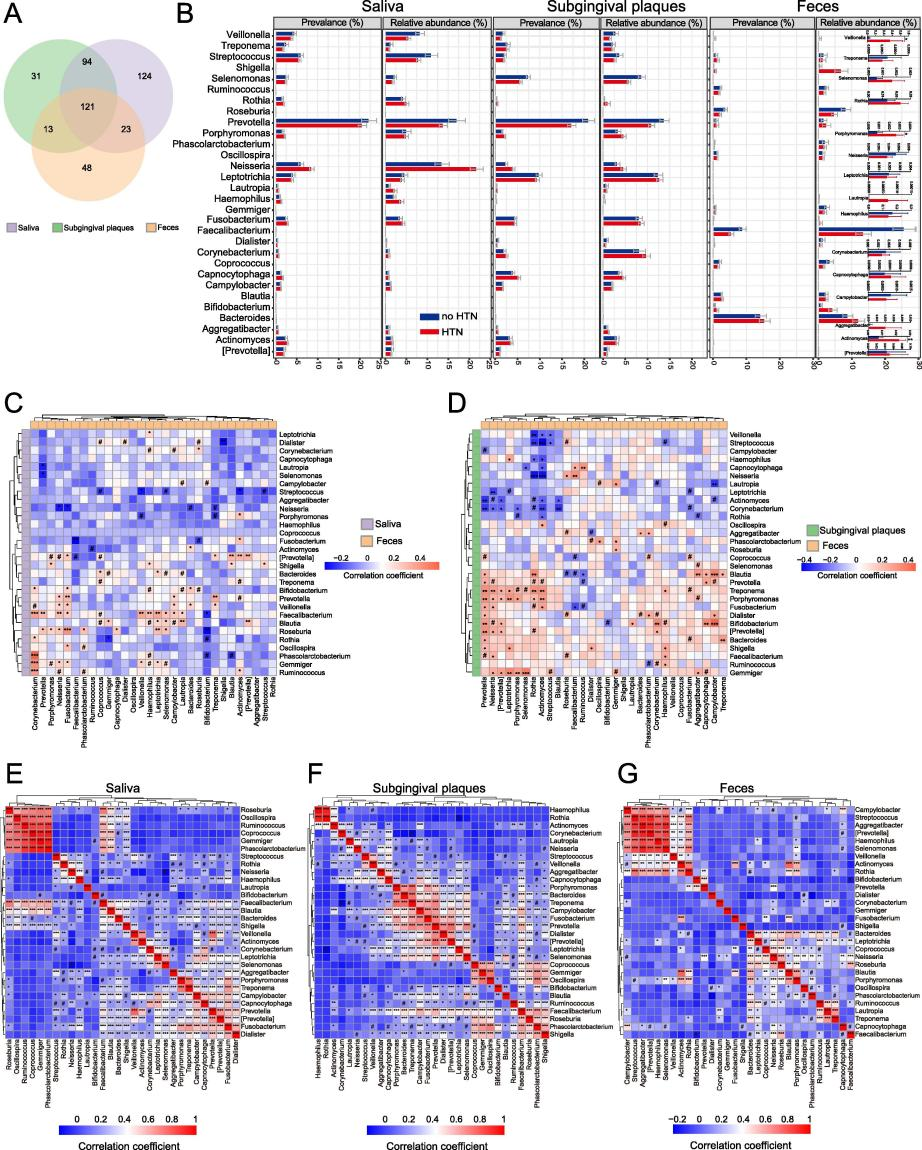
已有研究表明口腔-肠道微生物传播在不同疾病中的重要性,接下来,本文进行研究HTN患者中口腔和肠道微生物群之间的潜在通信。首先,通过韦恩图寻找唾液、龈下菌斑和粪便样本中共有及独有的菌群,发现口腔中的一些常见物种会在肠道中出现,且在HTN患者的肠道中比no-HTN参与者的肠道中更普遍或更丰富。最明显的变化是HTN患者肠道中Veillonella的相对丰度急剧增加。然后,本文在共有菌群中主要针对丰度top30的属水平物种进行相关性分析,并特别关注了Veillonella。结果发现,Veillonella潜在的异位定植更可能涉及唾液中的菌属,而不是龈下菌斑中的菌属。同时,Streptococcus和 Veillonella之间在每个样本类型(唾液、龈下菌斑和粪便)中的相关性都是显著正相关。
以往的报道认为Streptococcus和 Veillonella是胃肠道的常见定植者,而Streptococcus能够通过产生乳酸来促进Veillonella的生长。唾液Streptococcus和 Veillonella在肠道中异位定植可能影响血压。因此,以上这些数据表明,在HTN患者中,口腔和肠道微生物群之间存在潜在的通信。
⑤HTN中微生物群的口腔-肠道传播及因果关系
为了进一步研究口腔和肠道微生物群之间的通信,本文对24名no-HTN参与者和36名HTN患者的口腔和肠道样本进行了宏基因组测序。结果发现,PD相关物种在HTN患者的龈下菌斑中显著富集;LEfSe还揭示了HTN组和no-HTN组之间的差异富集的微生物功能模块等。另外,以前的报告表明,在菌株水平上追踪微生物群落,而不是在物种水平上,对于建立和定量微生物群传播更可靠,因此,本文接下来分析了宏基因组测序数据中的SNVs。其结果表明,16种口腔-肠道传播菌种,特别是Veillonella可能在HTN中发挥重要作用。
不过,口腔和肠道微生物群会随时间波动。因此本文对 52 名 HTN 患者和26名对照人群进行了一项后续研究,以讨论HTN 中微生物群的改变和口腔-肠道传播是否持续的问题。alpha多样性和PCoA分析的结果表明,肠道微生物群的波动小于口腔微生物群。溯源分析显示,HTN患者的口腔-肠道通信有所增加,表现为肠道微生物群中唾液来源微生物的比例显著增加。另外,top50优势物种的热图分析表明,各样本类型的前50属水平物种组成与6个月前人群的物种组成相似,但no-HTN组和HTN组存在显著差异的属发生了变化;在16种口腔-肠道传播种所属的5个属中,HTN患者的肠道菌群中Veillonella的相对丰度显著增加,与6个月前人群的结果一致。这些数据共同揭示了在HTN中,口腔-肠道传播和口腔微生物群的异位定植的稳定性。
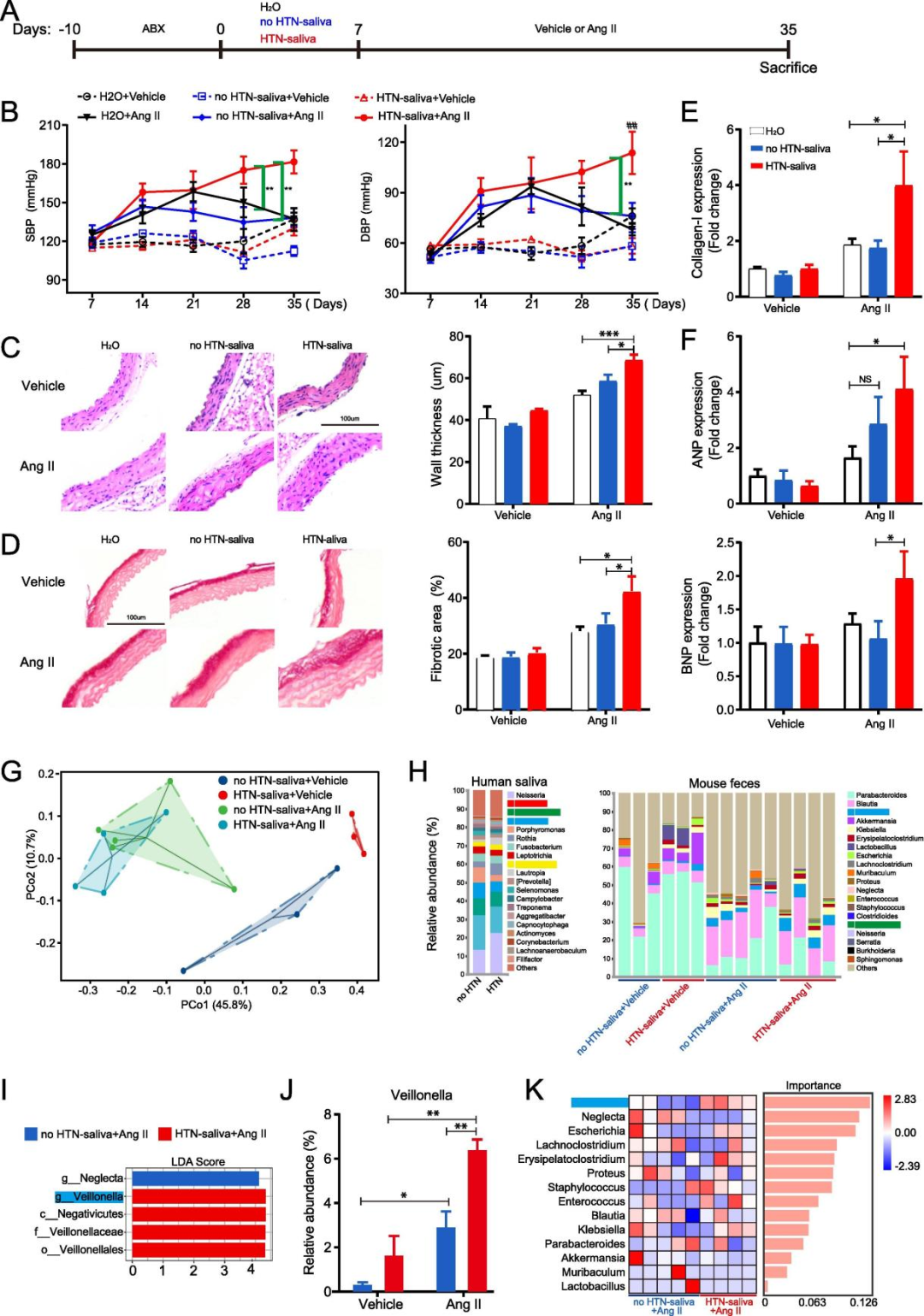
最后,为了研究口腔-肠道递质和HTN之间的潜在因果关系,本文在注入载体的 ABX 预处理受体小鼠中进行了唾液微生物群移植实验。其结果表明,HTN-唾液在小鼠肠道中的异位定植加剧了血管紧张素II诱导的HTN。另外,为了验证在临床研究中发现的口腔-肠道递质的重要性,本文对人唾液和接受了人唾液的小鼠粪便进行了16SrRNA基因测序。其PCoA分析结果表明,未注射HTN-唾液和接受HTN唾液的小鼠之间的肠道微生物群落组成完全分离,但在注射AngII后更相似。同时,在所有经过唾液处理的小鼠中,只有Veillonella成功地在小鼠的肠道中出现,重要的是,接受HTN-唾液和注入AngII的小鼠的Veillonella更丰富,肠道微生物群更丰富。此外,根据对接受人唾液和注入AngII的小鼠肠道菌群的随机森林回归分析,Veillonella的重要性排名最高。
综上所述,这些动物实验的结果与临床研究的结果基本一致。移植了HTN-唾液的小鼠的血压显著升高。小鼠肠道中唾液来源的Veillonella含量较高,这可能是口腔-肠道微生物传播和HTN之间的因果关系。
总结
本研究加强了PD与HTN之间的关联,建立了口腔和肠道微生物群之间、口腔/肠道微生物群与HTN/HTN相关临床参数之间的强相关性,以及确定了HTN相关的口腔-肠道传播微生物。这些数据全面证明了PD和口腔微生物群在HTN中的作用,特别是揭示了Veillonella等微生物在口腔-肠道传播的重要性。而且,这些发现支持了PD和HTN的关联性,而肠道中口腔来源的微生物的鉴定可能为HTN的预防、诊断和治疗提供新的策略。
文章索引:
Chen B Y, Lin W Z, Li Y L, et al. Roles of oral microbiota and oral-gut microbial transmission in hypertension[J]. Journal of Advanced Research, 2022.
以上研究的测序和部分数据分析工作由上海派森诺生物科技有限公司完成。如需进一步讨论,欢迎讨论区留言或者发邮件给我们哟(邮箱地址:metasupport@personalbio.cn)!