2022-08-16

影响因子:5.058
派森诺与沈阳医学院携手合作,在国际著名杂志《Frontiers in Medicine》发表了EPN3抑制乙肝病毒复制的调控机制。
技术路线
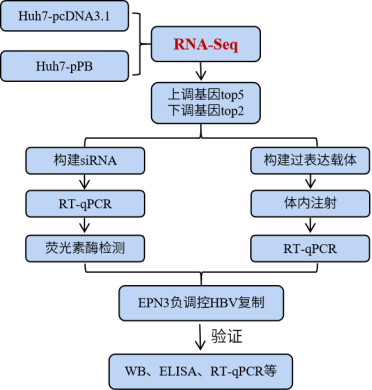
研究背景
乙肝是病毒性肝炎主要类型之一,具有传染性,在全世界范围内都有病例,病毒性肝炎不断加重会导致肝硬化,并逐渐发展为肝癌。目前绝大多数慢性乙肝需要抗病毒治疗,只能控制病毒复制,达到临床治愈,但是并不能彻底治愈,因此本研究从转录组角度对EPN3抑制乙肝病毒复制的作用机制进行了探讨。
研究材料与方法
Huh7 和 HepG2细胞
2.测序平台
Illumina Hiseq 2500
3.分析方法
转录组测序,荧光素酶检测,qPCR,WB,ELISA等。
研究结果
将空质粒和HBV pPB分别导入到Huh7细胞,通过RNA-seq分析发现了13个上调基因和29个下调基因,进一步针对上调基因TOP 5(EPN3、SEMA5B、UBD、KLRF1、TAS2R38)和下调基因TOP 2(SLC25A22、LPA)构建siRNA载体,与pPB一起导入Huh7细胞。结果显示,siEPN3转染组的HBV RNA表达水平显著高于siRNA阴性对照(siNC)转染组(图2A)而其他siRNAs并不影响病毒RNA复制。研究又经过一系列实验(图2B-J,图3),结果都表明EPN3对HBV RNA具有负调控作用。
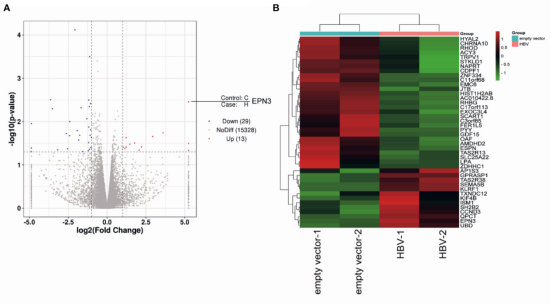
图1差异表达基因火山图(A)和热图(B)
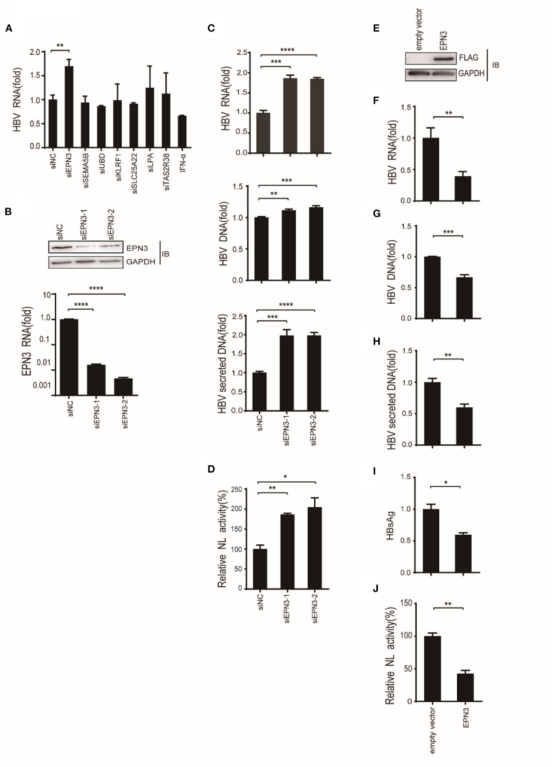
图2 EPN3负调控HBV RNA表达
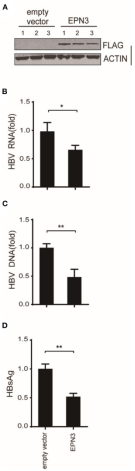
图3 小鼠乙肝模型体内注射实验
2.EPN3以转录偶联方式抑制HBV RNA
本研究为了进一步阐明EPN3负调控HBV RNA表达的分子机制,用转录抑制剂ActD处理空载体和EPN3转染的Huh7细胞,结果发现ActD减少了空载体中的病毒RNA,但没有减少pEPN3转染体中的病毒RNA(图4)。研究推测EPN3抑制病毒RNA,依赖于转录过程。然后进一步验证了EPN3介导的HBV RNA还原所必需的epsilon茎环结构,构建突变型pCMV1.2xHBVNL载体,其5’和3’epsilon结构缺失,当pCMV1.2xHBVNL载体与AID载体共转染Huh7细胞时,缺乏茎环结构的转染体NL活性降低(图5)。这些结果表明其EPN3抗病毒机制与AID截然不同。
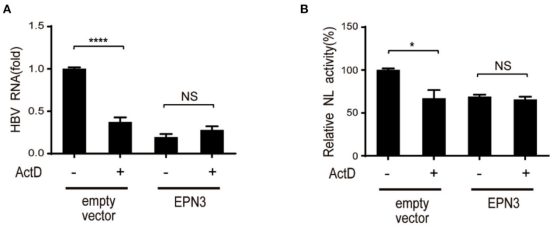
图4 EPN3负调控HBV依赖于转录
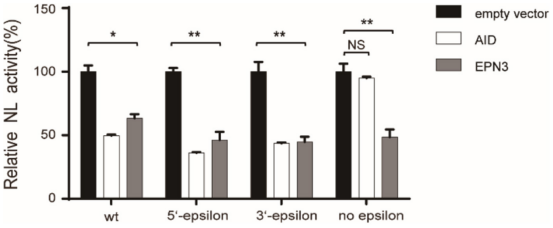
图5 EPN3不需要epsilon结构来抑制HBV
3.EPN3抑制P53和IFN-α下游的乙肝病毒复制
有研究表明p53能促进EPN3表达,所以本研究推测EPN3是p53介导抗HBV下游的效应因子。实验构建GFP-P53过表达载体,转染后发现EPN3表达增加,而HBV相对减少(图6A)。此外,当GFP-p53和siEPN3共转染时,GFP-p53对HBV RNA还原作用被siEPN3减弱(图6B),这表明EPN3介导了P53抗HBV活性。前人研究表明IFN-α可抑制乙肝病毒的复制,研究又进一步验证了该结果,siEPN3抑制了IFN-α对HBV RNA的还原(图6C,D)。综上所述,这些结果都表明EPN3负调控IFN-α/P53途径下游的HBV RNA复制。
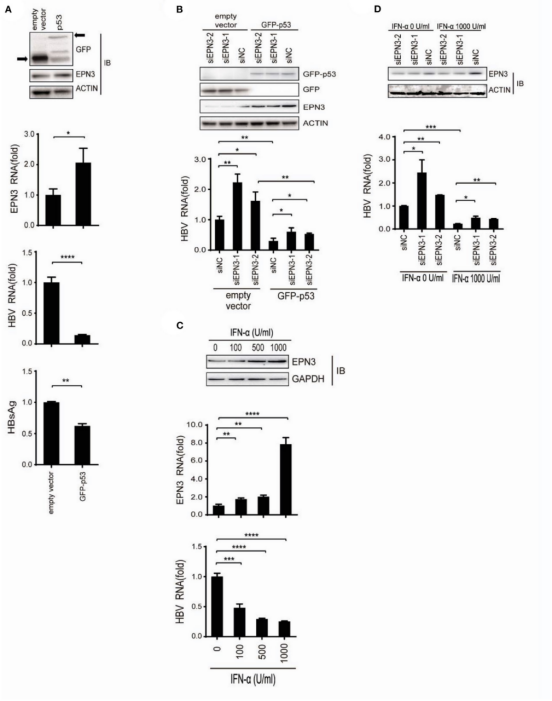
图6 EPN3抑制IFN-α/p53下游的乙肝病毒复制
讨 论
EPN3的抗病毒活性不需要epsilon结构,这表明它与AID作用机制是不同的。EPN3负调控HBV RNA的确切分子机制有待确定,其是否影响病毒启动子活性或病毒RNA稳定性也是未知的。其次,HBV感染对EPN3蛋白的上调也有待验证。综上所述,本研究发现了一种新的宿主因子EPN3,它负调控IFN-α/p53途径下游HBV RNA表达,但是需要进一步的研究来阐明IFN-α的详细分子机制,为治疗HBV提供一种更有效、副作用更小的方案。
本研究的测序和数据分析工作由上海派森诺生物科技有限公司完成。
原文索引:https://www.frontiersin.org/articles/10.3389/fmed.2022.944489/full


