2022-10-18

《Emerging Microbes & Infections》 影响因子:19.568
中国医科大学附属第一医院在国际著名杂志《Emerging Microbes & Infections》发表了MYOC在新生隐球菌侵入大脑时的作用机制。
技术路线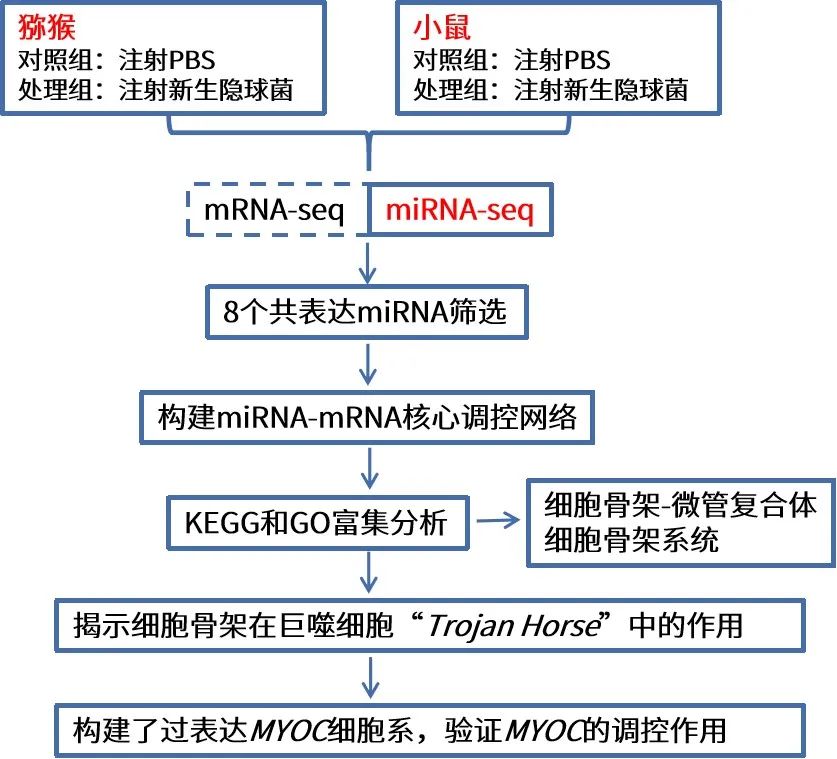
研究背景 侵袭性真菌病每年导致100多万人死亡,主要由白色念珠菌、烟曲霉菌和新生隐球菌引起。其中隐球菌性脑膜脑炎(CM)如果不治疗,死亡率为100%,真菌的CNS播散在感染过程中是致命,但目前尚缺乏体内或临床研究阐明隐球菌的CNS播散机制。前人研究表明,新生隐球菌的感染扰乱了小鼠的细胞骨架通路,但是目前还没有证据表明细胞骨架与隐球菌播散性脑炎之间的机制。鉴定细胞骨架与真菌感染之间的关系可能会发现真菌发病的新机制,并为开发真菌病治疗药物提供靶点。
研究材料与方法 六只雌性猕猴和小鼠(对照组:PBS,处理组:新生隐球菌) 2、测序平台 Illumina NextSeq 500 3、分析方法 miRNA和mRNA测序,RT-qPCR,WB,FCM,CFU测定等 研究结果
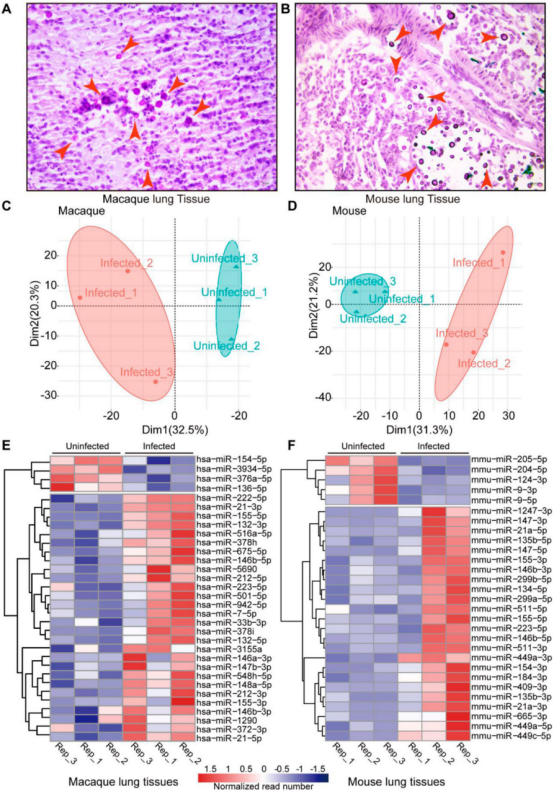
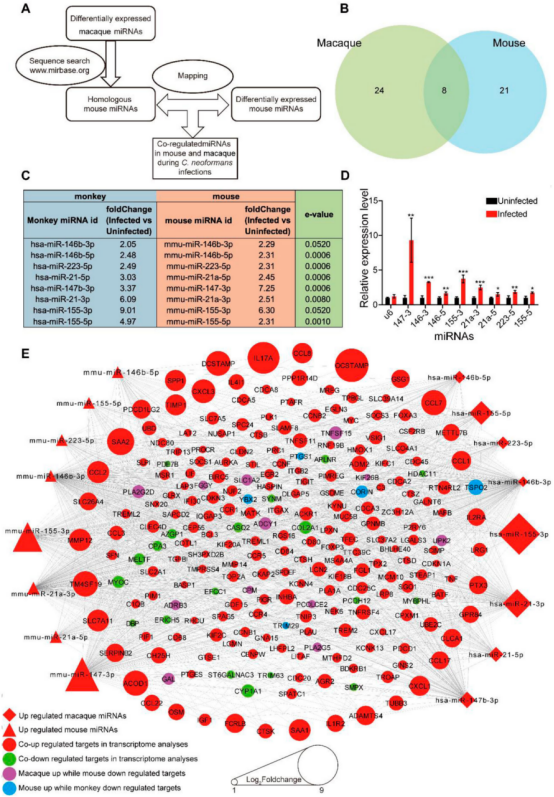
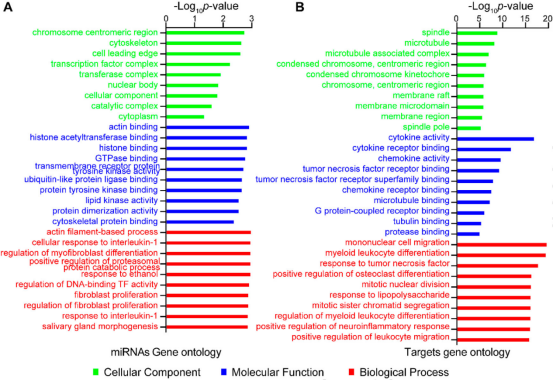
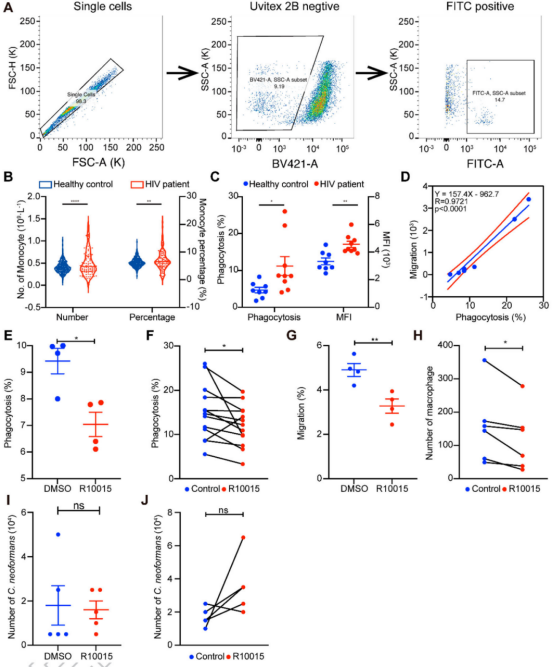
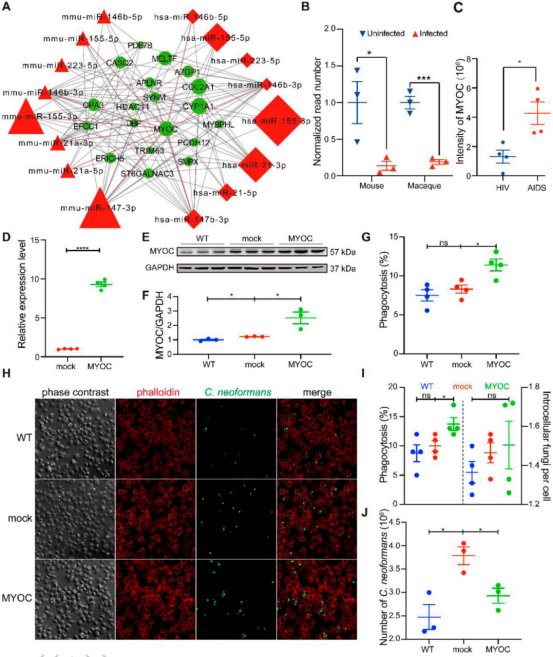
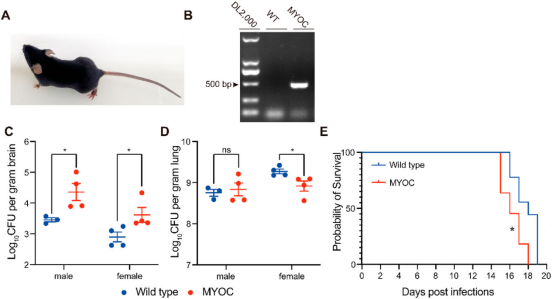
本研究对猕猴和小鼠感染模型分离的肺组织进行了miRNA转录组分析(图1)。病理观察到了猕猴和小鼠肺组织中新生隐球菌的荚膜结构(图2A、B)。提取猕猴和小鼠肺组织的总RNA做miRNA测序,分别鉴定出1038和1166个miRNA。对miRNA进行PCA分析(图2C、D)。然后利用DESeq软件分析差异miRNA,并对差异miRNA绘制热图,其中猕猴中有32个差异miRNA(4个下调和28个上调),小鼠中有29个差异miRNA (5个下调和24个上调)(图2E、F)。 图1动物感染和RNA测序流程图 图2猕猴和小鼠miRNA测序分析 2.miRNA-mRNA联合分析获得宿主的核心反应 为了模拟人类感染隐球菌的反应,进行了同源分析(图3A),在感染新生隐球菌的猕猴和小鼠中找到了8个共调节的miRNAs。随后对这个8个miRNAs进行了RT-qPCR验证,结果与miRNA测序结果一致(图3B,C,D)。 随后对这8个miRNA预测了靶基因,并构建了miRNA-mRNA网络,该网络共有223个靶基因(图3E),对其进行了KEGG和GO分析(图4)。与免疫系统、肺部疾病和传染病有关的KEGG通路都显著富集,GO分析发现,涉及细胞因子活性、组蛋白、免疫细胞、单核细胞、骨髓白细胞和细胞周期的GO term都显著富集(图4)。此外,另一显著富集的是肌动蛋白结合和微管及其相关复合体,它们构成了细胞骨架系统,表明细胞骨架在隐球菌感染中具有潜在功能。 图3 miRNA-mRNA核心调控网络 图4 共调节miRNAs-mRNAs GO分析 3.巨噬细胞 "Trojan Horse "在HIV/AIDS患者中的作用增强,并可被细胞骨架途径抑制剂所抑制 免疫细胞骨架功能障碍是HIV/AIDS患者的主要病理特征之一,而HIV/AIDS是CM的主要人群。对100例HIV/AIDS患者和200例健康者进行了PSM比较,发现HIV/AIDS患者的单核细胞数量和百分比显著增加(图5B)。为了揭示宿主细胞骨架功能,比较了9名HIV/AIDS患者和8名健康者的MDM吞噬和迁移(图5A)。结果表明HIV/AIDS患者的吞噬能力增强(图5C),迁移没有变化,但MDM迁移与吞噬能力呈正相关(图5D)。 为了证实HIV/AIDS患者中新生隐球菌感染与细胞骨架的作用关系,使用了细胞骨架途径抑制剂R10015,将TDM和MDM用R10015预处理2小时,洗净后与新生隐球菌孵育过夜。发现R10015抑制THP-1细胞系(TDMs)和单核-巨噬细胞(MDMs)的吞噬能力和迁移(图5E、F和G、H)。然而,R10015不影响TDMs和MDMs的杀伤能力(图5I、J)。这些结果证实了细胞骨架在巨噬细胞“Trojan Horse”中的重要作用。 图5 HIV/AIDS患者的巨噬细胞“Trojan Horse”增强 4.MYOC通过调节巨噬细胞“Trojan Horse”抑制新生隐球菌中枢播散 为了确定新生隐球菌感染期间细胞骨架的功能,选择了与细胞骨架相关的基因肌纤蛋白。肌纤蛋白是由MYOC编码的,它是miRNA-mRNA调控网络的核心之一,在猕猴和小鼠的新生隐球菌感染期间显著下调(图6A、B)。此外,MYOC的表达在HIV/AIDS患者中也有所上升(图6C)。 为了探索MYOC的功能,构建了过表达MYOC细胞系,并通过RT-qPCR和WB对其进行定量分析,与mock细胞相比,MYOC在mRNA和蛋白水平上分别有10倍和2倍的增长(图6D、E、F)。随后检测了MYOC细胞系的吞噬、迁移和杀伤能力(图6G、H、I、J)。通过流式细胞术或共聚焦扫描检测发现,MYOC过表达时TDM中的吞噬效率显著增加(图6G、H、I)。通过CFU检测到的活菌更少,表明MYOC过表达也增强了杀伤能力(图6J)。 为了评估MYOC在体内的功能,作者制备了MYOC转基因小鼠(图7A),并利用PCR验证(图7B)。与野生型小鼠相比,MYOC转基因小鼠的脑内CFU均增加(图7C)。雌性小鼠肺中的CFUs减少,而雄性组无变化(图7D)。同样观察到的是,在生存试验中,MYOC转基因小鼠的生存时间比野生型小鼠短(图7E)。 图6 MYOC增强新生隐球菌介导的巨噬细胞“Trojan Horse” 图7 在MYOC转基因小鼠中MYOC增强了新生隐球菌感染中枢的过程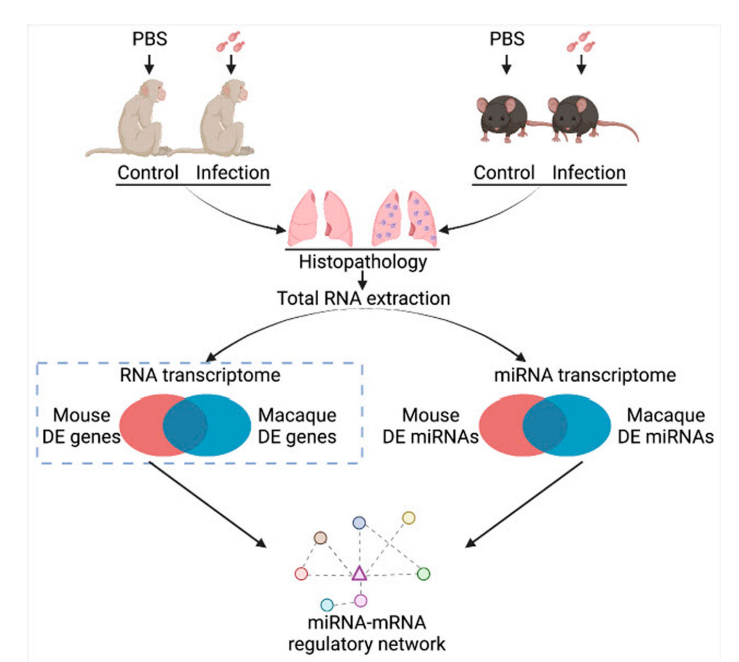
小 结
本研究使用猕猴模型来模拟人类的反应,并通过构建miRNA-mRNA调控网络发现细胞骨架通路是新生隐球菌在猕猴和小鼠模型中调控感染的核心通路。此外,临床免疫细胞检测证实了HIV/AIDS患者的巨噬细胞“Trojan Horse”的增强,而细胞骨架通路的干预则破坏了“Trojan Horse”。细胞骨架相关基因MYOC被证实是“Trojan Horse”的重要靶点。综上,这些发现揭示了真菌侵袭中枢神经系统的新调控因子,并可能有助于开发新的抗真菌治疗方法。


