2022-10-25

《Nano Research》
影响因子:10.269
近期,安徽医科大学第一附属医院于国际著名期刊《Nano Research》上发表了MRSA感染治疗的新进展,运用转录组学技术手段揭示了细菌感染治疗的抗菌机制。
研究背景
耐甲氧西林金黄色葡萄球菌(MRSA)感染因可引起软组织感染、肺部感染、骨关节感染等严重全身性疾病而受到全世界的关注。在美国,耐甲氧西林金黄色葡萄球菌占金黄色葡萄球菌的53%。由于抗生素的过度使用和滥用,其发生率在逐年增加,特别是一些亚洲国家的MRSA检出率最高。 上转换纳米粒子(UCNPs)由于其独特的能力,在激发较长波长的同时产生较短波长的发射,引起了广泛关注。AgBiS2纳米材料具有较高的光吸收系数、散热率和光热转换效率,是理想的光热转换剂的候选材料。故我们据此合成的UCNPs@AgBiS2具有改进ROS产生和光热转换能力,能有效杀死MRSA,是一种良好的对抗耐药细菌的替代策略。
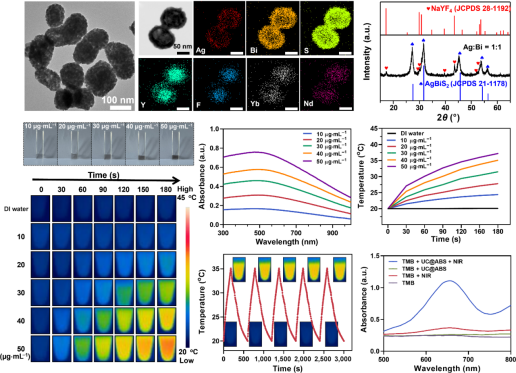
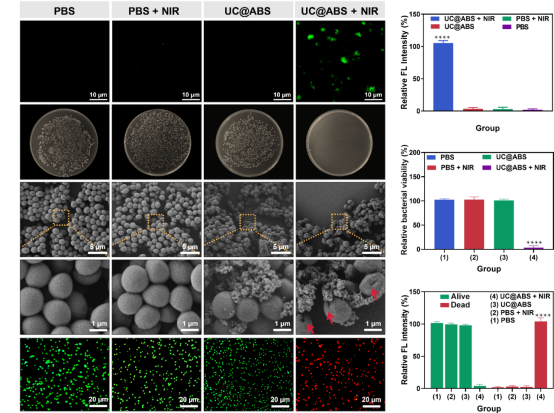
技术路线 UCNPs@ABS治疗细菌感染示意图 研究内容 1.UCNPs@ABS的合成与功能评价 UCNPs@ABS的合成工艺及表征 为了探究UCNPs@ABS的合成与其功能进行评估,我们做了扫描透射电子显微镜、UCNPs@ABS的XRD图谱以及不同浓度下的吸收光谱等。将UCNPs@ABS整合到一个系统中,是开发PTT/PDT协同治疗的优质光热剂的一种很有前途的方法。该系统能够增强UCNPs向AgBiS2传递荧光共振能量转移(FRET)效应所诱导的ROS生成能力。 UCNPs@ABS在808 nm激光的刺激下通过PDT产生了一定量的ROS,这可能有助于UCNPs和AgBiS2之间的有效能量传输。AgBiS2可被FRET触发,随后与环境中的H2O和O2反应生成·OH和O2。据推测,通过PTT和PDT组合,UCNPs@ABS在O2和·OH清除细菌细胞时表现出了优异的ROS生成性能。这些结果表明,UCNPs@ABS是一种优良的光热试剂,具有优异的稳定性和在近红外激光照射下产生ROS的能力。 2. UCNPs@ABS对MRSA的体外抗菌活性 UCNPs@ABS对MRSA的体外抗菌活性 根据上述结果,制备的UCNPs@ABS具有优异的光热效应和光动力。因此,我们推测,UCNPs@ABS有很大的潜力用于细菌感染的治疗。总的来说,我们建立了一系列的对比试验,以确定最合适的条件使用UCNPs@ABS,并做了一系列体外抗菌能力验证实验。 结果显示,三个对照组的活菌都处于典型的生存状态,但治疗组UCNPs@ABS的照射诱导的红色荧光信号比PBS组高97.6%。结果表明,几乎所有的细菌细胞都被杀死了,证实了之前的猜想,UCNPs@ABS在激光照射下依靠PTT和PDT产生ROS来达到杀死MRSA的效果。 3. UCNPs@ABS对MRSA的体内抗菌活性 UCNPs@ABS对MRSA的体内抗菌活性 为了进一步证实UCNPs@ABS的杀菌作用,我们在体外实验的基础上又在小鼠体内进行了抗菌活性实验。以直径约1.0 cm的人工创口为模型,研究6 ~ 8周龄麻醉雌性Balb/c小鼠背部形成的感染MRSA (108 CFU·mL−1)的UCNPs@ABS体外抑菌效果。 结果表明,UCNPs@ABS作为PDT和PTT治疗的联合体系在体内依然具有良好的抗菌性能。对其生物安全性和细胞毒性进行深入的研究发现,每组的体重都稳步增加,这说明UCNPs@ABS治疗对正常小鼠生长几乎没有明显的副作用,突出了它们在临床细菌应用方面的巨大潜力。 4.转录组分析 探讨UCNPs@ABS抗MRSA的作用机制 受UCNPs@ABS及其体内协同PTT和PDT治疗效果的鼓舞,我们做了RNA测序,以确定可能的分子生物学机制。对对照组和添加UCNPs@ABS + NIR (UN_S group)组进行转录组分析,一共检测到2613个基因,其中710个DEGs(FC > 2,FDR<0.05),518个上调基因,192个下调基因,并对结果进行火山图以及富集分析。 GO富集分析显示,富集到1542个条目,其中149个为显著富集条目。KEGG分析结果显示,共有112个基因与重要的细菌生命周期调控系统相关,如碳水化合物代谢、膜转运系统、耐药系统、转译和细胞过程等。具体来说,这些途径包括半乳糖代谢、核黄素代谢、ABC转运体等。与抗菌相关的代谢途径是半乳糖代谢、核黄素代谢等,它们在抗MRSA过程中发挥重要作用。因此,我们认为抑菌活性可能与温度升高和ROS的产生有关,从而直接、无差别地损伤细菌及其胞内物质和一些重要途径。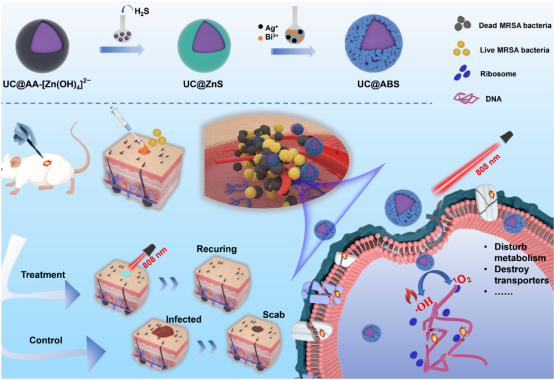
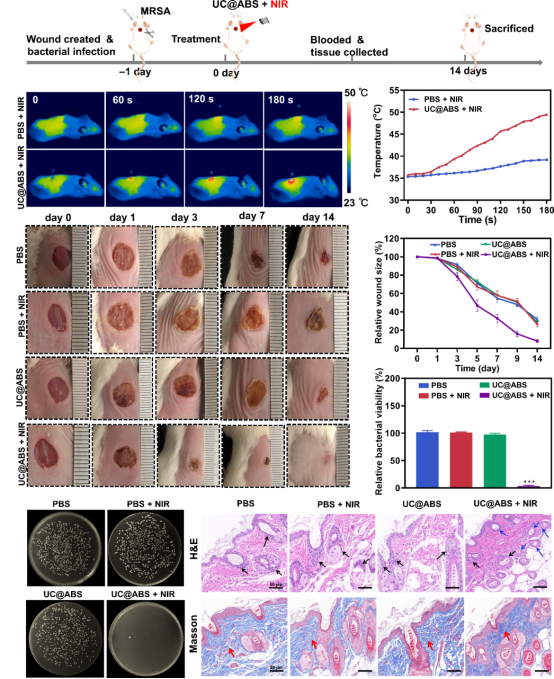
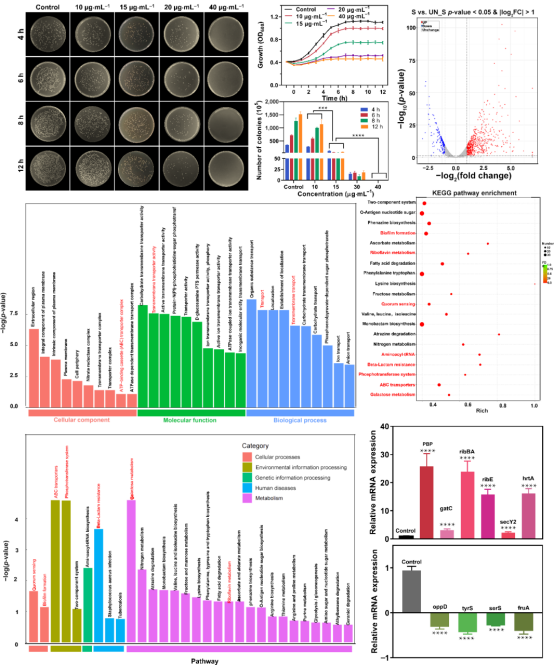
文章总结 我们通过简单的化学方法构建了UCNPs@ABS作为协同PDT/PTT的有效光热剂。由于其较强的近红外吸收能力,良好的光热效应,以及良好的体外和体内抗菌能力抑制MRSA感染。 机制研究表明,UCNPs@ABS能够杀死MRSA并提高感染创面愈合速度,是因为PDT和PTT调节pbp、oppD等相关基因家族的表达,破坏运输系统,增加MRSA细胞膜的通透性,使MRSA更容易通过干扰群体感应杀死和抑制生物膜。因此,UCNPs@ABS配合功能性抗菌治疗可以减少对抗生素的需求,防止超级细菌的出现,可能是临床治疗多药耐药细菌感染的优秀候选药物。
本研究的测序和部分数据分析工作由上海派森诺生物科技股份有限公司完成。


