
2023-02-21

《Pharmacological Research》
影响因子:10.334
文章题目:Functional metabolomics revealed the dual-activation of cAMP-AMP axis is a novel therapeutic target of pancreatic cancer 技术手段:RNA-seq,LC-MS/MS 上海交通大学近期在《Pharmacological Research》上发表了功能代谢组学揭示了cAMP-AMP轴的双重激活是胰腺癌新治疗靶点的研究成果。
研究背景 胰腺癌症(Pancreatic Cancer)是消化道常见恶性肿瘤之一,因其极高的侵袭性和死亡率而引起广泛关注,胰腺癌的临床治疗局限于隐匿的早期症状和复杂的发病机制,目前对其的治疗主要是通过手术切除和吉西他滨药物治疗。由于对胰腺癌的理解还存在不足,现有药物效率和新药物发现的较大挑战是缺乏有效的治疗靶点。 吉西他滨具有广谱抗肿瘤活性,在卵巢癌、乳腺癌、膀胱癌、宫颈癌及肾细胞癌的临床治疗中都具有一定疗效。目前急需从系统生物学驱动的功能代谢组学策略发现吉西他滨的新靶点,从而找到治疗胰腺癌的新药物,或者添加辅助药物实现老药新用。本研究将为胰腺癌药物分子的快速筛选评价提供全新靶点。此外,通过制剂优化等手段增强吉西他滨对新靶点的靶向性,将有助于改善其治疗胰腺癌的有效性。
技术路线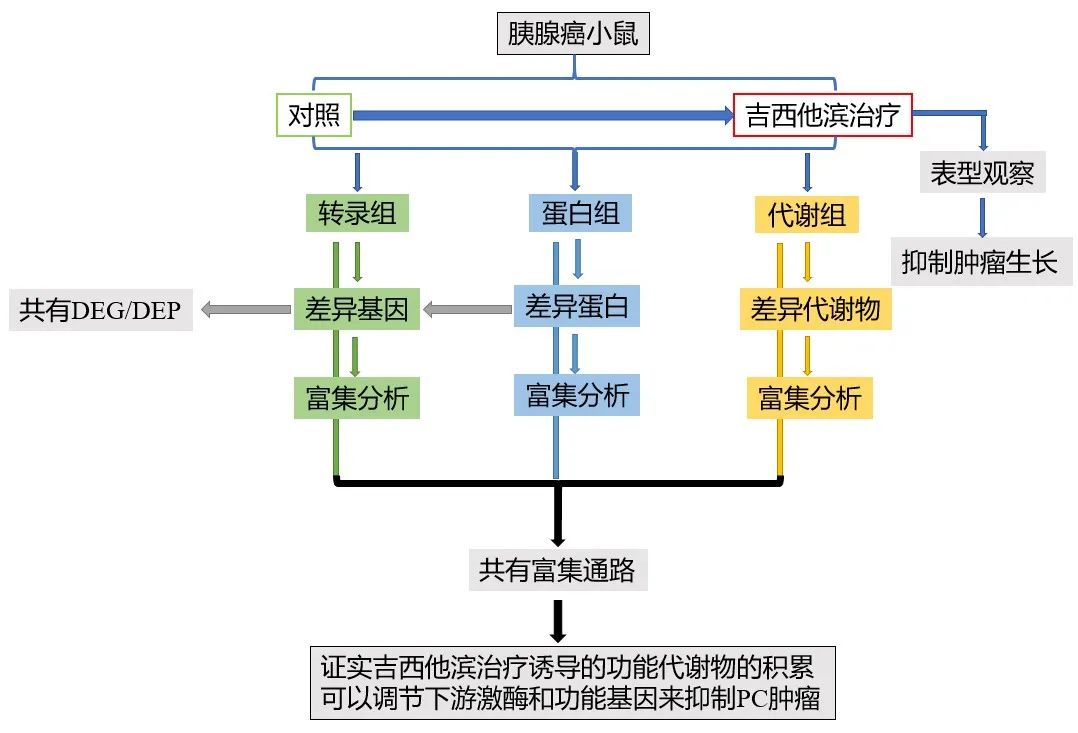
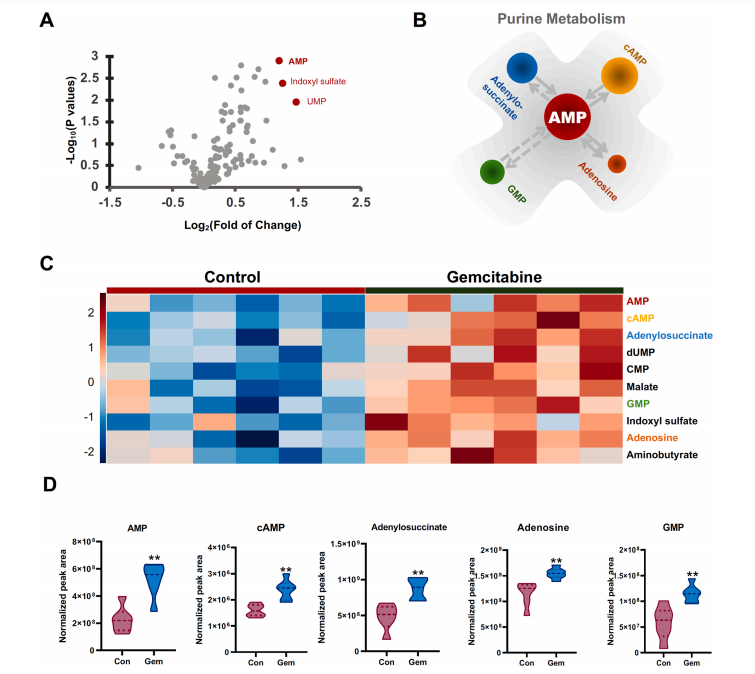
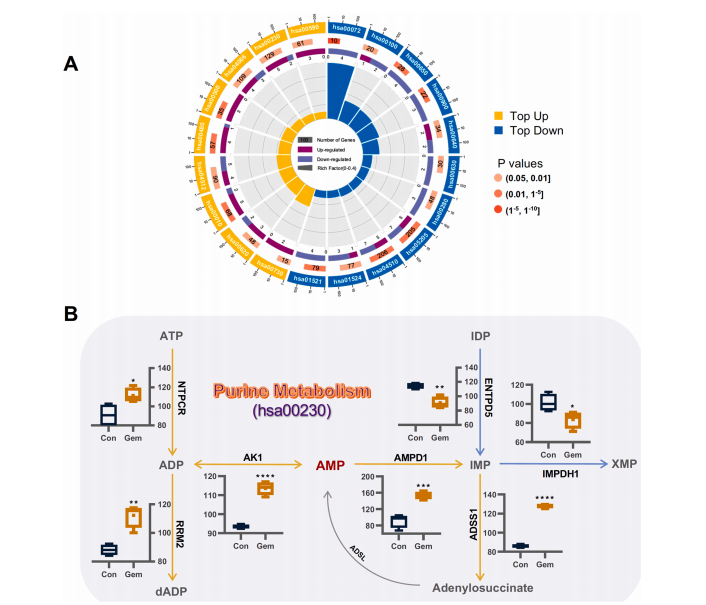
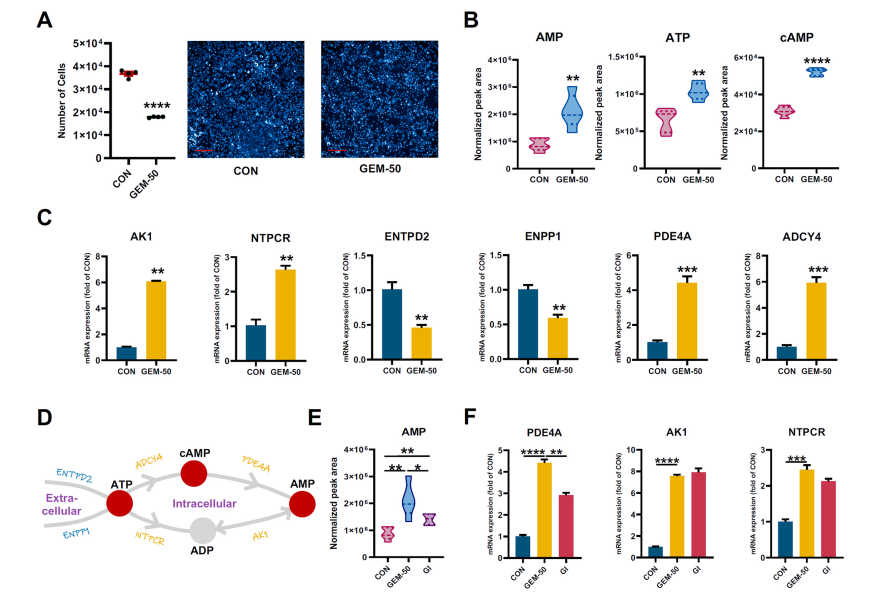
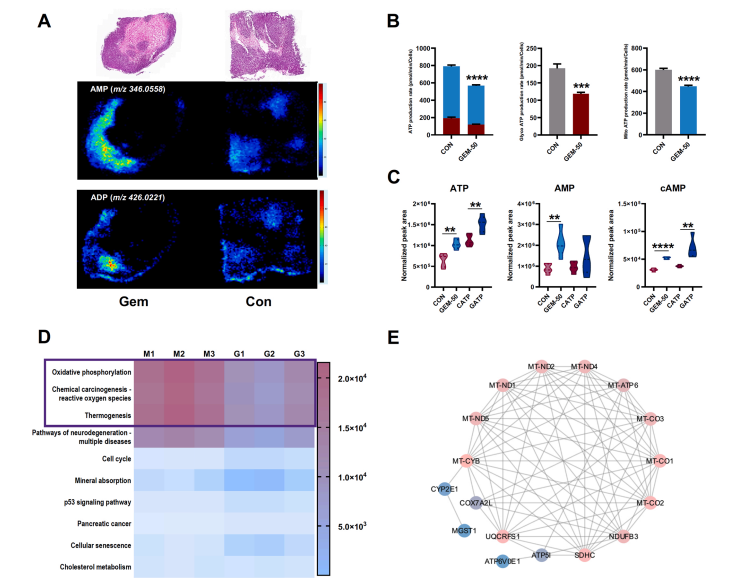
研究结果 AMP是一种新型功能性代谢物,促进吉西他滨对PC肿瘤的抑制作用 吉西他滨治疗组皮下肿瘤的重量和体积均明显减少(图1B、1C),还验证了Ki67的标记程度(图1D),ki67主要用于标记增殖周期中的细胞,该标记率高这主要是由肿瘤生长越快,组织分化能力越差,而对ki67也越敏感,因此证实了吉西他滨抑制肿瘤发生的能力。 将吉西他滨治疗前后肿瘤组织中代谢物进行比较,发现154种代谢物发生了变化,并通过火山图发现吉西他滨显著上调了AMP、硫酸吲哚酚和UMP的表达水平(图2A)。此外,通过热图识别治疗过程中肿瘤组织中变化最显著的差异代谢物,发现嘌呤代谢相关的AMP、cAMP、腺苷琥珀酸、腺苷和GMP明显增加(图2C、2D)。因此,将嘌呤代谢的核心分子AMP确定为功能性代谢物(图2B),吉西他滨可能将其作为抗PC肿瘤发生的靶点。 图1. 在裸鼠模型中证实吉西他滨对PC肿瘤的抑制作用 图2. 靶向代谢组学确定了对吉西他滨治疗有反应并受影响最大的功能代谢物 吉西他滨治疗PC肿瘤组织中AMP生物合成相关代谢酶明显上调 基于PC肿瘤组织差异蛋白的KEGG途径富集分析来解释吉西他滨的治疗作用。其中吉西他滨给药组嘌呤代谢(has00230)显著增加(图3A),许多与AMP生物合成和转化相关的酶表达水平显著上调(图3B),再次证实了AMP在促进吉西他滨对PC的治疗效率方面的关键作用。 图3. PC肿瘤组织的蛋白组分析揭示了AMP代谢酶的变化 吉西他滨治疗PC时,肿瘤组织中由ATP产生的AMP和cAMP显著累积 图4A所示,吉西他滨抑制细胞增殖,而图4B显示,细胞内AMP的变化与肿瘤组织代谢组学分析一致。接着确定AMP产生的主要前体,验证了AK1和NTPCR在Aspc-1细胞中的表达变化。吉西他滨可以通过NTPCR催化ATP生物合成ADP,然后AK1升高调节AMP与ADP之间的双向催化作用上调,ATP在PC细胞中略有积累(图4B、4C),进一步定量分析了参与同一生物合成途径的胞外酶的表达。 随着PDE4A受到抑制,AMP的水平明显下降(图4E),但吉西他滨对AK1和NTPCR的调控几乎不受IBMX的影响(图4F),说明cAMP仅促进部分AMP的生物合成,但不影响ATP通过ADP转化为AMP。由此可见,促进AMP积累的两条生物合成途径之间没有明显的依赖关系。 图4. 吉西他滨治疗诱导的Aspc-1细胞中功能代谢物和代谢酶的表达变化 质谱成像可视化了吉西他滨靶向的AMP和ADP在PC肿瘤组织中的空间分布 采用AFADESI-MSI技术,可视化功能性代谢物在PC肿瘤组织中的空间分布(图5A)。可以看到吉西他滨诱导的AMP过度积累在实体瘤的密集区域直观可见。质谱成像分析揭示了在与AMP重叠的区域观察到的ADP产量轻微上调。 图5. 质谱成像可视化PC肿瘤组织中AMP和ADP的相对强度 吉西他滨诱导AMP-cAMP轴双重激活,靶向GADD45A,调控下游激酶AMPK和PKA信号通路,抑制PC肿瘤 AMP可激活AMPK的磷酸化,诱导肿瘤细胞自噬,而cAMP可通过激活PKA调节多条信号通路(图6A、6B),诱导肿瘤细胞凋亡和抑制肿瘤启动。因此,吉西他滨诱导AMP-cAMP轴双重激活抑制PC肿瘤,主要是通过分别激活下游功能激酶AMPK和PKA诱导肿瘤细胞自噬和凋亡。通过吉西他滨治疗期间胰腺癌通路中差异基因的表达,上调了5个与胰腺癌相关的基因,并发现AMP和cAMP均与GADD45A的表达呈正相关(图6C、D),GADD45A与AMP和cAMP都有较强的相关性(图6E),因此,GADD45A可能是吉西他滨治疗由AMP-cAMP轴双重激活调节的PC的新靶点。 图6.吉西他滨诱导AMP-cAMP轴的双重激活,调节下游激酶和功能基因来抑制PC肿瘤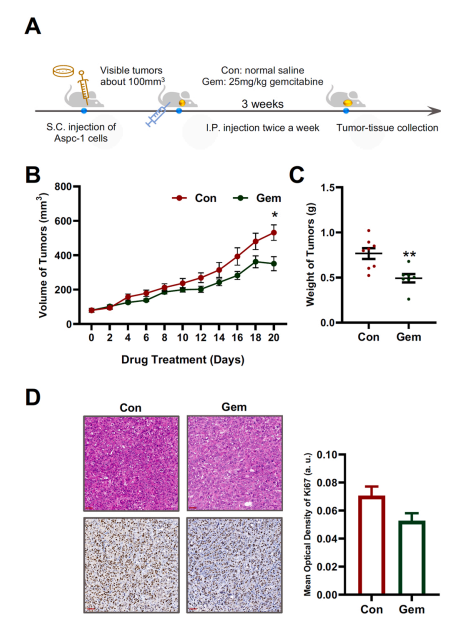
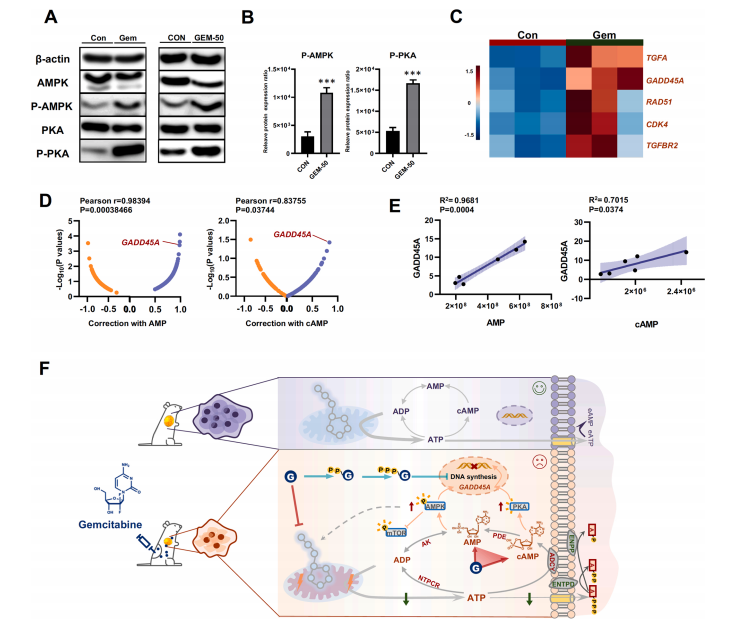
结 论 胰腺癌(PC)是恶性肿瘤之一,具有极高的侵袭性和死亡率,这种情况目前引起了广泛的耐药性和治疗缺陷。在本研究中,提出了一种新的功能代谢组学策略—时空操作真实代谢组学(STORM),以动态和可视化的模式识别决定性的功能代谢产物,其水平变化与吉西他滨对PC的治疗效果有关。结合体内功能代谢物的定量分析和空间可视化表征,发现AMP-cAMP轴是PC的一个新的治疗靶点。吉西他滨可诱导cAMP和AMP在肿瘤组织中的双重累积。相关生物合成酶和基因的定量分析表明,在较低水平的能量环境中,细胞内有两条独立的ATP生物合成途径促进AMP-cAMP轴的双重激活。然后,吉西他滨诱导AMP和cAMP的双重累积,可分别激活AMPK和PKA的信号通路,通过上调下游抑瘤因子GADD45A抑制肿瘤生长。综上所述,吉西他滨诱导AMP-cAMP轴的双重激活可以有效抑制PC肿瘤生长。
本研究中转录组测序及部分分析工作由上海派森诺生物科技股份有限公司完成。
参考文献:Jingjing Liu, Wanghui Jing, Tianyu Wang, Zhe Hu, Haitao Lu,Functional metabolomics revealed the dual-activation of cAMP-AMP axis is a novel therapeutic target of pancreatic cancer,Pharmacological Research,Volume 187,2023,106554,ISSN 1043-6618.