2023-04-04
近期,吉林农业大学李所课题组在《Environmental Pollution》和《Journal of Animal Science》上发表了高质量SMART-seq文章,小派今天就分享这两篇有关猪卵母细胞转录组测序的文章解读,文章的原文索引及链接见文章末尾。
文章一
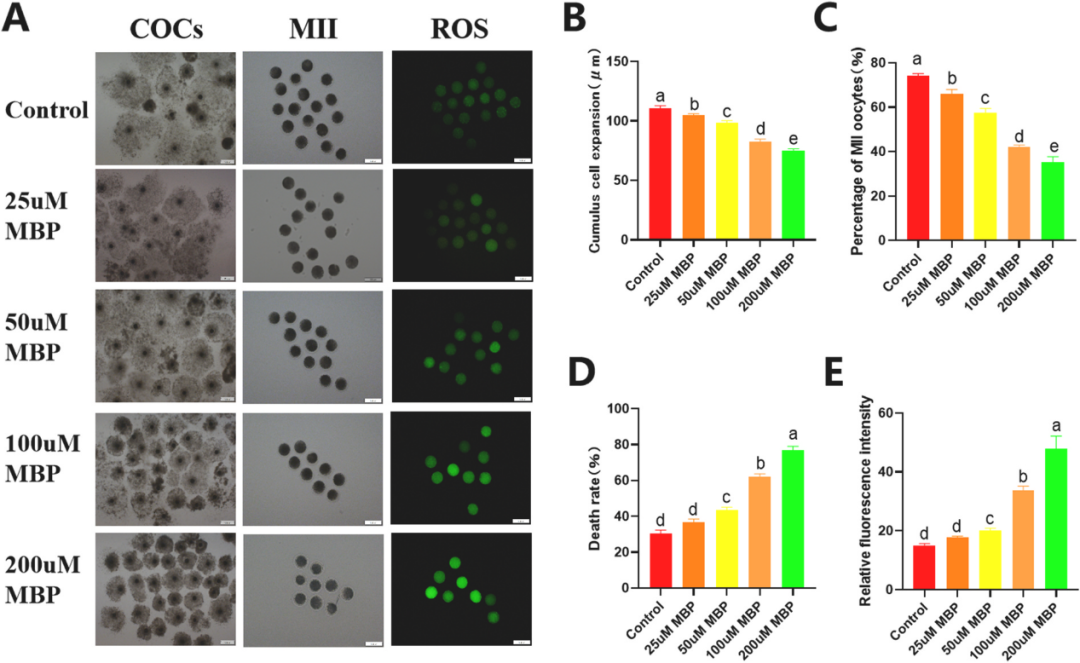
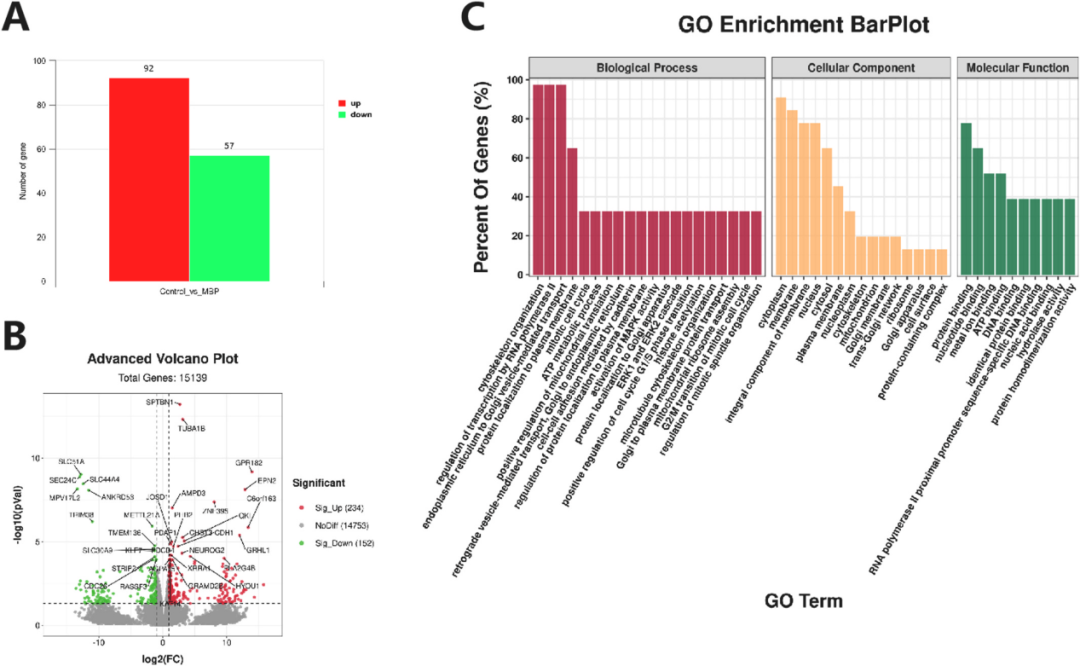
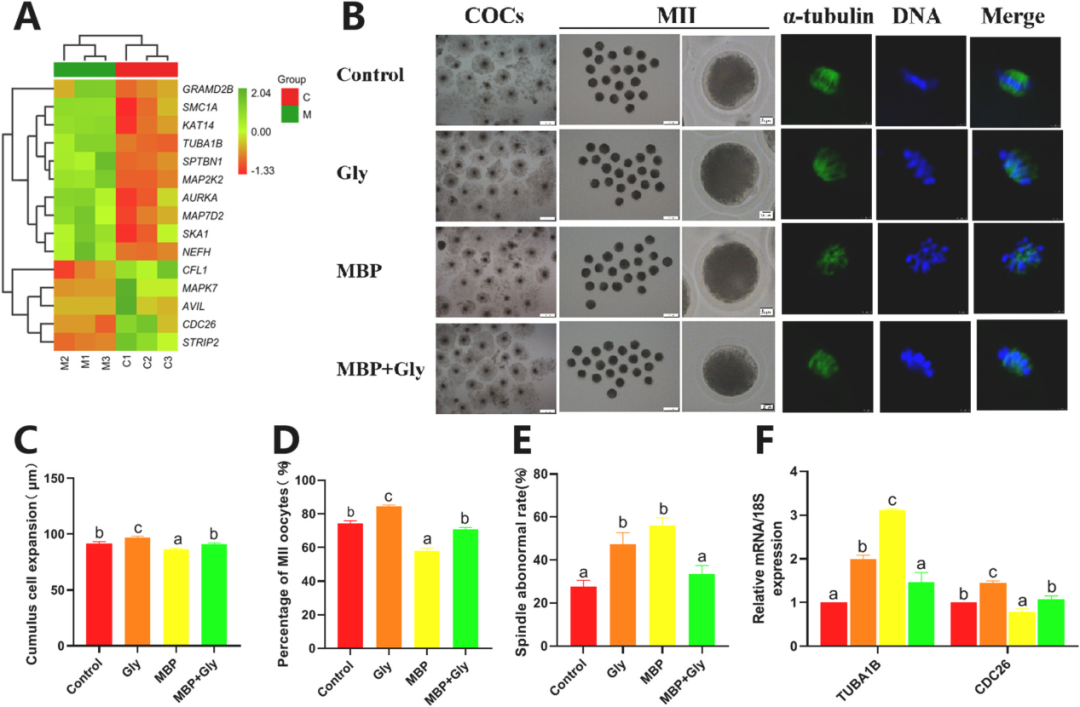
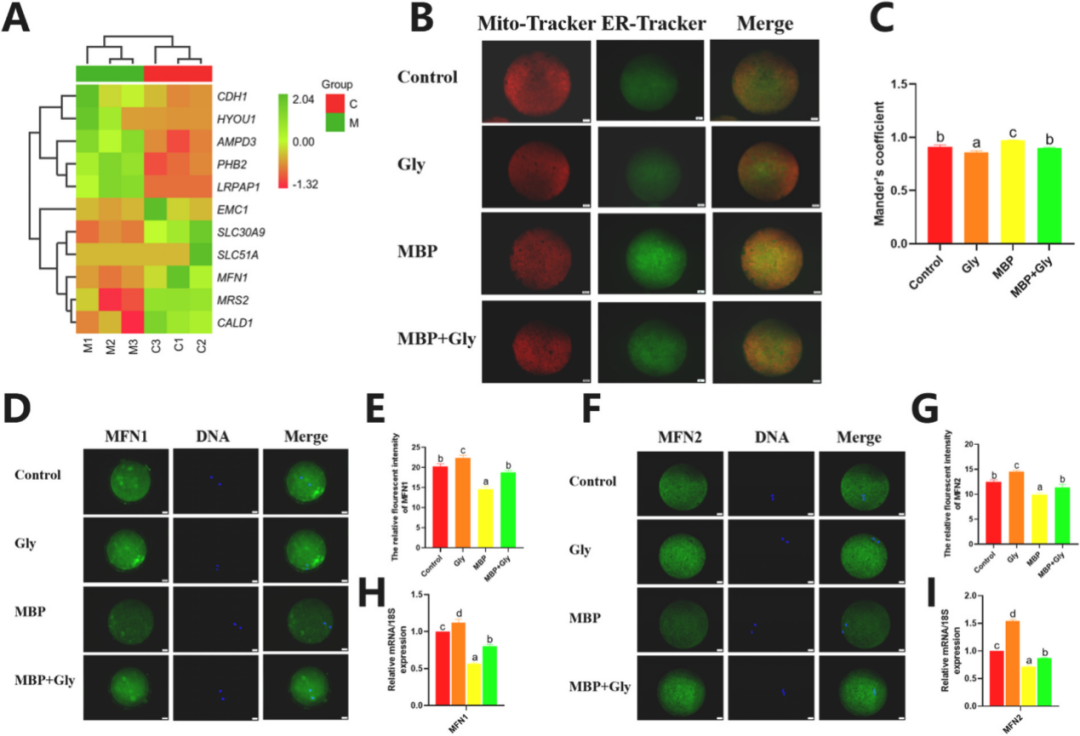
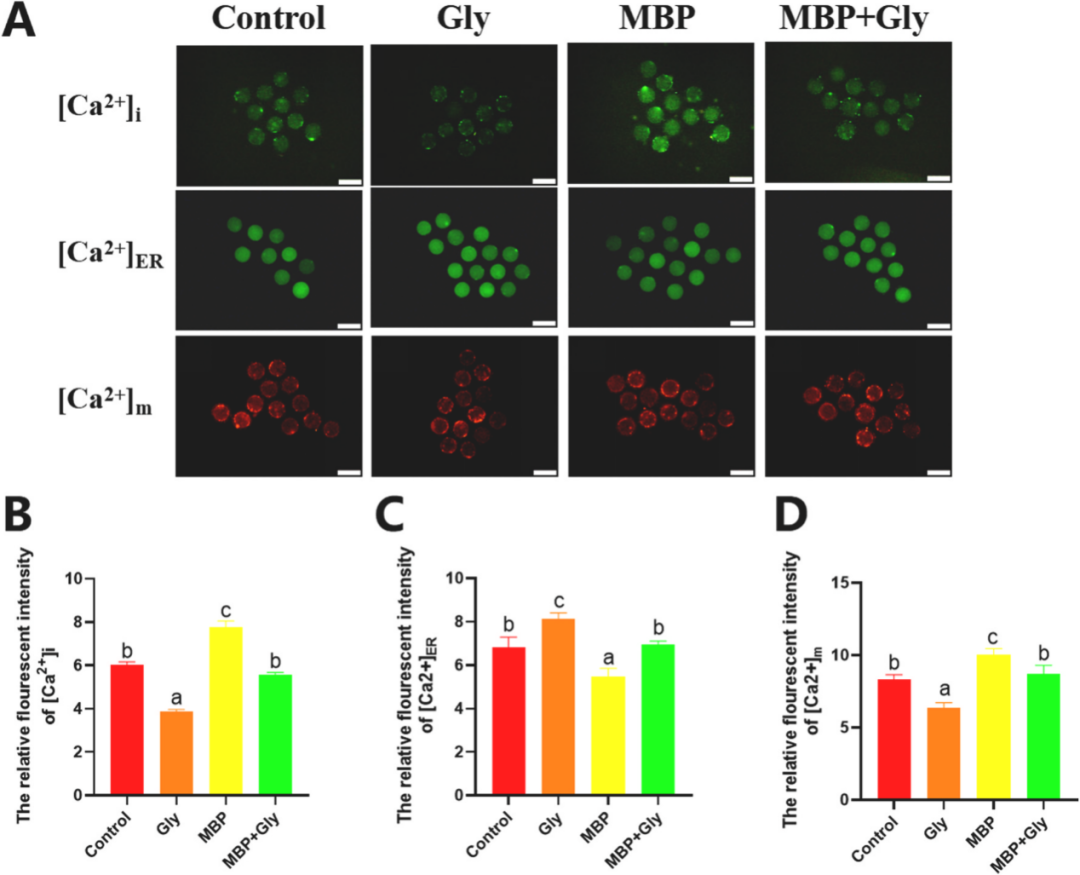
甘氨酸通过调节猪卵母细胞线粒体-内质网相互作用改善MBP诱导的减数分裂异常和凋亡 《Environmental Pollution》 影响因子:9.988 研究背景 邻苯二甲酸单丁酯(MBP)是邻苯二甲酸二丁酯(DBP)在体内的主要代谢产物。MBP具有稳定的结构,可以在生物体中持续积累,并有可能损害动物和人类的生殖功能。在卵巢卵泡微环境中,DBP及其代谢物MBP可能导致卵泡发育和类固醇生成的缺陷,减数分裂成熟异常,卵巢功能受损和其他生殖缺陷。以前的研究发现甘氨酸似乎能够保护卵母细胞免受MBP诱导的损伤。在本研究中,通过SMART-seq探究MBP暴露对猪卵母细胞体外成熟(IVM)的影响。阐明MBP对卵母细胞毒性作用的潜在机制,并探索甘氨酸改善MBP诱导的猪卵母细胞损伤的机制。 技术路线 研究内容 1、MBP对猪卵母细胞成熟和ROS水平的影响 首先,用不同MBP浓度(25 μm、50 μm、100 μm和200 μm)处理卵母细胞,评估MBP对卵母细胞减数分裂的影响。与对照组相比,MBP组中的卵丘细胞部分扩张或未扩张。对照组中的大多数卵母细胞已排出第一极体(PBI),而大部分卵母细胞在MBP处理后未能排出PBI。MBP处理组的PBI排出率以剂量依赖性方式显著降低。也评估了卵母细胞成熟和死亡率。用ROS荧光强度评估MBP暴露是否导致氧化应激,在MBP暴露后ROS荧光强度显著增强,结果表明卵母细胞经历了氧化应激损伤。 图1. MBP暴露对猪卵母细胞减数分裂成熟的影响 2、MBP对猪卵母细胞mRNA表达的影响 为了研究MBP暴露对猪卵母细胞成熟的影响,进行了RNA-seq。在培养42小时后,MBP暴露组与对照组相比有149个基因的表达有显著差异,92个上调的基因和57个下调的基因 (padj <0.05,fold change > 2)(图2A)。对差异表达的基因进行GO富集分析。结果表明,MBP暴露后差异表达的基因在生物过程细胞骨架组织和细胞质微核中显著富集。显著富集的细胞成分包括ER伴侣复合物和线粒体外膜等(图2C)。这些结果提供了关于MBP对猪卵细胞质量产生负面影响的功能途径。 图2.转录组分析评估MBP暴露对卵母细胞成熟的影响 3、甘氨酸对暴露于MBP的卵母细胞的影响 为了评估甘氨酸对MBP暴露后卵母细胞成熟的影响。观察了纺锤体形态,验证了CDC26 (中/晚期有丝分裂转变调节因子) mRNA表达的变化(图3)。表明甘氨酸改善了MBP诱导的猪卵母细胞减数分裂异常。 聚类分析表明,在MBP暴露后,内质网伴侣复合物、线粒体外膜、线粒体和其他细胞成分显著富集(图4A)。在物理条件下,ER通过线粒体相关的ER膜(MAM)与线粒体相互作用。因此,使用Mander系数评估了ER膜(MAM)与线粒体之间的相互作用程度。结果表明MBP增加了线粒体与ER之间的相互作用,甘氨酸可以减少MBP诱导的线粒体和内质网之间的相互作用。通过分析MFN1和MFN2的蛋白表达、相对荧光强度以及基因表达量,发现甘氨酸可能通过保护MFN1和MFN2的表达来减轻MBP诱导的ER与线粒体之间的相互作用。 ER和线粒体之间相互作用的增强导致两个细胞器之间的钙转移增强,因此测量了MBP暴露后的猪卵母细胞的钙离子水平,包括[Ca2+]i,[Ca2+]ER和[Ca2+]m。与对照组相比,单独用甘氨酸治疗的组的[Ca2+]i水平降低,而MBP组的[Ca2+]i水平明显高于其他组,甘氨酸治疗显著降低[Ca2+]i水平(图5B)。用特定探针对ER和线粒体进行染色,以评估细胞内钙离子的总体动态平衡。结果表明,[Ca2+]m水平的变化趋势与四组[Ca2+]i水平的变化趋势相同。(图5D)。我们检查了[Ca2+]ER水平的趋势,MBP暴露组[Ca2+]ER水平显著降低,而甘氨酸治疗组的[Ca2+]ER水平明显高于MBP组(图5C)。 ROS和GSH的水平是氧化和抗氧化应激的主要指标。分析了ROS和GSH荧光强度,还分析了几种氧化应激和抗氧化应激相关基因的mRNA表达。MBP暴露显著上调MDA mRNA表达,甘氨酸治疗后下调了MDA mRNA的表达;MBP暴露显著下调了CAT的mRNA表达,甘氨酸治疗后使CAT的mRNA表达恢复至正常水平(图6),结果表明,甘氨酸可以保护卵母细胞免受MBP暴露引起的氧化应激。 氧化应激通常诱导凋亡。聚类分析表明,几个重要的凋亡相关基因的表达上调(图7A)。为了研究MBP处理是否会导致猪卵母细胞的早期凋亡,对卵母细胞进行了Annexin V和Caspase3染色(图7C和D),还分析了几个凋亡相关基因的表达,MBP暴露后BAX和Caspase 3表达增加、差异表达基因AIFM1表达下调。这些结果表明,甘氨酸对MBP诱导的细胞凋亡具有保护作用。 图3.甘氨酸对暴露于MBP的卵母细胞纺锤体形态的影响。 图4.甘氨酸对MBP暴露卵母细胞线粒体和内质网共定位的影响 图5.甘氨酸对用MBP处理的猪卵母细胞中Ca2+水平的影响 图6.甘氨酸对MBP暴露卵母细胞氧化应激的影响 图7. 甘氨酸改善了MBP暴露对猪卵母细胞凋亡的影响 研究结论 该结果证实了甘氨酸对MBP诱导的猪卵母细胞的细胞质成熟受损具有保护作用。从细胞器的角度,本研究揭示甘氨酸可以通过降低MFN1和MFN2的表达,进一步降低[Ca2+]m的水平来调节MAM相互作用,从而改善卵母细胞线粒体功能,降低ROS水平和卵母细胞凋亡,并减轻MBP诱导的卵母细胞减数分裂和细胞骨架异常的毒性作用。这些结果有助于我们理解MBP影响卵母细胞质量的毒理学机制,并且甘氨酸可以潜在地用于防止MBP诱导的来自人类或其他用于胚胎工程技术的动物物种的卵母细胞中的缺陷。 本研究的转录组测序和部分数据分析工作由上海派森诺生物科技股份有限公司完成。 文章一原文索引: Gao L, Zhang C, Yu S, et al. Glycine ameliorates MBP-induced meiotic abnormalities and apoptosis by regulating mitochondrial-endoplasmic reticulum interactions in porcine oocytes[J]. Environmental Pollution, 2022, 309: 119756.



文章二 甘氨酸调节脂质过氧化促进猪卵母细胞成熟和早期胚胎发育
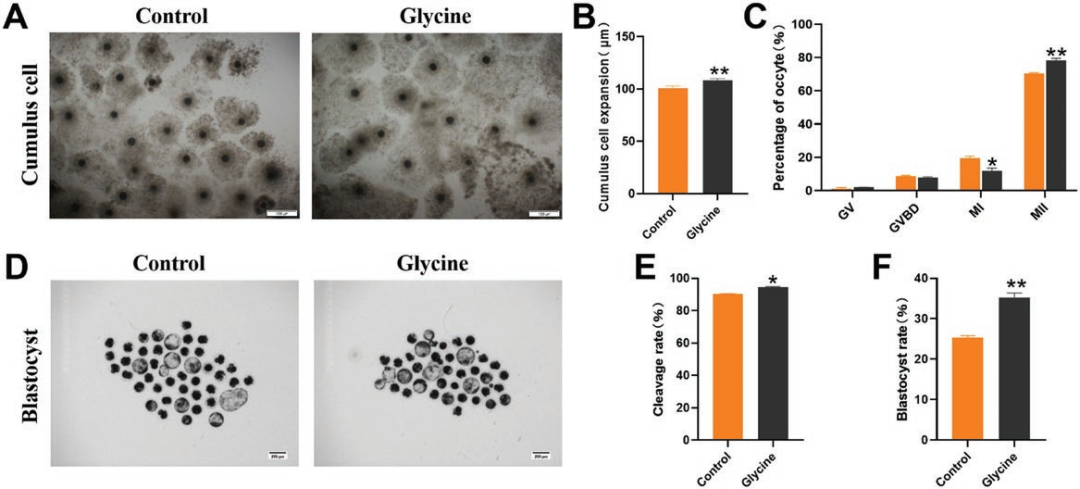
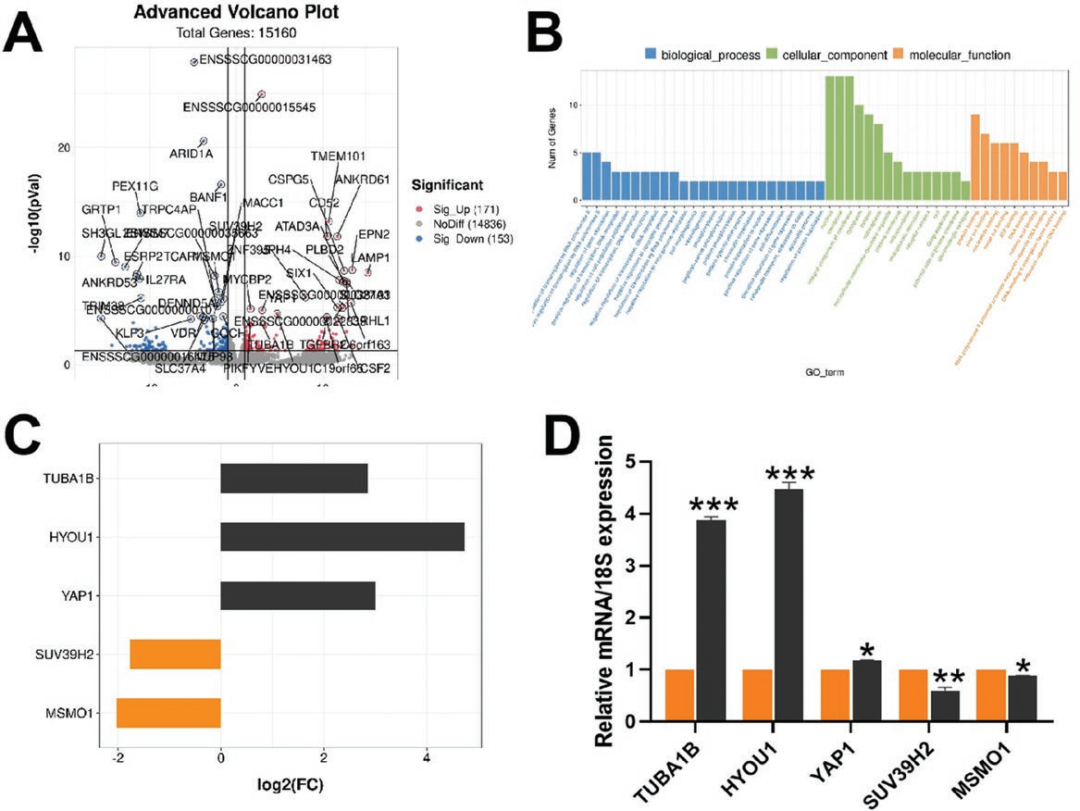
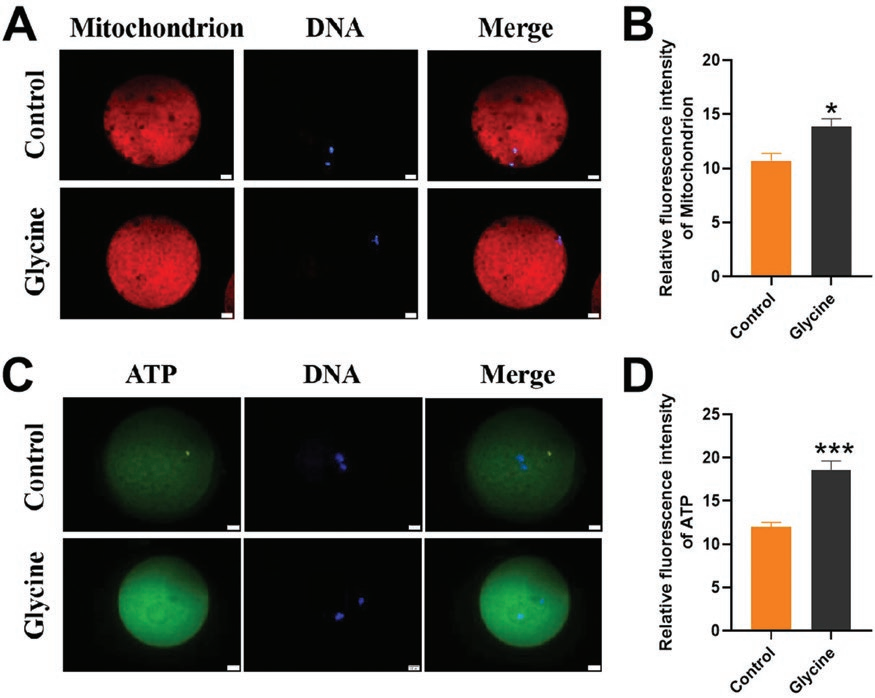
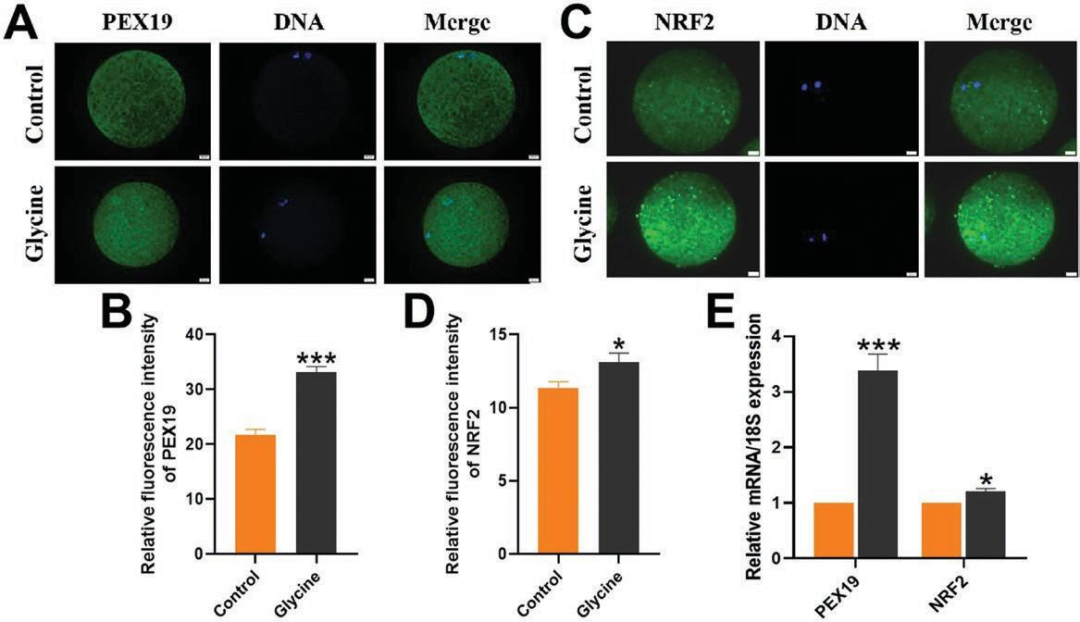
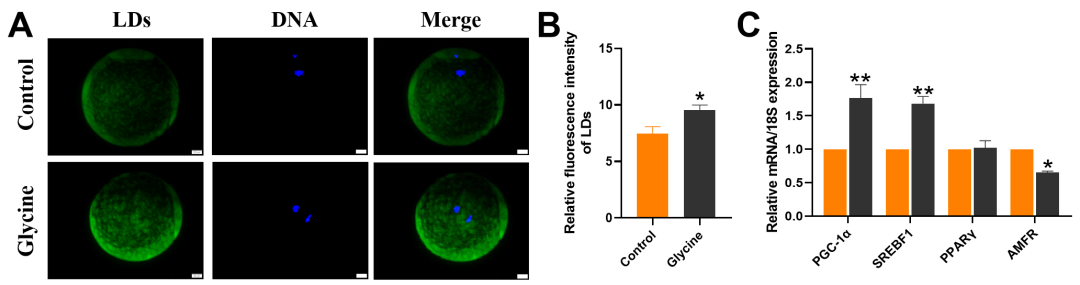
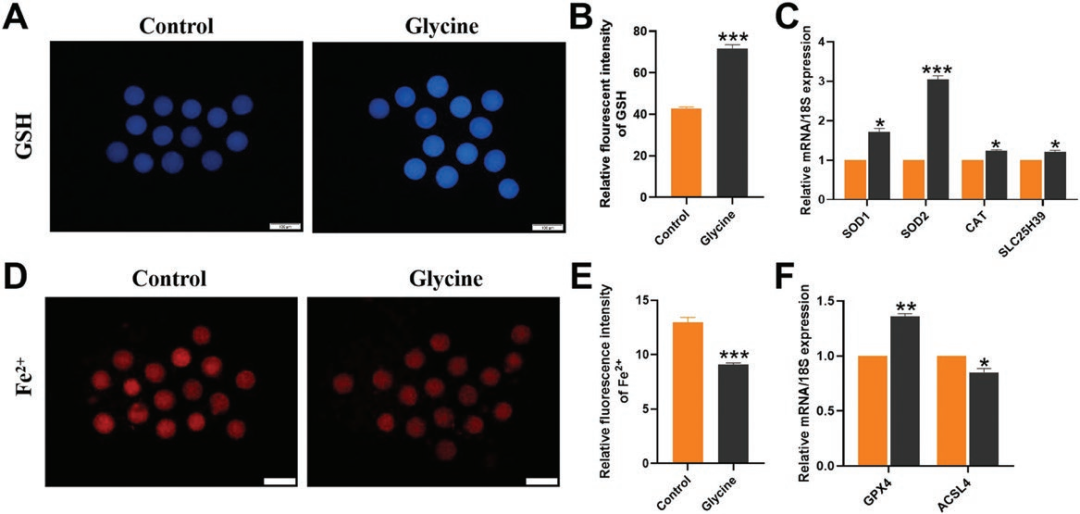
《Journal of Animal Science》 影响因子:3.338 研究背景 生产优质配子是家畜繁殖和种质资源保存的前提,尤其是优质卵母细胞。体外成熟(IVM)培养已成为获得成熟卵母细胞的重要途径,但体外培养的卵母细胞与体内卵泡微环境分离,比体内卵母细胞更容易受到外部环境变化的影响,这种脆弱性破坏了细胞内环境的稳态。 甘氨酸是谷胱甘肽(Glutathione, GSH)的主要成分之一,在体外保护猪卵母细胞方面发挥着重要作用。但甘氨酸的保护机制有待进一步阐明。本研究通过SMART-seq等技术确认甘氨酸是否可以调节ROS诱导的LPO,从而保护卵母细胞免受铁死亡并促进卵母细胞在体外成熟。本研究将为预防和改善卵母细胞体外培养过程中的氧化损伤提供理论依据。 技术路线 主要研究内容 1.甘氨酸处理对猪卵母细胞成熟和早期胚胎发育的影响 与对照相比,甘氨酸处理显著促进卵丘细胞扩散(图1A),这一结果也通过卵丘细胞的扩散分析得到证实(图1B);如图1C所示,甘氨酸处理还显著降低了发育至MI期的卵母细胞比例,并促进了大多数卵母细胞发育至MII期,同时,甘氨酸组的卵裂率和囊胚率也显著上调(图1D)。综上,甘氨酸处理促进猪卵母细胞的成熟和早期胚胎的发育。 图1:甘氨酸处理对猪卵母细胞成熟和早期胚胎发育的影响 2.甘氨酸对猪卵母细胞mRNA表达的影响 为了研究甘氨酸处理对猪卵母细胞质量影响的潜在机制,我们分析了对照组和甘氨酸组的转录组谱,并对猪卵母细胞进行RNA-seq检测。如火山图所示,甘氨酸组的卵母细胞与对照组的卵母细胞相比,共鉴定出15000个差异表达基因,其中有171个上调基因和153个下调基因(FC>2,P value<0.05)(图2A),并从中随机选取了5个差异显著的基因进行qPCR验证,基因变化趋势的一致性验证了SMART-seq的准确性(图2C.D)。GO富集分析表明,差异基因显著富集到的条目大多与细胞成分有关,包括细胞核、膜、整体膜成分、膜结合细胞器、质膜和线粒体等(图2B)。 图2:甘氨酸对卵母细胞成熟影响的转录组分析 3.甘氨酸对卵母细胞LPO的影响 细胞内ROS水平检测结果显示,甘氨酸治疗组的ROS荧光强度明显低于对照组(图3B),此外MDA含量也明显低于对照组(图3C)。 图3:甘氨酸对卵母细胞LPO的影响 4.甘氨酸对卵母细胞线粒体功能和过氧化物酶体的影响 本研究通过评估线粒体动力学,研究甘氨酸处理对卵母细胞成熟的影响。结果表明,甘氨酸补充组的线粒体荧光强度明显高于对照组(图4A),荧光强度分析也证实了这一结果。如图4C所示,与对照组相比,补充甘氨酸后ATP荧光强度显著上调。这些结果表明甘氨酸促进猪卵母细胞中线粒体功能的发育。 根据GO富集分析显示,差异基因显著富集在过氧化物酶体相关条目上。因此,通过免疫荧光染色检测了重要指标PEX19和NRF2的蛋白表达,如图5A和C所示,与对照组相比,甘氨酸组PEX19和NRF2的信号强度明显增强。这些数据表明甘氨酸处理促进了猪卵母细胞的过氧化物酶体功能。 图4:甘氨酸对卵母细胞线粒体功能的影响 图5:甘氨酸对卵母细胞过氧化物酶体的影响 5.甘氨酸对卵母细胞脂质代谢的影响 本研究还通过BODIPY-LD(一种用于中性脂质的新型绿色荧光染料)证明了甘氨酸组卵母细胞的LDs水平也有明显上升趋势,这表明甘氨酸处理可以促进卵母细胞的脂质代谢(图6)。 图6:甘氨酸对卵母细胞脂质代谢的影响 6.甘氨酸对卵母细胞谷胱甘肽和铁离子水平的影响 甘氨酸组中的卵母细胞产生非常强的GSH荧光信号,GSH荧光强度分析证实了这一发现(图7B),抗氧化相关基因的表达趋势也证实了结果(图7C);铁积累的增加是诱导铁死亡的关键,荧光强度实验及铁死亡相关基因的表达谱均证实了甘氨酸表达可以通过增加GSH水平来减少铁死亡的发生(图7D.E.F)。 图7:甘氨酸对卵母细胞中GSH和铁离子水平的影响 研究结论 本研究结果表明,补充甘氨酸促进了卵丘细胞的扩散和卵母细胞的成熟。卵母细胞发育能力检测表明,补充甘氨酸显著提高了体外受精(IVF)过程中的卵裂率和囊胚率;SMART-seq表明这种效应与甘氨酸介导的细胞膜结构和功能调节有关。外源添加甘氨酸,通过增强线粒体、过氧化物酶体和脂滴(LDs)的功能,减少活性氧(ROS)引起的脂质过氧化并降低丙二醛(MDA)的水平和脂质代谢相关因子水平,从而防止生物膜损伤并减少铁死亡的发生以维持正常的卵母细胞发育功能。 本研究的转录组测序和部分数据分析工作由上海派森诺生物科技有限公司完成。 文章二原文索引: Gao L, Zhang C, Zheng Y, et al. Glycine regulates lipid peroxidation promoting porcine oocyte maturation and early embryonic development[J]. Journal of Animal Science, 2023, 101: skac425.