2023-05-30

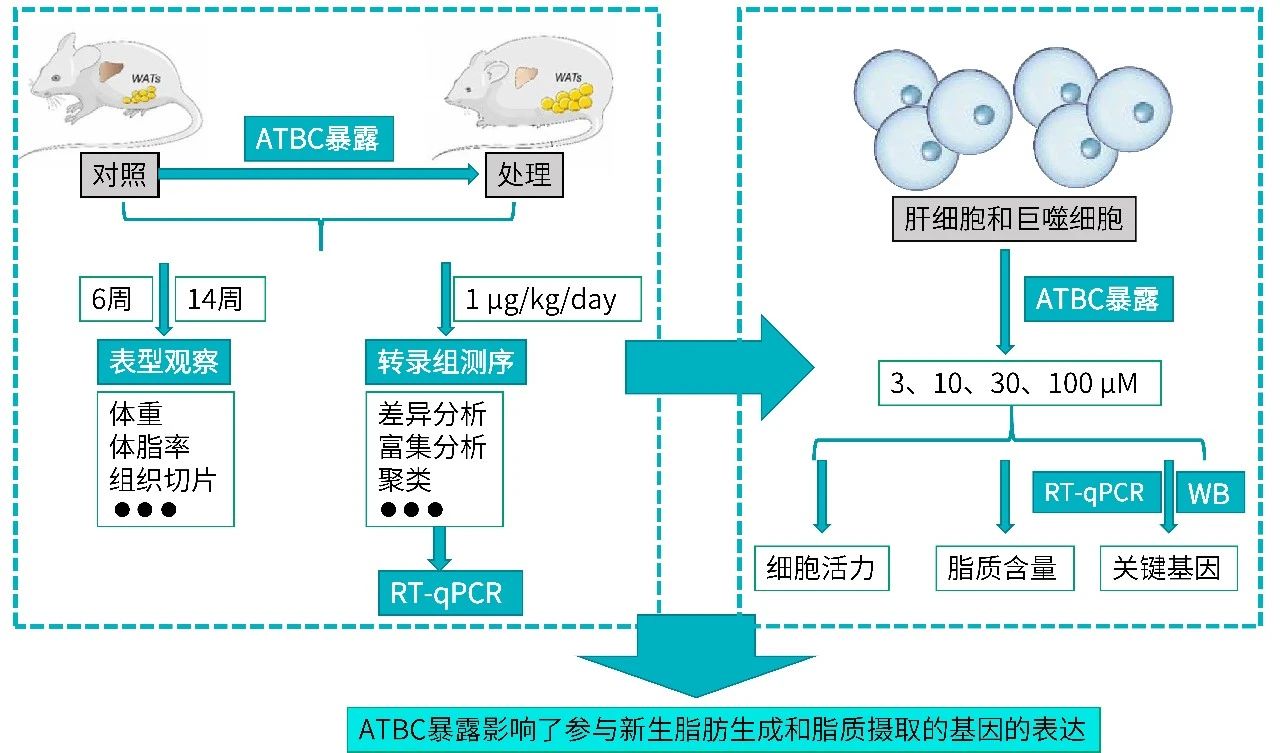
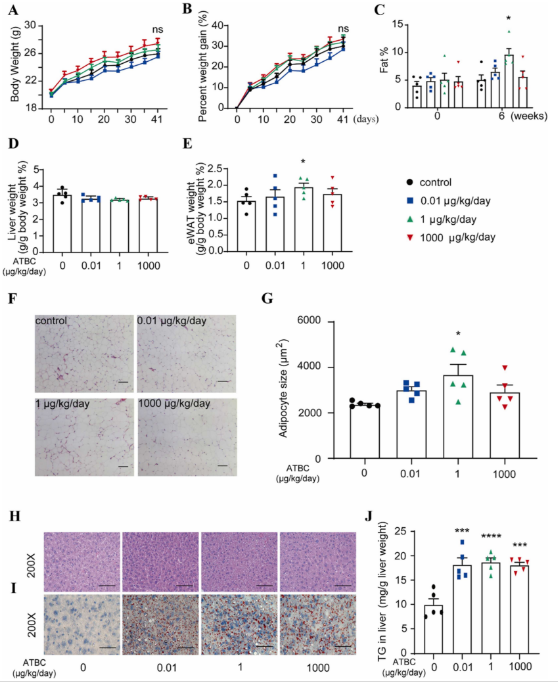
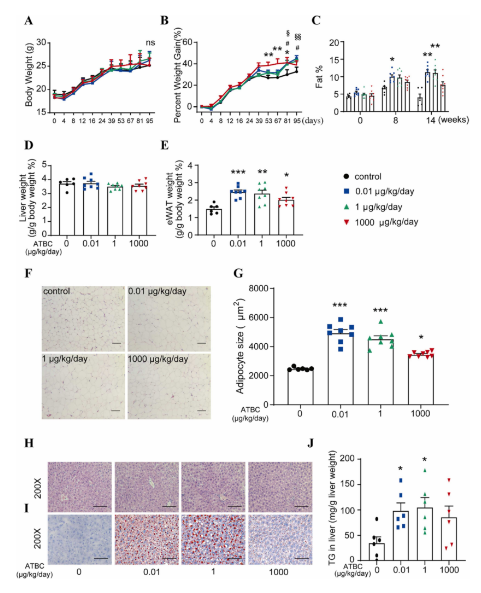
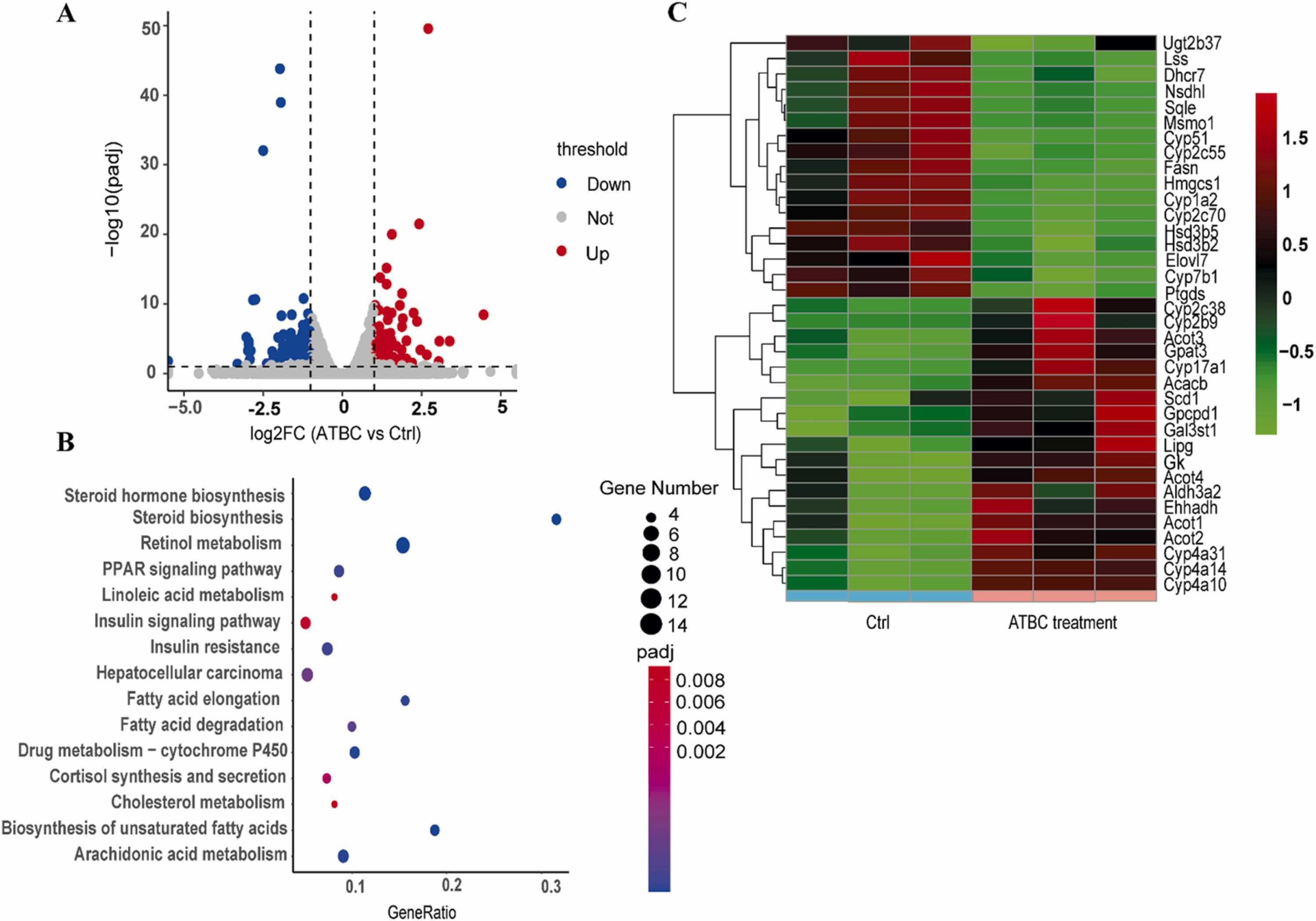
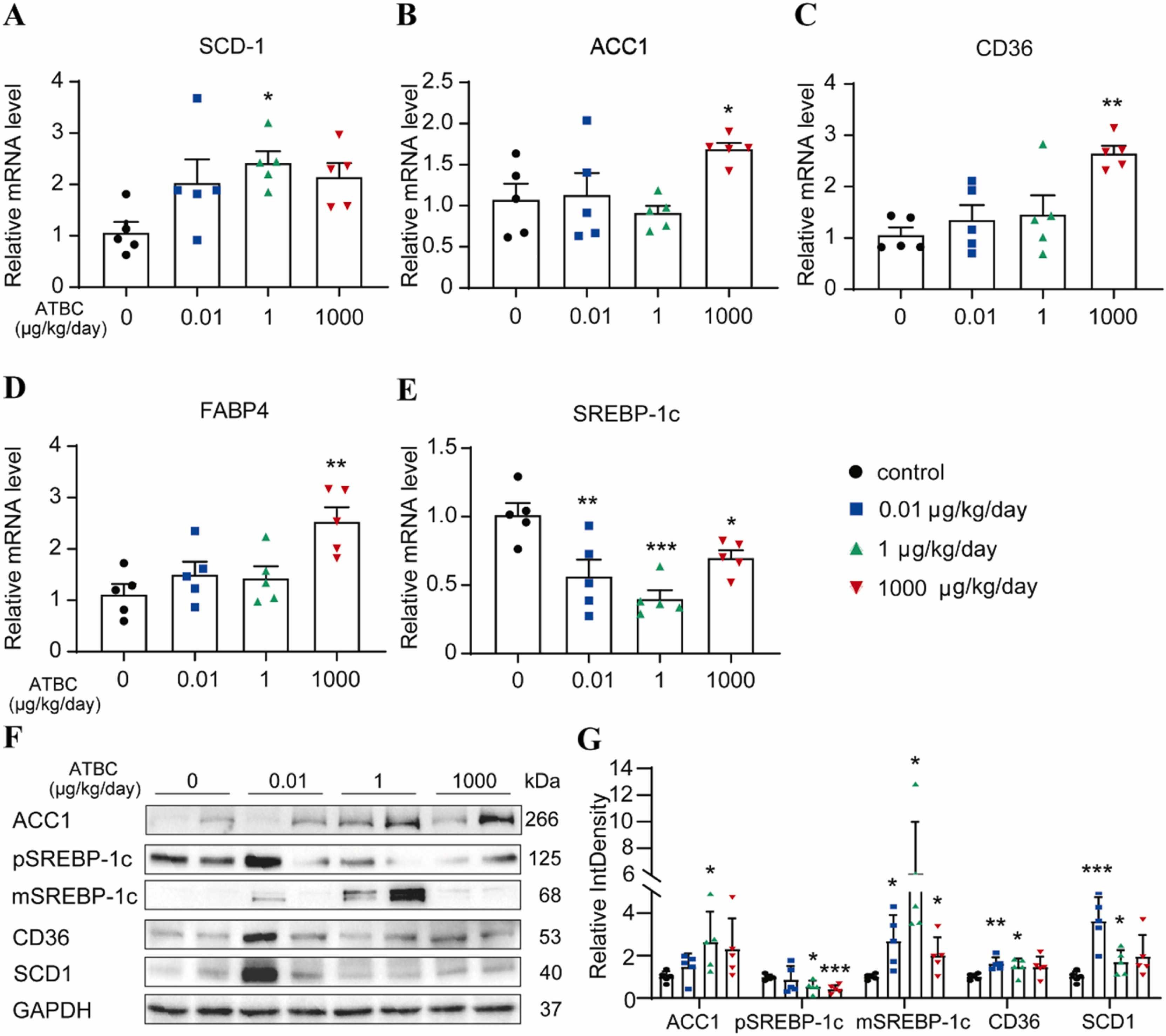
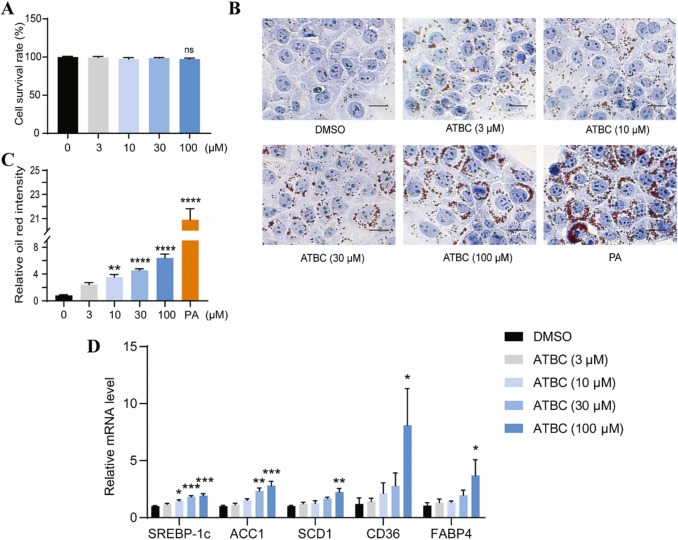
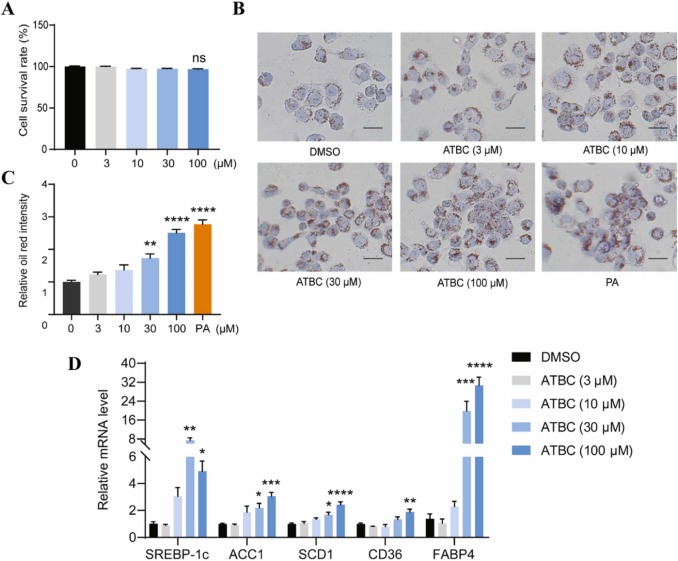
《Journal of Hazardous Materials》 影响因子:14.224 文章题目:Characterizing the obesogenic and fatty liver-inducing effects of Acetyl tributyl citrate (ATBC) plasticizer using both in vivo and in vitro models 技术手段:RNA-Seq 派森诺生物与南京理工大学携手合作,在《Journal of Hazardous Materials》上发表了利用体内、体外模型表征乙酰柠檬酸三丁酯(ATBC)增塑剂的致肥胖和脂肪肝诱导效应的研究成果。 研究背景 近几十年来,肥胖和非酒精性脂肪肝病(NAFLD)的发病率均在迅速上升。大量证据表明,肥胖和NAFLD的大幅增加不仅与生物因素有关,也与环境因素,包括接触化学物质、空气污染、塑料的使用等相关。化学品暴露在肥胖的大流行中起着重要作用。然而,目前对环境致肥源的认识还较浅,迫切需要深入研究现有致肥源的数量和类型、致肥源诱发肥胖和NAFLD的潜在机制,以及如何避免这些有害影响。 乙酰柠檬酸三丁酯(ATBC)是替代传统邻苯二甲酸二乙己酯(DEHP)的主要柠檬酸增塑剂。ATBC被广泛用于制造食品包装产品、儿童玩具、以及聚氯乙烯医疗器械等。目前,ATBC被认为是一种安全的增塑剂。但随着ATBC应用的增加,其高迁移率引起了人们对其潜在暴露风险的担忧。ATBC不与塑料中的聚合物发生化学结合,因此很容易从食品包装、医疗器械和其他塑料制品中泄漏,并扩散到血液、体液、空气、室内灰尘、环境土壤和水中。因此对ATBC的健康安全和风险进行全面系统的评估具有重要意义。 技术路线 研究结果 1. ATBC暴露对雄性C57BL/6J小鼠致肥及脂肪肝的诱导作用 分别饲喂小鼠对照饲料和不同剂量的添加ATBC的饲料,持续6周。结果显示,ATBC暴露对体重增加没有明显影响(图1A, B),但与对照组相比,中位剂量组(1 μg/kg/day ATBC)体脂率显著升高(图1C)。在暴露结束时,采集肝脏和皮下腹部脂肪组织并称重,肝脏重量与体重之比不受ATBC暴露的影响(图1D),而腹部皮下脂肪组织重量与体重之比在中位剂量组明显更高(图1E)。组织学分析表明,ATBC暴露小鼠的脂肪细胞大小增加(图1F, G)。综上,中位剂量的ATBC暴露诱导小鼠脂肪生成和肥胖。肝组织H&E分析显示,ATBC暴露未引起明显的肝损伤(图1H)。然而,即使是最低剂量的ATBC暴露也能显著增加肝脏脂质含量(图1I)。此外,所有ATBC处理组的肝脏TG水平均显著增加(图1J)。上述结果表明,6周的ATBC暴露可导致C57BL/ 6J小鼠致肥,并具有显著的脂肪肝诱导作用。 图1. ATBC暴露的致肥胖及脂肪肝诱导作用 另一组独立的小鼠暴露于不同剂量的ATBC,持续14周。与对照组相比,三个剂量组的体重增加的百分比显著增加(图2A, B)。低剂量和中剂量ATBC组体脂率显著增加(图2C)。所有剂量组的皮下脂肪组织重量与体重的比例均显著高于对照小鼠(图2E)。以及脂肪细胞大小均显著增加(图2F, G)。并且ATBC暴露明显诱导肝脏脂质积累,导致三个剂量组均出现脂肪肝特征(图2 I, J)。 图2. 长期暴露于ATBC诱导小鼠肥胖和肝脏脂肪变性 2. 小鼠肝组织转录组测序分析 与对照组相比,中剂量组有134个基因上调,182个基因下调(图3A)。KEGG分析表明,这些差异表达的基因主要富集在脂质代谢相关通路,包括类固醇生物合成通路、PPAR信号通路、胰岛素信号通路、脂肪酸延伸降解途径、不饱和脂肪酸生物合成途径、胆固醇代谢途径等(图3B)。ATBC暴露显著改变了许多调节脂质代谢过程的基因的表达,包括Scd1、Fasn、Elovl7等(图3C)。 图3. 对照和中剂量(1 μg/kg/day)ATBC处理小鼠肝组织转录组测序 RT-qPCR 结果表明,中剂量组Scd-1表达显著增加(图4A),这与RNA-seq数据一致(图3C)。此外,高剂量ATBC暴露诱导PPAR通路调控的靶基因Acc1 、Cd36 和Fabp4的表达显著增加(图4B-D)。相比之下,三个剂量组Srebp-1c的表达降低(图4E),WB结果显示,ATBC暴露增加了ACC1、SCD1和CD36的表达(图4F, G)。ATBC暴露降低了SREBP-1c前体(pSREBP-1c)的表达水平,但成熟裂解形式的SREBP-1c 的表达增加(图4F, G)。这些结果表明,在ATBC处理的小鼠中,尽管SREBP-1c前体mRNA和蛋白水平均下降,但更多的SREBP-1c被激活到成熟形态,从而进一步诱导脂肪生成调控基因的表达。 图4. ATBC对小鼠肝组织脂质代谢调控基因表达的影响 3. ATBC促进AML12小鼠肝细胞和THP-1人巨噬细胞的脂质积累 用不同剂量的ATBC处理小鼠肝细胞36小时。结果显示,ATBC处理对细胞活力没有明显影响(图5A)。ATBC处理以剂量依赖的方式显著增加了细胞内脂质积累(图5B, C)。即使是低剂量的ATBC也能够扰乱脂质代谢稳态。此外,ATBC处理增加了肝细胞中参与脂肪生成和脂质摄取相关基因的表达,其中100 μM ATBC表现出最强的效果(图5D)。 图5. ATBC处理促进了AML12肝细胞的脂质积累,并诱导了脂肪生成和脂质摄取相关基因的表达 用ATBC(3、10、30、100 μM)处理成熟的人THP-1细胞36 h。结果显示,ATBC处理对THP-1巨噬细胞不产生细胞毒性(图6A)。然而,ATBC暴露刺激了THP-1巨噬细胞中的脂质积累(图6B)。此外,ATBC还显著增加了THP-1巨噬细胞中脂肪生成基因和参与细胞脂质吸收的基因的表达(图6C),这与小鼠肝细胞的结果一致。 图6. ATBC诱导THP-1巨噬细胞细胞内脂质积累。 结 论 本研究首次通过体内和体外暴露模型揭示了ATBC的致肥和脂肪肝诱导作用。ATBC暴露增加了小鼠的体重增加,增加了体脂含量和脂肪细胞的大小,诱导了肝脏脂肪变性。与体内效应一致,ATBC处理增加了体外肝细胞中的细胞内脂质积聚。ATBC暴露影响了参与新生脂肪生成和脂质摄取的基因的表达。综上所述,ATBC可能是一种潜在的环境致肥源,具有代谢紊乱和脂肪肝诱导风险,在一定程度上导致了全球肥胖和脂肪肝的流行,应重新评估其在诸多消费品中的应用。 本研究的转录组测序和部分数据分析工作由上海派森诺生物科技股份有限公司完成。 原文索引: Zhang W, Jie J, Xu Q, Wei R, Liao X, Zhang D, Zhang Y, Zhang J, Su G, Chen Y, Weng D. Characterizing the obesogenic and fatty liver-inducing effects of Acetyl tributyl citrate (ATBC) plasticizer using both in vivo and in vitro models. J Hazard Mater. 2023 Mar 5;445:130548. doi: 10.1016/j.jhazmat.2022.130548.