
2023-07-11

《Experimental & Molecular Medicine》
影响因子:12.8
上海交通大学在国际著名杂志《Experimental & Molecular Medicine》发表了一种治疗阿尔茨海默症的新策略,利用 TRPV1调节神经元脂质代谢和自噬稳态来减轻 ApoE4 等位基因影响。本研究中脂质代谢以及转录组测序部分分析工作均由上海派森诺生物科技股份有限公司完成。
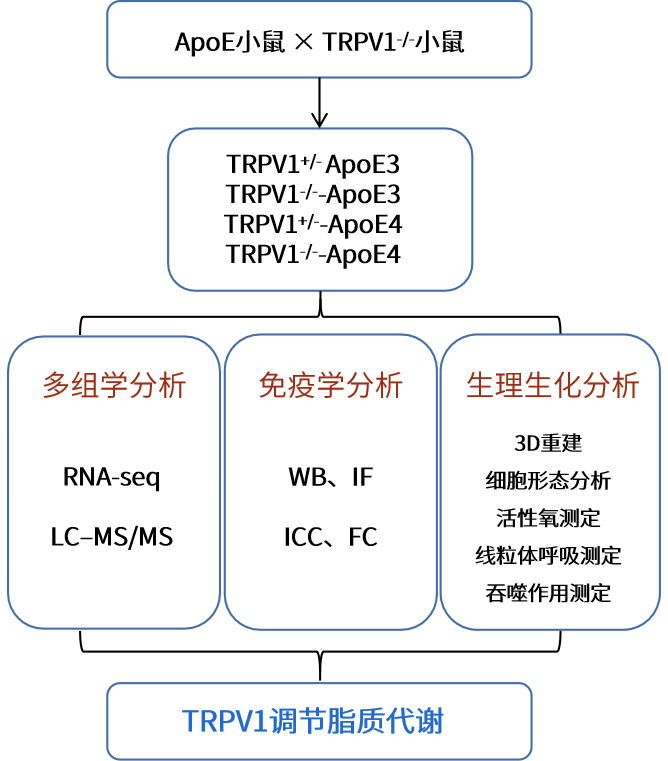
技术路线
研究背景
在ε2 -ε4多态性等位基因中,载脂蛋白E 基因的ε4等位基因是迟发性阿尔茨海默病(LOAD)的最强的遗传风险因子,ApoE4基因拷贝数增加,阿尔茨海默病患病风险也将随之增加。多项研究发现,APOE4与β-淀粉样蛋白沉积增加、tau蛋白过度磷酸化和聚集、认知能力下降加速相关。然而,APOE4介导这些效应的机制还不完全清楚。因此,阐明APOE4诱发阿尔兹海默病的分子机制和细胞途径,对预防和治愈阿尔兹海默病十分重要。
研究材料与方法
1.实验材料
转基因小鼠ApoE3或ApoE4与TRPV1−/−小鼠杂交后代 2.测序平台 Agilent 1290 Infinity LC、Illumina NovaSeq 5000 3.分析方法 LC‒MS/MS、RNA-seq、WB、IF、ICC、FC等
研究结果
1.ApoE4等位基因导致神经元和小胶质细胞脂质代谢功能障碍
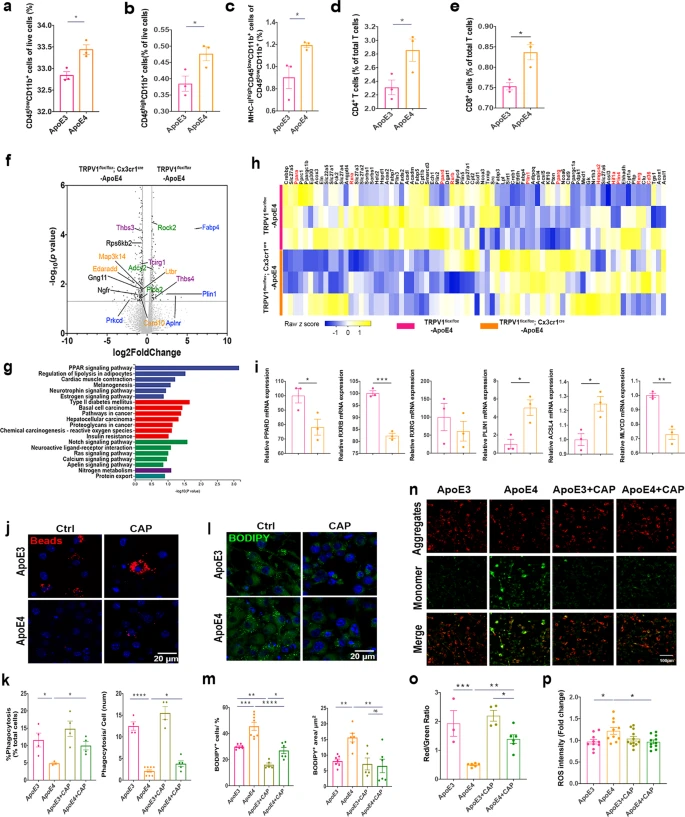
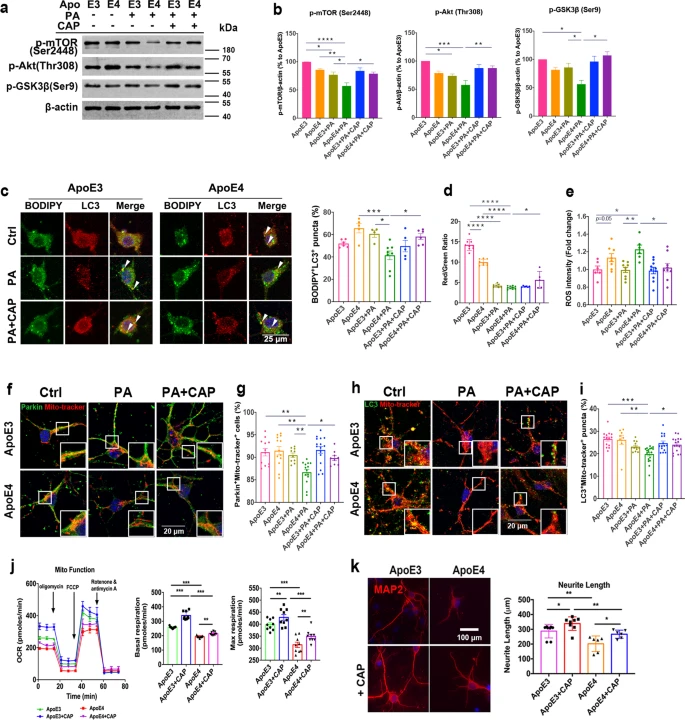
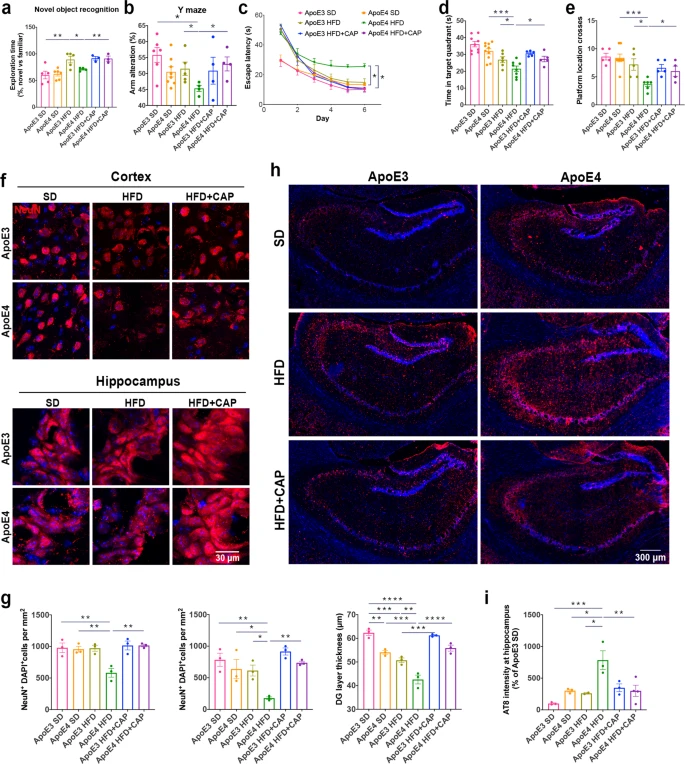
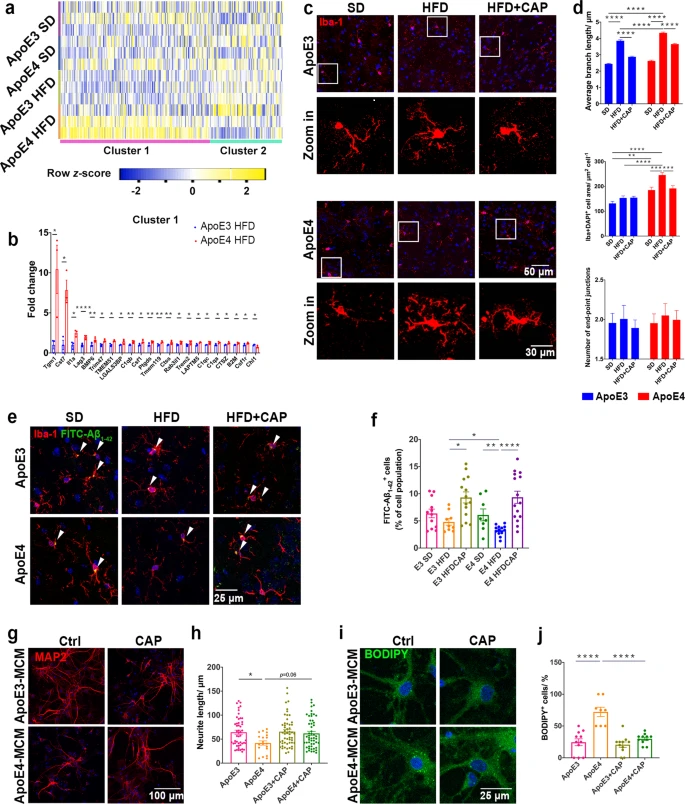
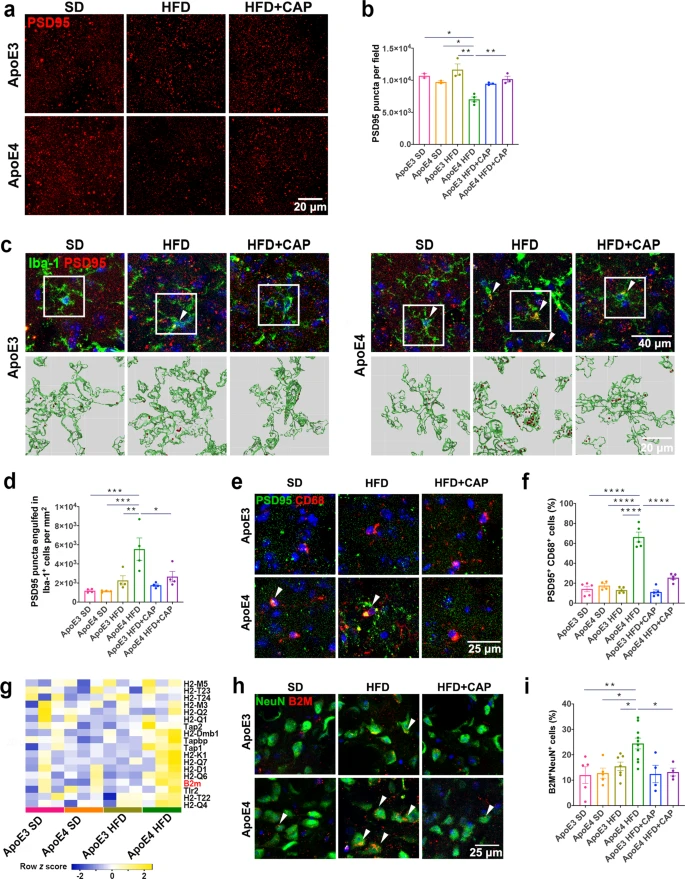
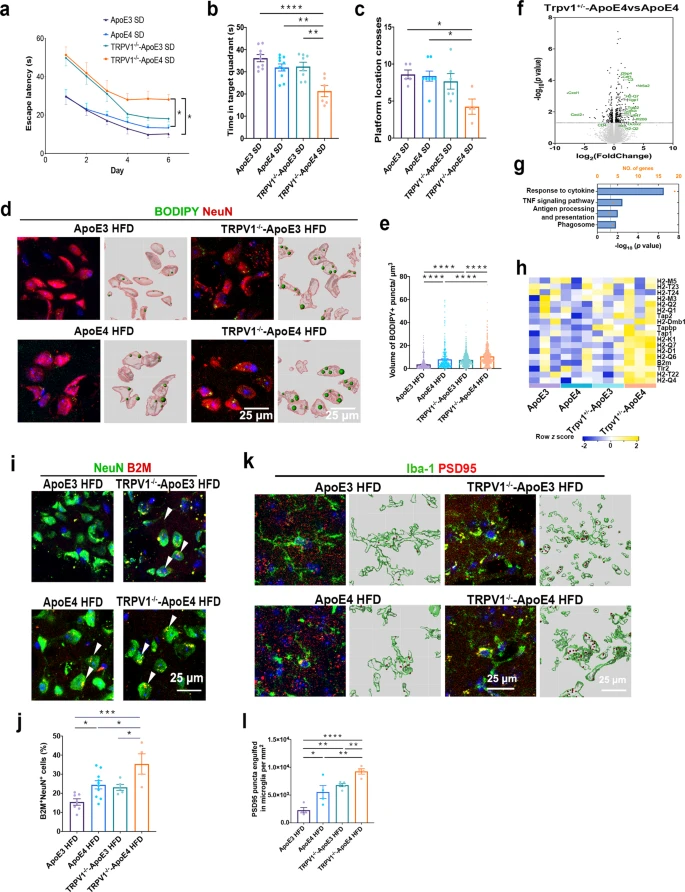
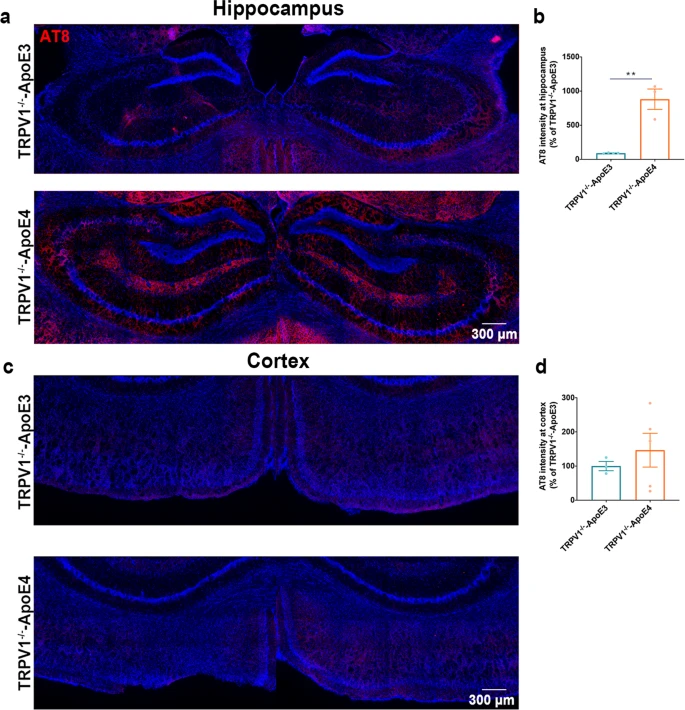
全基因组关联研究表明,脂质代谢紊乱与许多迟发性神经退行性疾病有关,例如阿尔茨海默症。研究通过免疫共荧光染色表明携带ApoE4等位基因的AD患者比健康者在小胶质细胞和神经元中积累了更多的脂滴(图1a,b),但是星形胶质细胞中的脂滴积累没有差异。质谱定量结果显示ApoE4 小鼠大脑中磷酸胆碱(PC) 显著下调(图1f),打破了细胞内脂质稳态。转录组测序共筛选到76个差异基因(图1g,h),显著富集在炎症反应以及多种能量代谢等通路上(图1j),表明 ApoE4 小鼠大脑中的能量代谢失调。此外WB结果中ApoE4 小鼠的 Akt/mTOR 和p-IRS1的蛋白水平低于 ApoE3 小鼠(图 1k,l),表明 ApoE4 导致能量代谢功能障碍和胰岛素抵抗。进一步研究发现 ApoE3 HFD 与ApoE4 HFD 小鼠相比,其神经元和小胶质细胞中脂滴显着积累(图 1m,n)。 图1 ApoE4等位基因导致神经元和小胶质细胞脂质代谢功能障碍 2.TRPV1 激活调节 ApoE4 诱导的小胶质细胞脂滴积累和免疫功能障碍 为了研究 ApoE4 对小鼠大脑中免疫细胞的影响,使用流式细胞术定量 ApoE3 和 ApoE4 小鼠大脑中的免疫细胞,结果显示,ApoE4 小鼠大脑中的 CD45lowCD11b+ 小胶质细胞显着增加(图 2a-e),外周免疫细胞、CD45highCD11b+ 单核细胞、CD4+ T 细胞和 CD8+ T 细胞也显著上调。转录组差异分析及富集分析结果表明ApoE4 小鼠大脑中 TRPV1 激活导致了胶质细胞中的脂质积累(图 2f-g)。此外使用辣椒素对 TRPV1 进行激活可减弱 ApoE4 BV2 细胞中 MMP 去极化和 ROS 产生(图 2n-p)。 图2 TRPV1激活逆转ApoE4诱导的小胶质脂滴积聚和免疫功能障碍 3.TRPV1 激活逆转 ApoE4 诱导的神经元代谢损伤和脂滴积累 PA 是一种饱和长链脂肪酸,可用于模拟体内 HFD 暴露,免疫荧光结果表明 TRPV1 激动剂通过诱导自噬促进神经元脂滴清除(图 3a-c),此外 TRPV1 激活挽救了脂质代谢过程中 ApoE4 诱导的神经元自噬损伤(图 3f-i)。与 ApoE4 细胞相比,辣椒素处理显着增加了 ApoE4 + 辣椒素原代神经元的基础呼吸和最大呼吸(图 3j)。MAP2+神经元的免疫荧光显示,ApoE4+辣椒素神经元的神经突长度、分支数量和面积显着长于ApoE4神经元(图3k)。 图3 TRPV1激活逆转apoe4诱导的神经元自噬损伤和脂滴积累 4.TRPV1 激活可挽救 ApoE4 HFD 喂养小鼠的记忆障碍和神经元损失 通过Y迷宫测试分析小鼠的空间工作记忆功能,评估结果表明,经辣椒素处理的 ApoE4 HFD 小鼠学习和记忆能力有所改善(图4a-e)。通过磷酸化 tau (AT8) 的免疫染色显示与 ApoE3 HFD 小鼠相比,ApoE4 HFD 小鼠海马体的表达显着上调,又通过对海马体中磷酸化 tau 免疫染色,结果表明辣椒素对 TRPV1 的激活可改善 ApoE4 HFD 诱导的 tau 病理学(图 4h,i)。 图4 TRPV1激活可挽救 ApoE4 HFD 喂养小鼠的记忆障碍和神经元损失 5.激活TRPV1可减弱ApoE4 HFD小鼠的小胶质瘤表型 作为大脑驻留的免疫细胞,小胶质细胞代表着衰老小鼠大脑中脂滴积累的促炎和吞噬功能损伤状态,于是本研究分析了与小胶质细胞功能相关的基因转录组谱,结果显示与 ApoE3 HFD 小鼠相比,ApoE4 HFD 小鼠大脑中促炎基因表达显著上调,正常细胞功能基因的表达显著下调(图5a,b)。对小胶质细胞形态分析显示,ApoE4 HFD 小鼠的小胶质细胞分支长度和 Iba-1+ 细胞面积显著增加, ApoE4 HFD 小鼠中小胶质细胞终点连接的数量也呈现增长趋势(图 5c、d)。为了确定 TRPV1 激活是否可以挽救 ApoE4 诱导的小胶质细胞吞噬活性受损,进行了小胶质细胞吞噬测定,测定显示TRPV1激活挽救了ApoE4小胶质细胞诱导的神经元生长受损(图5g,h)。 图5 TRPV1激活可减弱ApoE4 HFD小鼠的小胶质细胞增生和小胶质细胞脂质积累 6.TRPV1 激活减弱 ApoE4 HFD 小鼠突触的小胶质细胞吞噬作用 为了研究 TRPV1 对神经元突触的影响,使用突触后标记 PSD95 进行染色,PSD95和Iba-1双重染色显示,与ApoE4 HFD小鼠相比,TRPV1激活显着下调ApoE4 HFD +辣椒素小鼠中小胶质细胞对突触的吞噬,另外NeuN和B2M双重染色显示神经元 B2M 表达增加,表明 ApoE4 HFD 小鼠中 MHC-I 通路上调。,TRPV1 激活显着降低了 ApoE4 HFD + 辣椒素小鼠的神经元 B2M 表达(图6h,i)。 图6 TRPV1激活可减弱ApoE4 HFD小鼠突触的小胶质吞噬作用 7.TRPV1 基因缺失加剧了 ApoE4 小鼠的识别障碍和 tau 病理学 为了进一步研究TRPV1对神经元脂质代谢功能障碍的影响,敲除了ApoE3和ApoE4小鼠的TRPV1基因,再通过细胞免疫染色和转录组分析,结果显示TRPV1 基因缺失通过上调 ApoE4 小鼠神经元 MHC-I 表达,导致小胶质细胞吞噬更多突触(图 7k,l)。另外磷酸化 tau 免疫荧光显示,与 TRPV1−/−-ApoE3 小鼠相比,TRPV1−/−-ApoE4 小鼠的海马体中的表达显着上调(图 8a-d)。 图7 TRPV1基因缺陷加重了ApoE4小鼠的识别损伤和神经元脂滴积累 图8 TRPV1基因缺陷加重了ApoE4诱导tau病理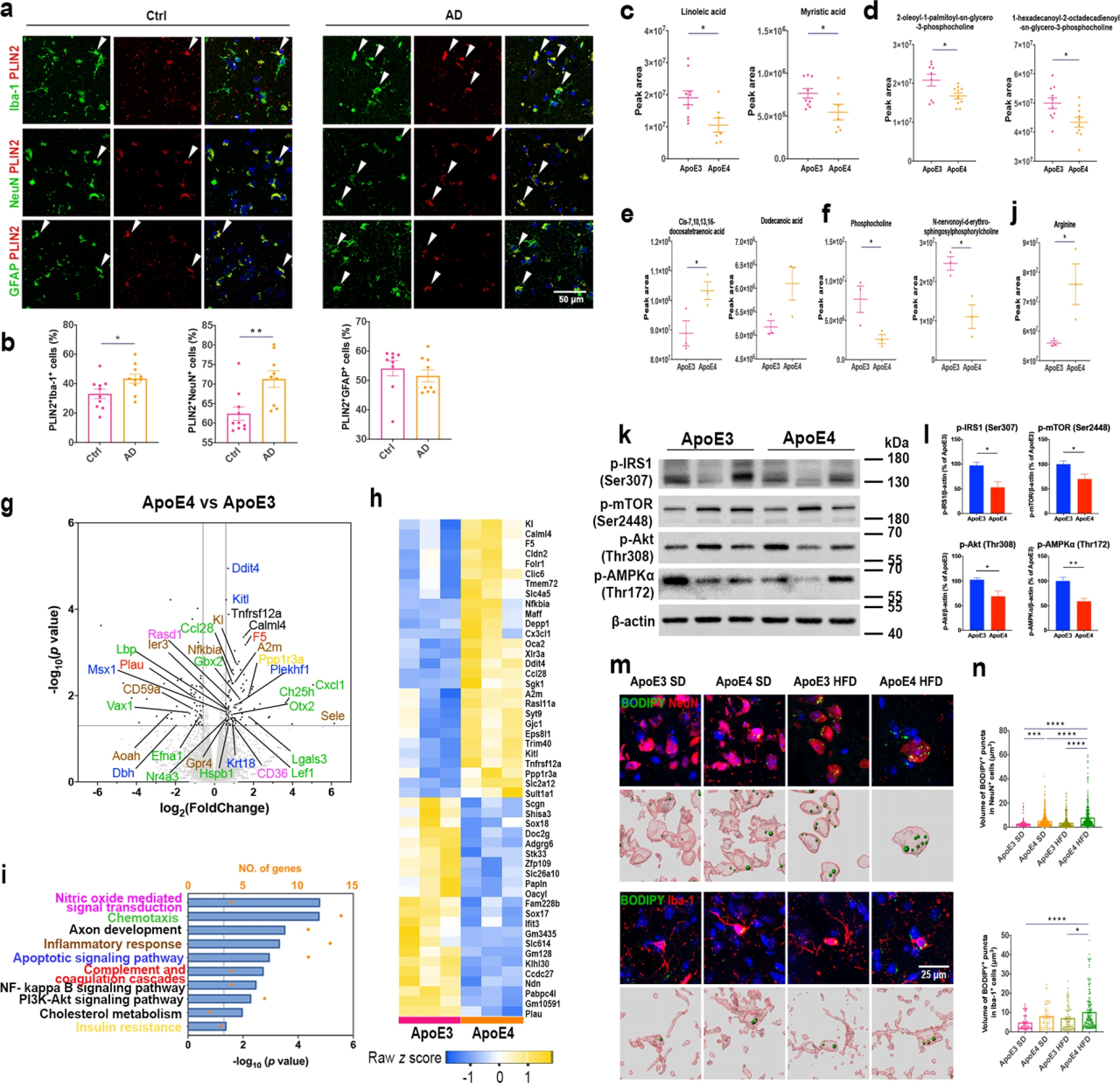
小 结
本研究发现,用辣椒素激活TRPV1可逆转ApoE4诱导的小胶质细胞免疫功能障碍和神经元自噬损伤,另外TRPV1基因缺失加重了ApoE4小鼠的识别记忆障碍和tau病理。总而言之,TRPV1调节脂质代谢可减轻ApoE4等位基因的影响,这可能是一种潜在的阿尔茨海默症治疗方法。