
2023-08-11

《Nature communications》 影响因子:16.6 最近,华中农业大学在《Nature communications》发表了题为“Cooperative microbial interactions drive spatial segregation in porous environments”的论文。文中指出孔隙环境中浮游微生物与生物膜微生物之间的相互作用会促使微生物群落空间分化。研究证明了生物膜形成能力较弱的Arthrobacter通过去除生物膜形成抑制分子D型氨基酸,促进Pseudomonas在固相表面定植形成生物膜。同时,生物膜在形成过程中分泌的公共代谢产物,则会提高Arthrobacter在流体环境中的生长与繁殖。这种互惠型合作关系促使Arthrobacter与Pseudomonas能够在群落定植初期分别快速占据流体环境和固相表面,进而诱导孔隙环境中微生物群落的空间组装与分布。上述研究结果为土壤和沉积物等孔隙环境中微生物群落的组装和演替提供了新的见解。 以上研究的16S rRNA扩增子测序,微生物基因组测序,微生物转录组测序,非靶向代谢组检测和部分数据分析工作由上海派森诺生物科技股份有限公司完成。
研究背景 土壤和沉积物等孔隙环境是地球上微生物的主要栖息地。在这些孔隙环境中,微生物通过分泌胞外聚合物相互粘结形成具有多细胞结构的生物膜。与浮游状态的细胞相比,生物膜内的细胞具有更强的环境适应能力和独特的生态功能等特征。因此,揭示生物膜形成与功能发挥机制对于维护微生物生态系统、保障环境健康、支撑绿色发展至关重要。在生物膜形成过程中,微生物通过相互作用形成具有一定空间组织结构的生物膜群落,但微生物之间复杂的相互作用如何调控生物膜群落的组装和空间分布仍不清楚。基于上述背景,研究团队自主构建了具有微柱阵列的土壤微流控芯片,解析了孔隙环境中土壤生物膜群落的组装过程,为土壤和沉积物等孔隙环境中微生物群落的组装和演替提供了新的见解。
研究方法 研究者开发了一种微柱阵列的微流控芯片模拟多孔环境(图1a)。取稻田土壤深度为0-20 cm,离心分离土壤微生物,并抽提土壤萃取液制作土壤微生物提取强化培养基(ISEM)。通过微流控培养、16S rRNA扩增子测序、qPCR、FISH、代谢组学、微生物分离纯培养等实验手段分析多孔环境中生物膜形成和微生物群落空间分化机制。
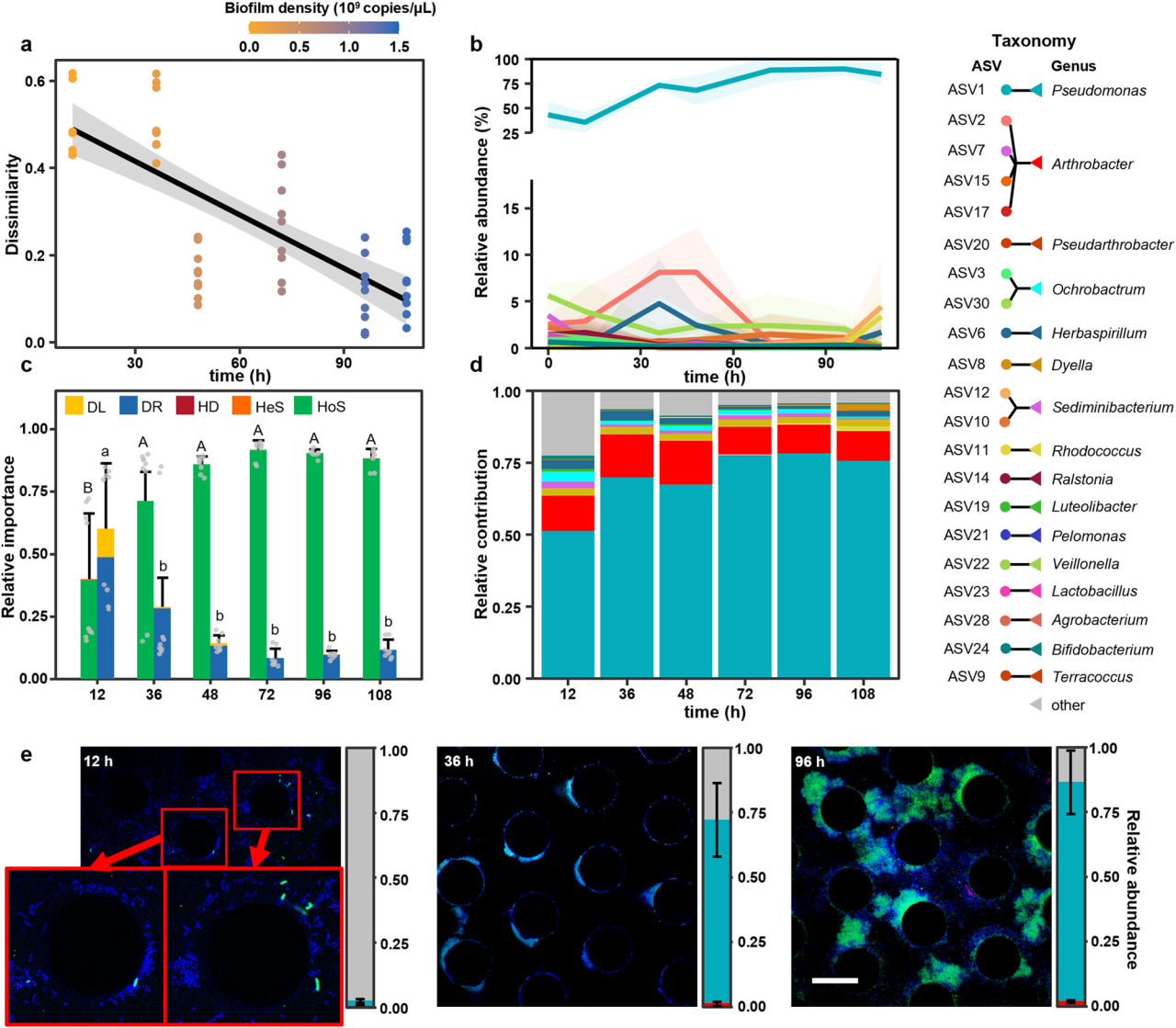
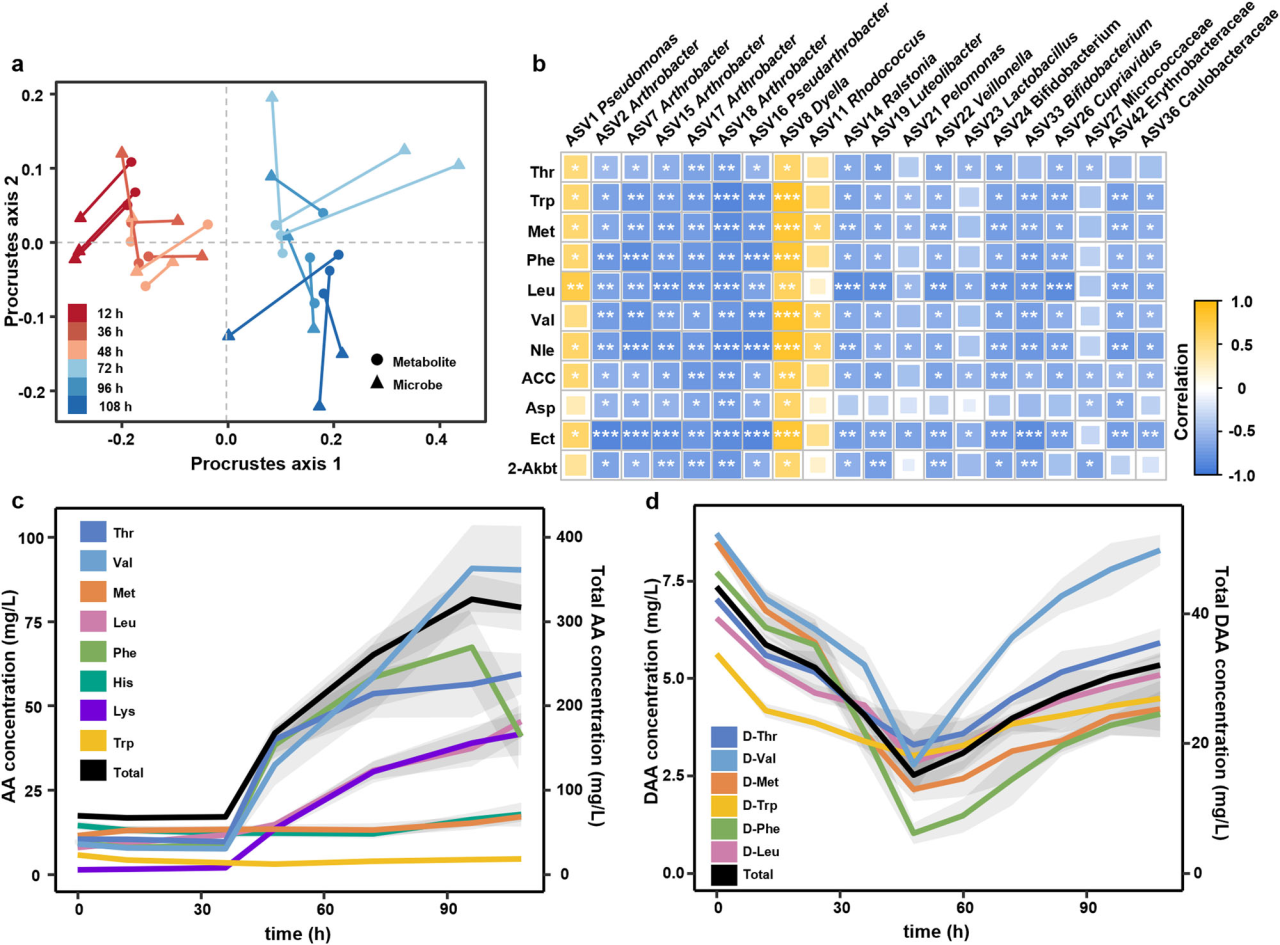
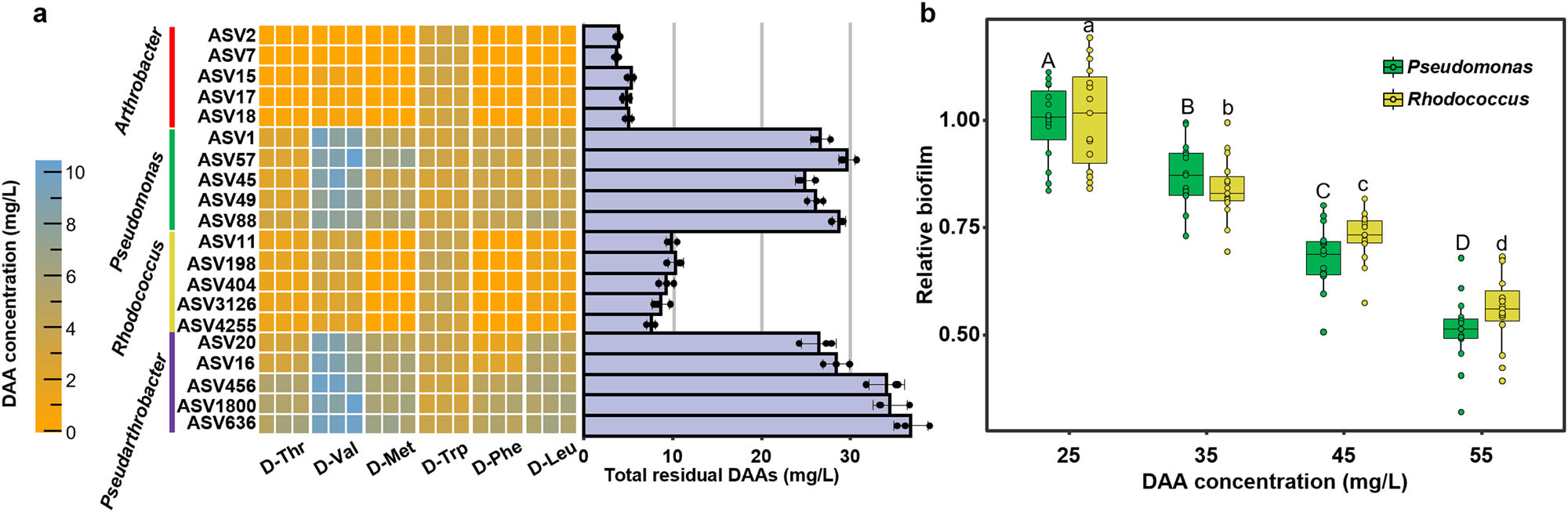
研究结果 1、多孔中生物膜的形成 在微流控装置中接种从土壤中获取的复杂微生物群落,然后加入ISEM培养基。生物膜的发育始于微柱阵列上形成的小微生物菌落。生长72 h后,生物膜开始覆盖微柱表面,并向孔隙空间延伸,最终堵塞多孔载体的通道(图1b)。72h后生物膜粗糙度显著增加(图1c)。粗糙度的增加,通常表明成熟生物膜的形成,扩大了液-生物膜界面,允许营养物质有效地向生物膜传递。qPCR定量结果显示浮游细胞和生物膜细胞在微流控室中的生长曲线都遵循logistic生长模式,在孵育结束时达到平台期(图1d)。除前24 h外,生物膜细胞数量均明显高于浮游细胞数量。 图1 | 生物膜形成过程。(a)模拟多孔环境的微流体装置示意图。微生物群落组成通过16S rRNA基因扩增子测序获取。流出物进行外代谢组学分析;(b)多孔环境中生物膜结构的发展。生物膜细胞用SYTO 9染色(绿色)。比例尺长度代表50μm。实验在四个独立的微流控芯片上重复,结果相似;(c)生物膜厚度和粗糙度的动态变化(n = 4个芯片× 15粒)。生物膜粗糙度计算为单个颗粒表面生物膜厚度的标准差。数据以平均值±标准差表示;(d)采用qPCR法测定微流控室浮游生物和生物膜细胞的数量(n = 4个芯片)。实线显示浮游细胞的比例随着生物膜发育的增加而减少。数据以平均值±标准差表示。 2、多孔载体上微生物的群落演替 为了研究生物膜发育过程中的群落演替,采用16S rRNA基因扩增子测序技术对微流控芯片内的总微生物群落动态进行了监测。随着生物膜形成,同一培养时间下总微生物群落的Bray-Curtis差异减小(图2a)。在初始阶段,群落多样性和丰富度明显下降。在成熟生物膜发育(>72 h)后,群落接近稳定状态。ASV1(Pseudomonas)和ASV2(Arthrobacter)是整个孵育阶段最丰富的两种ASV,占总reads的76.4%(图2b)。这两种ASV的相对丰度在早期(<48 h)同时增加,但在生物膜成熟后发生变化(图2b)。微生物群落演替是由同质选择驱动的,随着生物膜的发育,其相对重要性从39.5%增加到90.0%以上(图2c)。在属水平上,Pseudomonas对群落演替的贡献最大,其次是Arthrobacter,在早期(≤48 h)的演替贡献率超过15%(图2d)。这些结果表明,Pseudomonas和Arthrobacter是形成群落结构的关键类群。 图2 | 生物膜形成过程中的空间生态位划分。(a)微生物群落Bray-Curtis差异值随着培养时间下降(two-sided Pearson r = −0.754, p = 4.69×10−11),实线表示线性回归,灰色阴影表示95%置信区间;(b)前20的ASV在总微生物群落中的相对丰度(占总reads数的86.3%)。线的颜色对应于右边图例中的不同ASV。实线表示平均值,阴影表示三个生物重复的标准差;(c)不同生态过程在生物膜群落组装中的相对重要性,包括同质选择(HoS)、异质选择(HeS)、同质扩散(HD)、扩散(DL)和漂变(DR)。数据以确定性过程和随机性过程相对重要性的平均值±标准差表示。不同字母表示差异显著(p < 0.05,单因素方差分析);(d)不同属对群落演替的相对贡献。列的颜色是基于分类(右侧的分类图例);e微流控室生物膜的FISH图像。该生物膜同时与Arthrobacter (ART179-Alexa546,红色)和Pseudomonas(PSE227-Alexa488,绿色)探针杂交。生物膜细胞用DAPI染色(蓝色)。根据绿色和红色荧光细胞的面积(n = 4个芯片× 15个微柱)计算Pseudomonas和Arthrobacter在生物膜中的比例。数据以平均值±标准差表示。比例尺长度代表50μm。 3、生物膜形成早期的空间分离 属特异性探针在微流控芯片上进行FISH原位杂交分析结果显示,12 h时,检测到少量的Pseudomonas和Arthrobacter,并且大多数仍留在浮游群落中(图2e)。值得注意的是,在36 h时,Pseudomonas在生物膜中的比例增加到70.7±14.2%。在此期间,其在浮游群落中的相对丰度同时从68.4±5.2%下降到18.5±8.6%(图2e)。基于qPCR和扩增子测序分析(图1d, 2b),12 h时,微流控室中有19.5±12.7%的Pseudomonas栖息在生物膜上,36 h时,这一比例进一步上升至97.3±10.0%。固定化Pseudomonas细胞比例的增加表明,Pseudomonas在生物膜发育早期经历了从浮游到生物膜形成的转变。相反,在生长36 h后生物膜中仍然很少观察到Arthrobacter,而其在浮游群落中的比例从15.8±2.3%上升到64.5±10.4%,成为浮游群落中最常见的分类单元(图2e)。自由生活的Arthrobacter和形成生物膜的Pseudomonas分别占据流体和微柱表面环境。在后期,观察到密集排列的Pseudomonas生物膜覆盖微柱颗粒和孔隙空间。96 h时Pseudomonas在生物膜中的比例增加到84.5±12.3%(图2e)。浮游生物群落主要由从生物膜群落中分散出来的细菌组成,主要由Pseudomonas、Rhodococcus和Lysinibacillus组成。鉴于相对丰度同时增加(图2b),研究者假设Pseudomonas和Arthrobacter之间潜在的积极相互作用诱导了空间分离。 图3 | ISEM培养基中个体生长性能与两两相互作用。(a)ISEM培养基中Arthrobacter菌株与其他3属分离株的个体生长和两两共培养相互作用。个体浮游生物的生长用OD600来衡量。结晶紫染色后用OD590定量生物膜产率。根据共培养中各成员单株生物膜产量的最小值(Ymin)、平均值(Yave)、最大值(Ymax)和总和(Ysum)以及共培养生物膜产量(Yco),两两相互作用可分为正相互作用(Yco > Ysum)、强负相互作用(Yco < Ymin)或弱负相互作用(Ysum≥Yco≥Ymin);(b) ASV1 P. fluorescens与ASV2 A. ramosus共培养中生物膜形成相关基因的关键差异表达。括号中的数字表示具有相同功能的差异表达基因的数量;浮游的Arthrobacter(c)与形成生物膜的分离菌株(d)在条件培养基中的相互作用。根据条件培养基(Yc)和非条件培养基(Yu)中生物膜或浮游生物的生长情况,相互作用可分为正相互作用(Yc≥Yu)、弱负相互作用(1 > Yc/Yu≥0.5)和强负相互作用(Yc/ Yu < 0.5)。 4、个体生长和成对相互作用表明Arthrobacter诱导生物膜的形成 研究者对从微流控芯片中分离的细菌菌株的个体生长性能和成对共培养下的相互作用进行了分析,以弄清空间分离的潜在机制(图3a)。从4个属中筛选出20个丰度最高的分离株(图3a)。尽管所有分离株在ISEM培养基中都表现出明显的浮游生长,但Arthrobacter菌株表现出最小的生物膜形成能力(图3a)。这表明,在生物膜生长的后期,Arthrobacter的消失是由于其在生物膜形成方面的能力匮乏,以及在ISEM持续冲洗的情况下无法永久定植。大多数Arthrobacter菌株与形成生物膜的Pseudomonas和Rhodococcus之间的属间相互作用是正向的(图3a)。 对其中两个共培养组合进行基因组学和转录组学分析,以揭示种间相互作用中的转录应答。与ASV2(A. ramosus)共培养可诱导ASV1(P. fluorescens)和ASV11(R. erythropolis)部分基因/代谢途径上调、ASV1的生物膜形成相关基因高表达(图3b)等。此外,ASV1负责合成环境合作产物的基因,如铁载体和电子穿梭体(核黄素(RF)、黄素单核苷酸(FMN)和黄素腺嘌呤二核苷酸(FAD))的基因显著上调(图3b)。 通过在条件培养基(新鲜ISEM和培养Arthrobacter 48h后的ISME培养基上清液以1:1的比例混合制备)中培养形成生物膜的分离株(图3c),进一步验证自由生活的Arthrobacter的外代谢物可以通过促进生物膜的形成来诱导空间分离,同时生物膜微生物通过公共代谢产物的生产来提高Arthrobacter在浮游群落中的适应性。 图4 | 群落组装期间的外代谢产物池动态。(a)总微生物群组成非度量多维尺度分析(NMDS)图与代谢组NMDS图的Procrustes旋转(Procrustes correlation = 0.72, p = 0.001)。(b)ASV(在微流控芯片整体微生物群落中相对丰度>0.1%和氨基酸之间的相关性)。只有满足要求的结果展示( Spearman’s rank correlation coefficients |r| ≥ 0.5, ***p ≤ 0.001, **p ≤ 0.01, *p ≤ 0.05)。(c)总氨基酸在上清液中的累积(n=3个芯片)。(d) DAA在生物膜形成过程中呈现“v”型动态(n=3个芯片)。阴影区域表示三个生物学重复的标准差。 5、d -氨基酸(DAA)的消耗会引发空间分离 通过非靶向代谢组学分析微流控芯片流出物中细胞外代谢物的动态,以解析胞外代谢物如何驱动的空间分离。微流控芯片中的外代谢产物与总群落组成之间存在强烈且高度显著的相关性(图4a),Arthrobacter和Pseudomonas在氨基酸代谢中起着不同的作用(图4b)。同时,D型氨基酸(DAAs)的消耗与Arthrobacter的生长一致,表明Arthrobacter在DAA消耗中可能起作用(图4d)。由于已知DAA通过抑制初始附着、EPS产生和群体感应来抑制生物膜的形成,研究者认为DAA的消耗是触发空间分离的核心代谢特征。 6、Arthrobacter通过DAA水解诱导生物膜形成 分离菌株在ISEM中培养,考察其对DAA的去除能力。ISEM初始DAA浓度为44.1 mg/L。Arthrobacter菌株表现出较强的DAA去除能力(图5a)、随着DAA浓度的降低,条件培养基中Pseudomonas和Rhodococcus的生物膜形成比在ISEM中增强(图3c, 5b)等结果有力地支持Arthrobacter通过去除生物膜抑制剂DAA来诱导空间分离这一假设。 图5 | DAAs对生物膜形成的抑制作用。(a)每个分离株生长48 h后ISEM中的DAAs残留量(n = 3个生物学独立重复)。条形图显示了培养中的总残留DAA。数据以平均值±标准差表示。(b)不同DAAs水平的条件培养基(每属5株× 3个重复)的相对生物膜形成情况。每个分离株的生物膜生物量(用OD590表示)与在含25 mg/L d -氨基酸的条件培养基中形成的生物膜生物量归一化。不同字母表示差异显著(p < 0.05,one-way ANOVA)。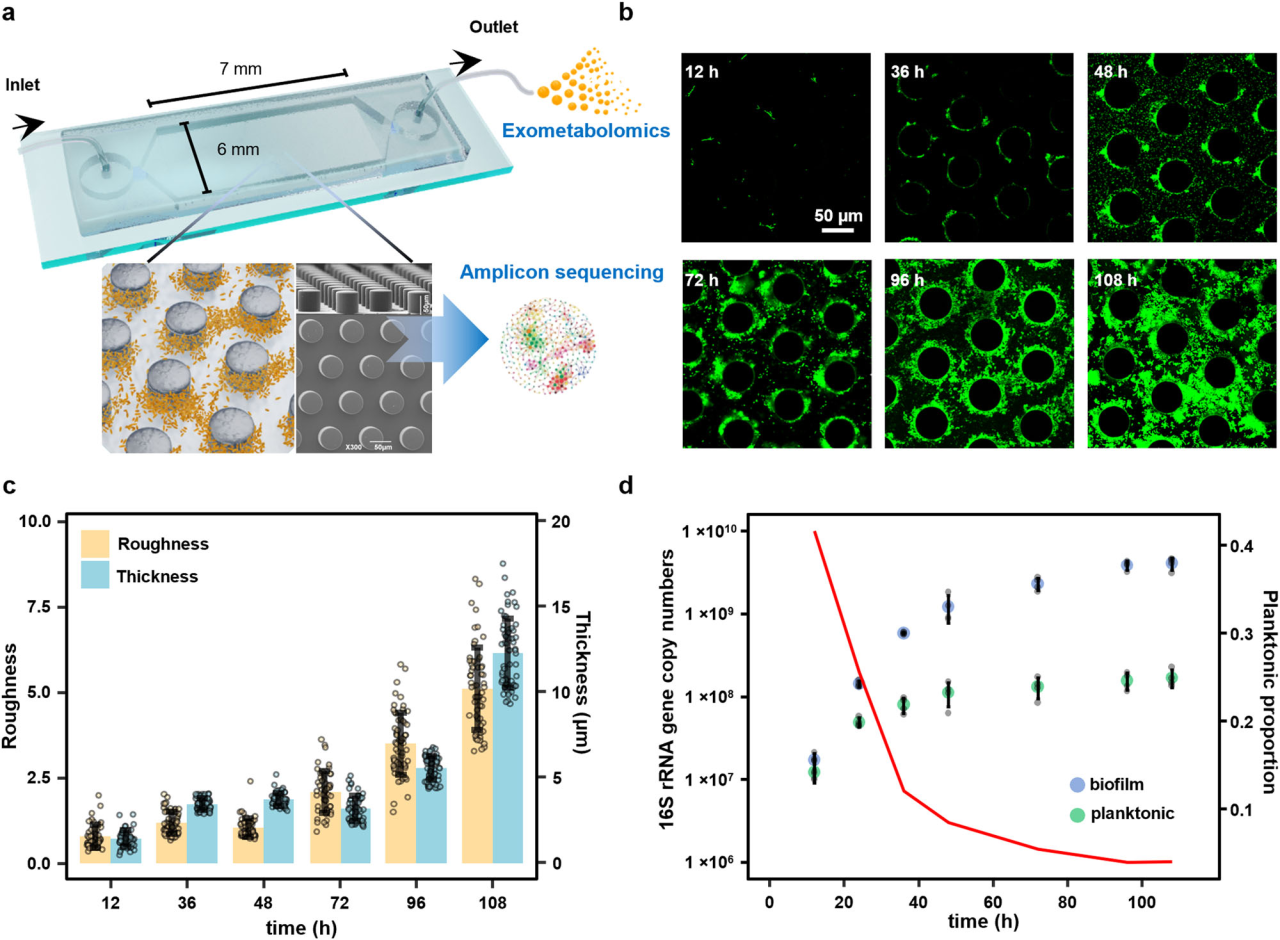

研究结论 孔隙环境中浮游微生物与生物膜之间的相互作用会促使微生物群落空间分化。本研究证明了生物膜形成能力较弱的Arthrobacter通过去除生物膜形成抑制分子D型氨基酸,促进Pseudomonas在固相表面定植形成生物膜。同时,生物膜在形成过程中分泌的公共代谢产物,则会提高Arthrobacter在流体环境中的生长与繁殖。这种互惠型合作关系促使Arthrobacter与Pseudomonas能够在群落定植初期分别快速占据流体环境和固相表面,进而诱导孔隙环境中微生物群落的空间组装与分布。上述研究结果为土壤和沉积物等孔隙环境中微生物群落的组装和演替提供了新的见解。
文章索引 Wu, Y., Fu, C., Peacock, C.L. et al. Cooperative microbial interactions drive spatial segregation in porous environments. Nat Commun 14, 4226 (2023). https://doi.org/10.1038/s41467-023-39991-4