
2023-10-17

《Small》
影响因子:13.3
文章题目:Covalently Grafted Biomimetic Matrix Reconstructs the Regenerative Microenvironment of the Porous Gradient Polycaprolactone Scaffold to Accelerate Bone Remodeling
四川大学生物材料国家工程研究中心在《Small》上发表了仿生基质重构3D打印梯度多孔支架再生微环境加速骨再生的研究成果。本研究中蛋白组检测及部分数据分析工作由上海派森诺生物科技股份有限公司完成。
一、研究背景
天然骨组织的微观结构中,坚实的无机成分(羟基磷灰石)主要负责支撑、保护和承重,而柔软的有机成分(胶原纤维,多糖)在干细胞的增殖和迁移中起着重要作用。因此,有效地模拟天然骨软硬结合的杂化的结构与功能,有助于调控干细胞命运来改善骨再生进程。3D打印技术可以用于组织工程支架结构的精确控制,特别是创建有序孔隙和用户自定义结构,被广泛应用于组织工程领域。然而,目前以PCL,PLA等为主的挤出式3D打印支架难以提供组织重塑过程中长期稳定的营养供给,同时其表面缺乏活性配体,这会导致无效的细胞粘附和下游细胞事件,难以模拟骨组织再生过程所需的生理微环境。因此寻找理想的骨再生性植入物仍然是临床上一个持续的挑战。
二、技术路线
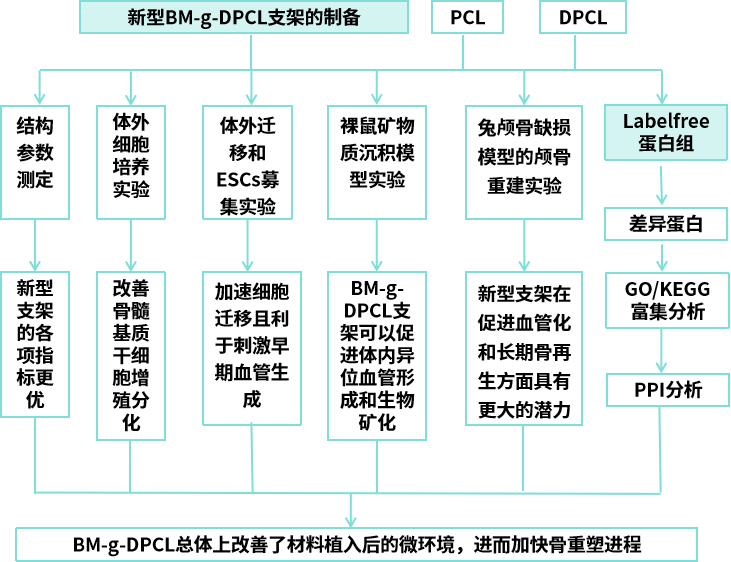
三、研究内容
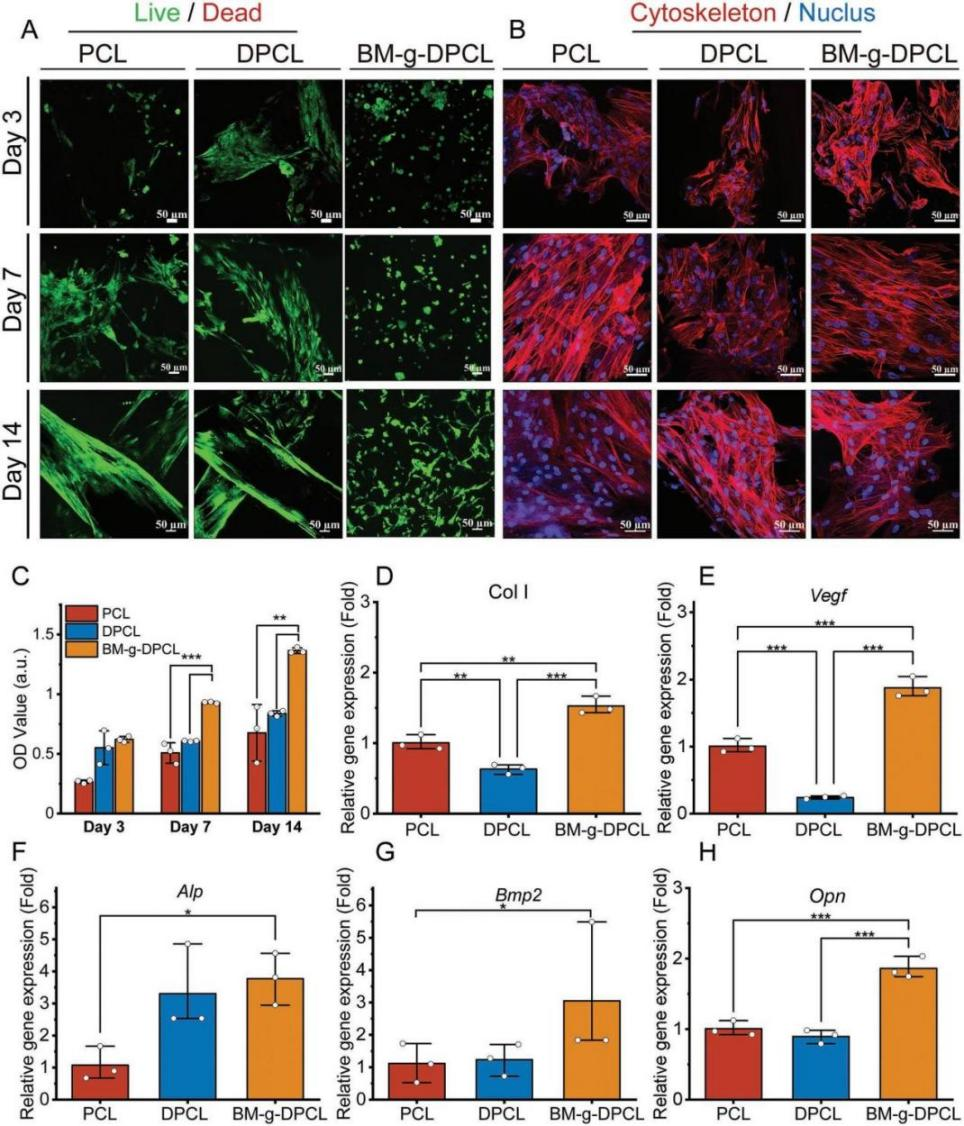
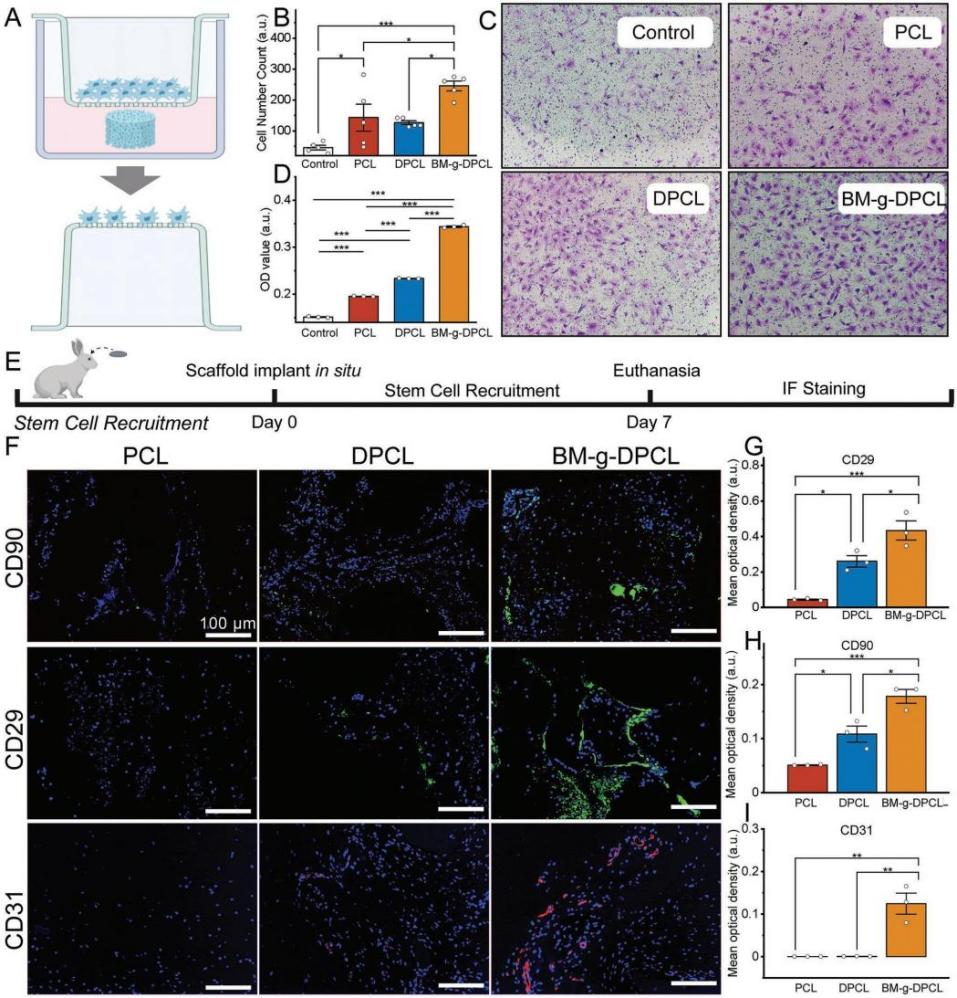
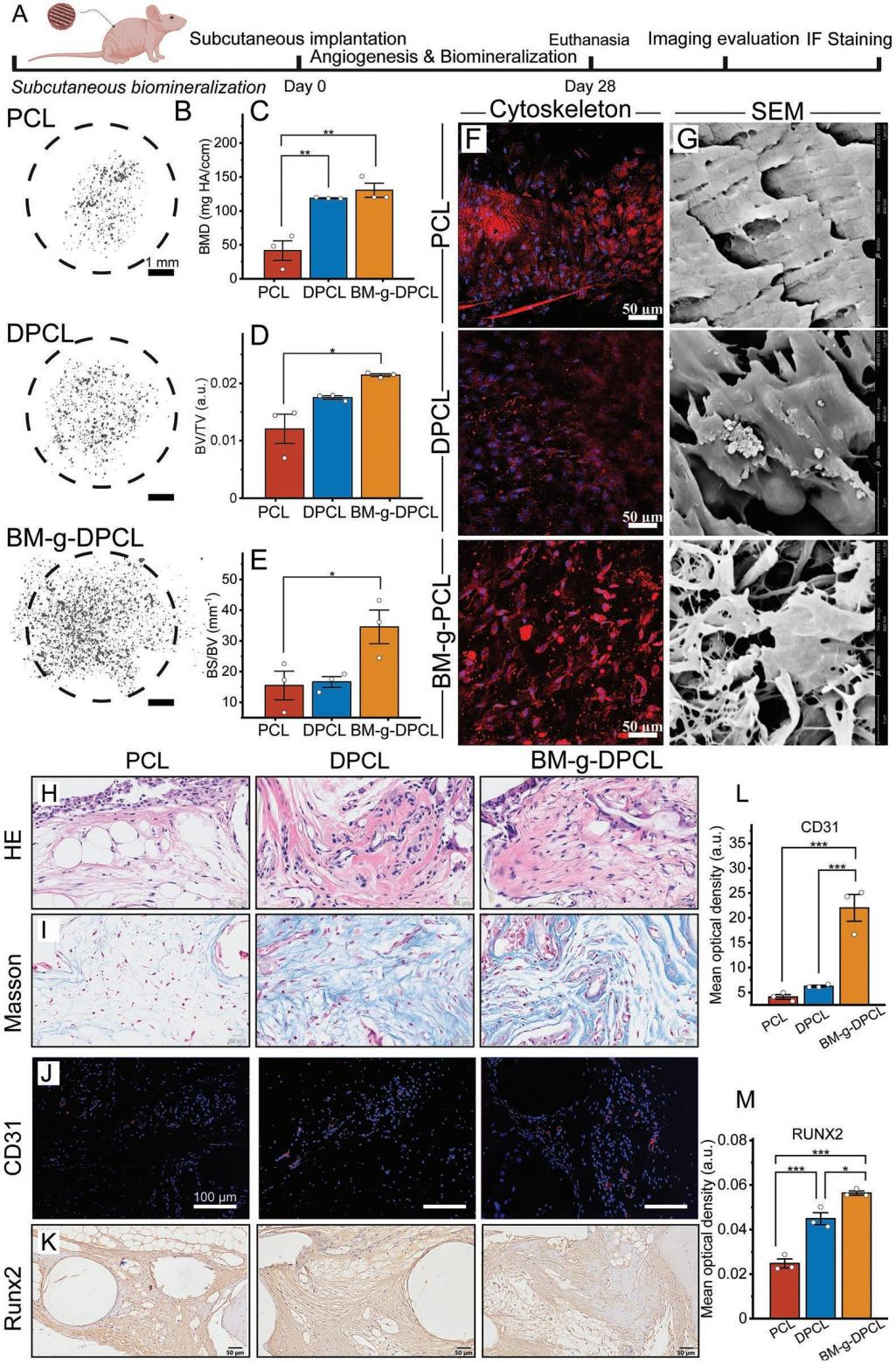
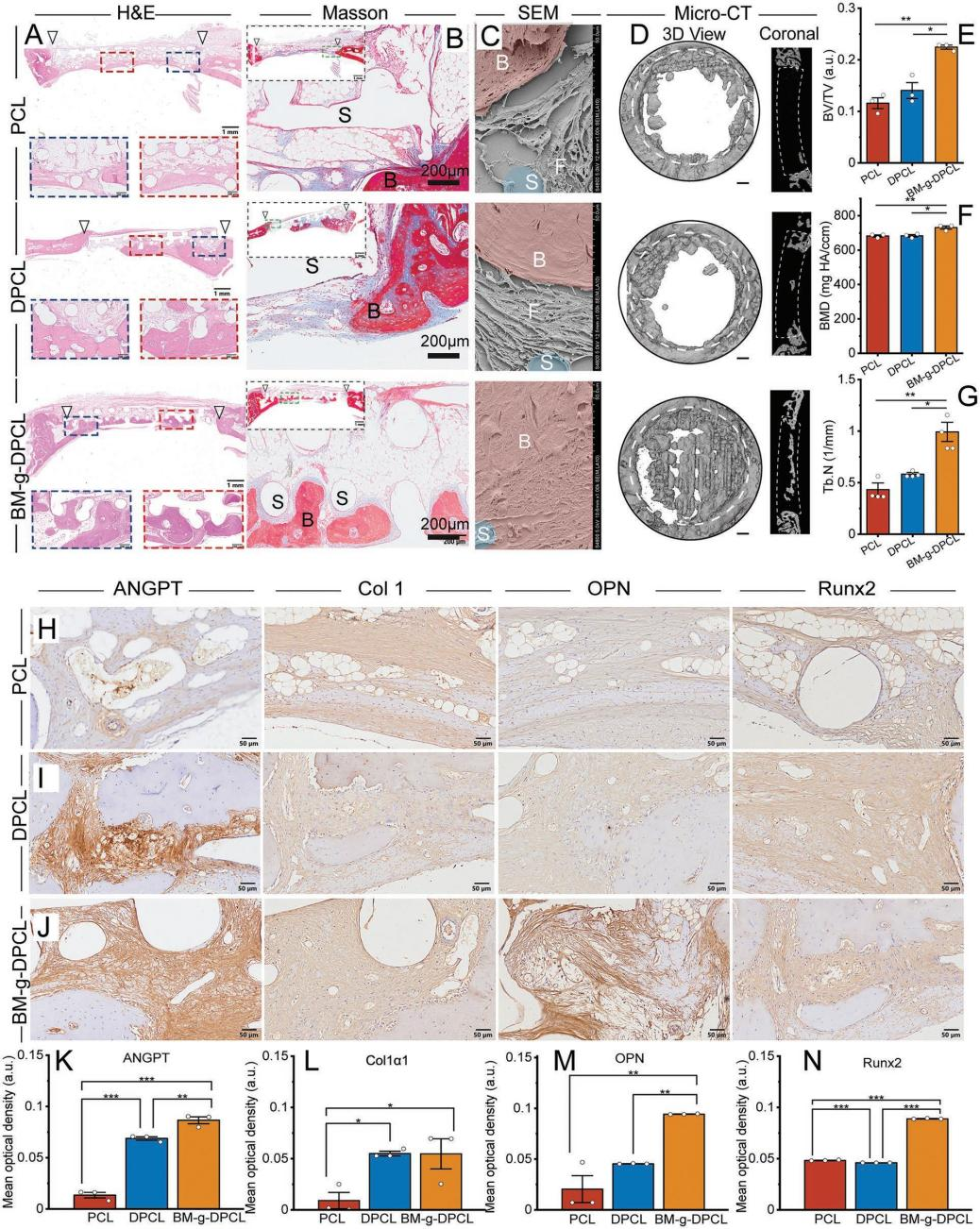
仿生基质修饰多巴胺涂层3DP梯度PCL支架的制备与表征 利用多巴胺介导的化学整合,将仿生胞外基质凝胶修饰在聚多巴胺涂层的3D打印PCL支架中,构建了软-硬结合的活性骨修复体(BM-g-DPCL,图1A)。采用原子力显微镜(AFM)和扫描电镜(SEM)测量了表面形貌和粗糙度,发现DPCL表面粗糙度和表面高度均高于未涂层支架(图1B-D),而PCL的水接触角显著高于DPCL(图1E)。DPCL的亲水性和粗糙的表面可能促进细胞和蛋白质的粘附。此外,DPCL纤维表面的PDA颗粒也显著促进了钙离子的螯合作用,并呈现出更强烈的绿色荧光,暗示潜在的矿物沉积能力(图1F-I)。热重分析曲线和差示扫描量热分析结果(图1J-L)显示,BM-g-DPCL的最高变性温度为402℃,相对而言,PCL为338℃,DPCL为345℃,说明儿茶酚诱导的多重键合反应增强了支架的热稳定性。此外,生物活性基质约占BM-g-DPCL总重量的22%。低倍镜下PCL和DPCL支架的显微结构无明显差异(图1M-N)。然而,BM-g-DPCL支架的孔隙结构特征发生了明显变化。胶原纤维和多糖透明质酸形成了大量的微孔(多为100-200µm,图1O),这些微孔均匀分布在整个3d打印支架中,以高度仿生的软硬结构构建骨修复体。 图1BM-g-DPCL支架的制备与表征 支架对骨髓基质干细胞增殖分化的影响 共培养3、7和14天后,分别进行活/死染色和细胞骨架染色(图2A-B),以评估细胞存活状态和形态。根据激光扫描共聚焦显微镜(CLSM)的活/死染色图像,支架中几乎没有可见的死细胞,表明支架与rBMSCs具有良好的生物相容性。由于只有支架的内部纤维能够提供粘附位点,因此在14 d后,PCL和DPCL支架也可以看到明显的定向生长以及内部纤维的生长,说明BM-gDPCL为细胞生长提供了优越的微环境。细胞骨架染色证实所有支架均支持细胞的扩散。 CCK-8检测(图2C)结果显示,与PCL相比,在BM-g-DPCL中引入PDA涂层和生物活性水凝胶增强了rBMSCs的粘附和增殖。21天后,定量测量成骨(Ocn、Alp、Opn和Bmp2)和基质重塑相关(Col I和Vegf)基因的表达(图2D-H)。BM-g-DPCL的基因表达水平高于DPCL和PCL。这些结果表明,BM-g-DPCL支架可以改善rBMSCs的增殖、血管生成和成骨分化以及特异性基质分泌。 图2 体外细胞的增殖和分化 仿生基质加速rBMSCs体外迁移和体内内源性干细胞(ESCs)募集 通过跨孔模型证实支架对rBMSCs体外迁移行为的影响(图3A)。结果表明,BM-g-DPCL组比DPCL和PCL组有更多的rBMSCs向trans-well的下腔迁移。半定量分析显示,各处理组均促进了细胞迁移,且迁移细胞数量呈增加趋势(BM-g-DPCL > DPCL > PCL > BK,图3B,C)。醋酸溶解结晶紫在570 nm处的定量OD值证实了这一结果(图3D)。rBMSCs迁移行为的改善可能是由于多酚或水凝胶吸附了功能蛋白或因子。 7天后提取体内植入支架,以评估家兔颅骨缺损部位内源性干细胞(ESCs)的募集情况(图3E)。所有的干细胞标记物(CD29和CD90,图3F)在BM-gDPCL组中均有显著的阳性表达,而在PCL支架中几乎没有可见的干细胞,说明BM-g-DPCL支架可以刺激ESCs向缺陷区迁移。平均光密度(图3G-H)证实了最强的荧光发生在BM-g-DPCL组。同时,CD31可见阳性染色(图3F)证实了血管生长,ImageJ的半定量荧光强度分析显示了BM-g-DPCL的最佳特征(图3I)。简而言之,BM-g-DPCL支架可以招募ESCs到缺陷部位,并刺激早期血管生成。 图3 干细胞在体内的迁移和体外的募集 异位裸鼠模型中矿物质加速沉积 生物材料皮下植入为材料内部细胞的生长提供了适宜的微环境和丰富的营养供应,保证了在明确的影响因素下,材料诱导成骨细胞分化和干细胞矿化沉积的效果得以显现。在这里,使用皮下植入物来评估28天后BALB/c裸鼠体内异位矿化和血管生成的潜力(图4A)。通过微型计算机断层扫描(CT)在BM-g-DPCL支架上沉积了最明显的骨基质(图4B),骨矿物质密度(BMD)、骨体积/组织体积(BV /TV)和骨表面积与组织体积比(BS/TV)参数证实了这种最佳的生物矿化沉积趋势(图4C-E)。与相对简单的圆形细胞分布相反,CLSM显示DPCL和BM-gDPCL存在不同程度的交织纺锤状形态(图4F)。SEM图(图4G)显示纤维与基质交织的类骨磷灰石沉积较多(BM-g-DPCL > DPCL > PCL)。HE和Masson三色染色(图4H-I)显示BM-g-DPCL和DPCL支架含有细胞(HE中紫色点)和骨基质(蓝色纤维),表明细胞增殖和生物矿化增强。CD31免疫染色的图像和半定量结果(图4J-L)存在显著差异。与PCL和DPCL支架相比,BM-g-DPCL支架中出现的新生血管数量更多。Runx2免疫染色也显示,移植细胞促进了所有组的骨形成,尤其是BM-g-DPCL支架(图4K-M)。综上所述,这些结果表明BM-g-DPCL支架可以促进体内异位血管形成和生物矿化。 图4 裸鼠模型皮下植入各种支架后异位矿物沉积 支架内源性骨再生修复兔颅骨缺损 HE和Masson染色显示,BM-g-DPCL组植入12周后,支架底部形成明显连续完整的骨结构薄层(图5A)。而PCL组和DPCL组仅修复了一小部分缺损体积。与BM-g-DPCL致密的再生界面相比,PCL和DPCL均存在宿主骨组织与支架之间的纤维组织,阻碍了骨组织的生长(图5B、C)。 定量结果显示,BM-gDPCL组骨体积/组织体积(BV /TV, 22.5±0.69%)显著高于PCL和DPCL组(图5D-E)。此外,BM-g-DPCL组也显示出最好的骨形态学参数(图5F-G),与上述HE和Masson染色结果一致,免疫组化染色图像(图5H-J)也均有证实,Image J显示BM-g-DPCL组血管生成和成骨相关蛋白ANGPT、ColI、OPN和Runx2表达增强(图5K-N)。这些结果表明BM-g-DPCL支架在促进血管化和长期骨再生方面具有更大的潜力。 图5 线粒体呼吸链复合物I(A)、II(B)、III(C)、IV(D)和V(E)的酶活性测定 差异表达蛋白的比较揭示成骨分化机制 为了在蛋白质组学水平上了解不同支架在加速成骨过程中的作用,采用非标蛋白质组学方法获得PCL、DPCL和BM-g-DPCL组在12周时的蛋白组成。通过主成分分析、差异表达蛋白维恩图和聚类分析对三组样本进行统计分析。结果表明,蛋白质组学数据可用于进一步分析。接下来,对差异表达蛋白(DEPs)进行火山图分析(图6A-B)。DPCL与PCL相比有519个DEPs上调,137个DEPs下调,BM-g-DPCL与DPCL相比有193个DEPs上调,170个DEPs下调。相对于PCL组,DPCL组显著促进了细胞结合、细胞对氧化应激的反应和醌代谢过程(图6C)。与DPCL组相比,BM-g-DPCL组显著促进了细胞外基质的形成、轴突的发育和细胞结合(图6D)。PDA涂层(图6E)增加了细胞粘附和干细胞发育,并随后增强成骨。BM-gDPCL通过促进细胞粘附、血管生成和潜在的炎症调节来加速成骨(图6F)。 差异蛋白质热图及蛋白质互作网络阐明了这一过程(图G-J)。含有生物活性水凝胶的BM-g-DPCL通过促进血管生成(MMP2、AGT、ITIH3、CSPG4)和细胞外基质(ECM)形成活性(FBLN1、ECM1、ECM2)以及骨重塑(SERPINH1、COL6A2、COL6A3)来促进骨生成。蛋白质组学数据分析与前期实验结果一致,表明BM-g-DPCL组可通过整合类ECM生物活性水凝胶,加速整合素/肽/因子结合募集ESCs,进而促进ECM的构建和形成,进一步促进血管生成和成骨。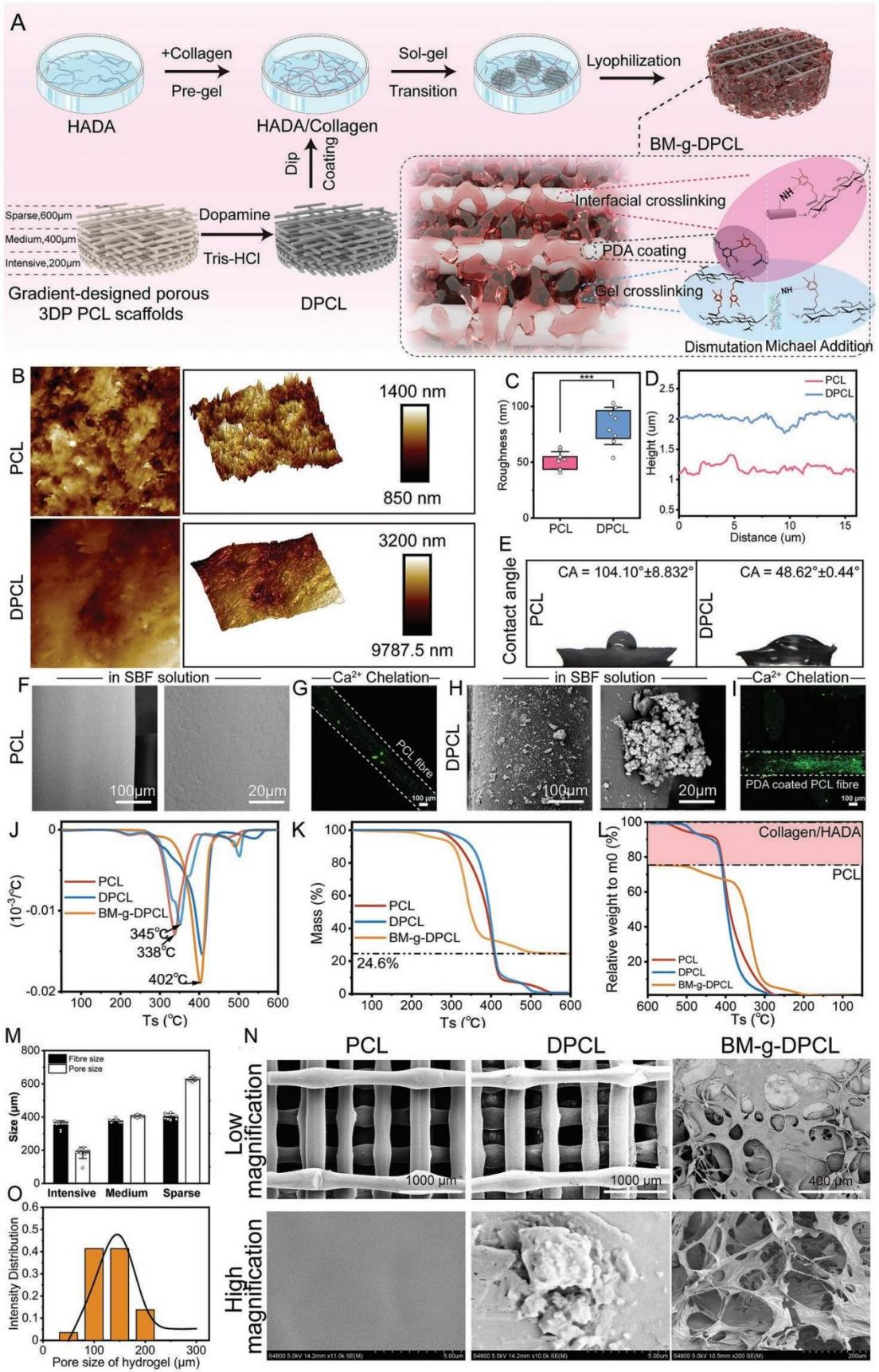
四、研究结论
本研究通过模仿骨基质的软硬结合结构,利用多巴胺介导的仿生细胞外基质锚定聚多巴胺包被的3DP PCL支架(BM-g-DPCL),构建了一种化学键合结构。它促进了干细胞在体外的迁移、增殖和成骨分化,并加速了体内内源性干细胞的募集和快速血管生成。植入后,能在骨组织与种植体之间融合,诱导骨基质沉积。蛋白质组学证实细胞因子粘附、生物矿化、快速血管化和细胞外基质形成是临床尺寸兔颅骨缺损重建满意的主要因素。该策略为无生长因子/细胞骨再生支架提供了一种可选的设计思路。
原文索引: Liu Q, Chen M, Gu P, Tong L, Wang P, Zhu J, Xu Y, Lu G, Luo E, Liang J, Fan Y, Zhang X, Sun Y. Covalently Grafted Biomimetic Matrix Reconstructs the Regenerative Microenvironment of the Porous Gradient Polycaprolactone Scaffold to Accelerate Bone Remodeling. Small. 2023 May;19(19):e2206960.