
2023-12-15

《ACS Nano》
影响因子:17.1
哈尔滨工业大学顾宁教授团队在《ACS Nano》发表题为“Foodborne Carbon Dot Exposure Induces Insulin Resistance through Gut Microbiota Dysbiosis and Damaged Intestinal Mucus Layer”的文章。阐释了慢性碳点(CD)暴露可通过破坏小鼠的肠-肝轴导致葡萄糖代谢紊乱。该研究通过高通量测序分析揭示了,CD暴露降低了有益细菌(Bacteroides、Coprococcus和S24-7)的丰度,增加了有害细菌(Proteobacteria、Oscillospira、Desulfovibrionaceae和Ruminococcaceae)的丰度以及F/B(Firmicutes/Bacteroidetes)比率。通过对比无肠道菌群小鼠和有肠道菌群小鼠可发现,暴露于CD小鼠出现胰岛素抗性的原因在于肠道菌群紊乱和肠道粘液层的破坏。
以上研究的16S rRNA基因测序和部分数据分析工作由上海派森诺生物科技股份有限公司完成。
研究背景
碳点(CD)是一种新兴的碳基纳米材料,其直径通常<10 nm,在许多应用中都展现出了优异的性质。自从发现CD以来,研究主要集中在CD的制备和应用上,而忽略了其潜在的医疗风险。由于食物成分在高温下容易碳化,烹饪过程中会产生食源性CD;在饮料、烘焙食品和烤肉中这一现象尤为普遍。体内和体外研究表明,CD会导致某些不良影响,如细胞活力降低、细胞凋亡、细胞周期中断和代谢应激。尽管如此,暴露于慢性食源性CD与葡萄糖代谢之间的关系仍不清楚。
测序区域
16S rRNA基因 V3V4区
测序平台&分析
Illumina NovaSeq+派森诺基因云
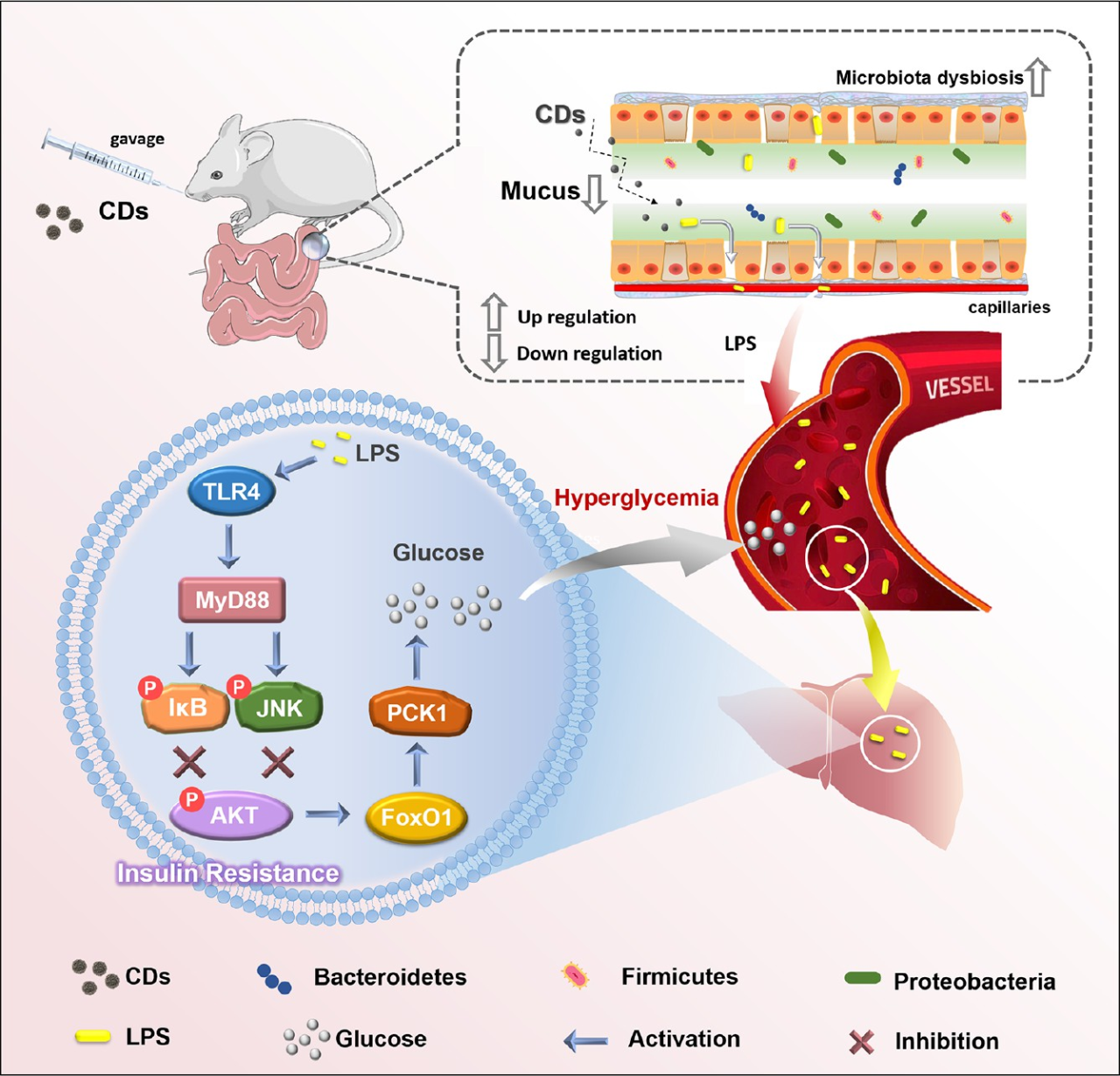
CD暴露通过影响肠道−肝轴破坏糖代谢示意图
研究结果
1.补充益生菌可缓解CDs引起的葡萄糖稳态失衡、肝损伤及肠道菌群失调
在CDs处理14周后,小鼠出现高空腹血糖水平、糖耐量受损以及肝脏受损(肝脂肪变性、肝细胞空泡和肝纤维化锁破裂增加),而补充益生菌的处理(CP组)提示可以恢复CDs引起的葡萄糖稳态失衡及肝损伤。

图1 CD暴露对葡萄糖稳态和肝功能的影响
大量的研究已经表明,肠道微生物群在饮食诱导的Ⅱ型糖尿病(T2DM)中起着重要作用。因此,为了进一步探讨CD对肠道微生物群的影响,作者采用不同处理小鼠结肠内容物进行16S rRNA基因测序。结果显示在门水平上,CD组小鼠中菌群组成发生了明显改变,如Bacteroidetes丰度降低、F/B(Firmicutes/Bacteroidetes)比率增加、Proteobacteria丰度增加和Coprococcus丰度降低等,这些菌群变化提示与全身炎症或代谢综合征相关。值得注意的是,所有CDs诱导的微生物群组成的改变都被膳食益生菌恢复。
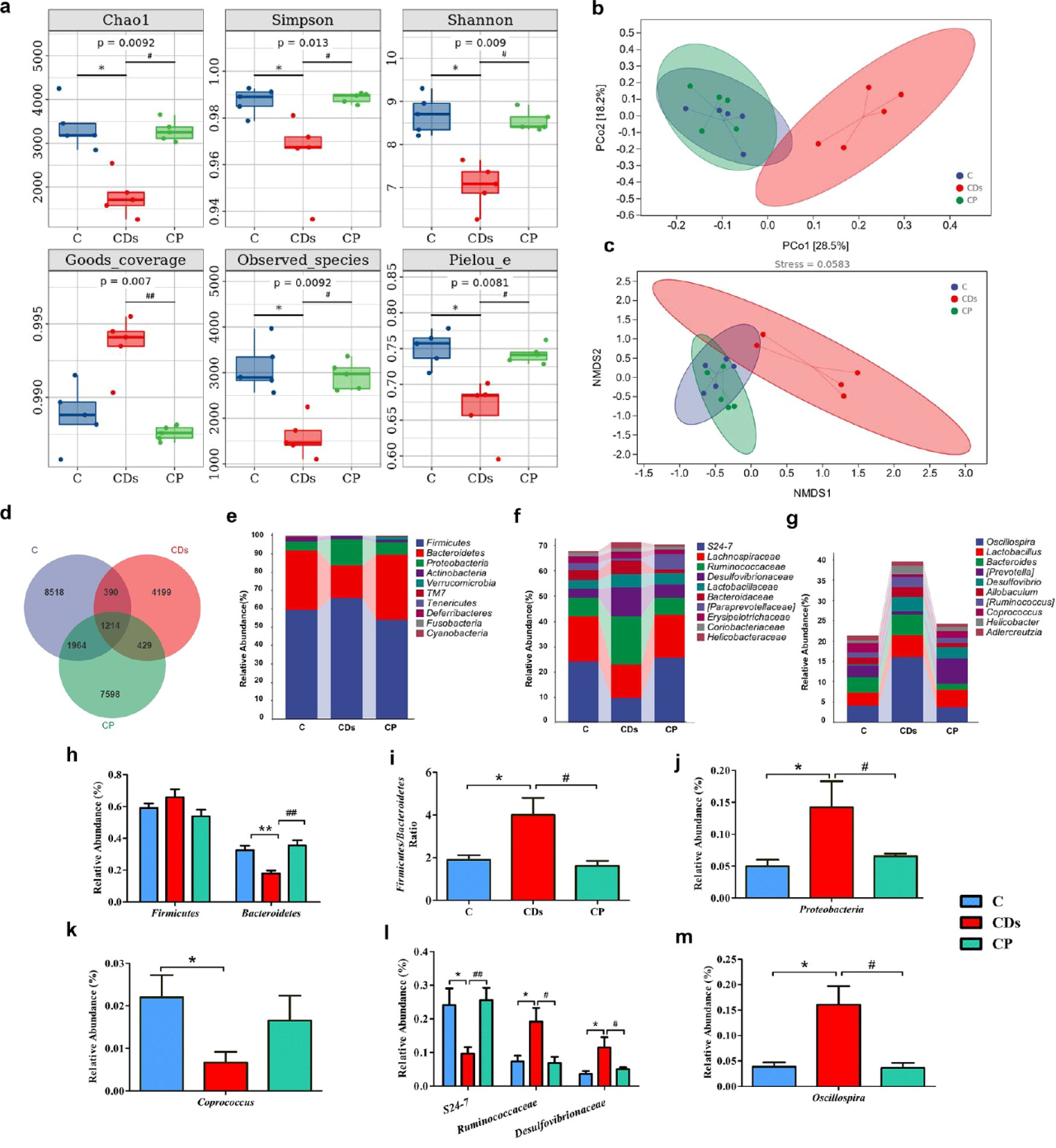
图2 CD处理对肠道微生物群的影响和复杂益生菌的有益作用
2.CDs诱导的肠道菌群失调增加了肠道通透性且引起脂多糖相关的全身炎症
LEfSe分析结果表明,CDs暴露增加了脱硫弧菌科(Desulfovibrionaceae)的丰度,可能引起脂多糖(LPS)水平升高,导致肠道黏液层被破坏。另一方面,结肠长度和隐窝深度是评估肠道炎症的重要指标。研究结果显示,益生菌可以防止CDs诱导的结肠长度缩短,并产生隐窝深度的强烈恢复趋势,促进肠道炎症的衰减。免疫荧光和Western blot结果证实了CD处理小鼠肠道黏液层被破坏。此外,粪便中LPS和硫化氢水平的增加验证了Desulfovibrionaceae的负面影响。进一步在CD组中检测到较高的血清LPS和TNFα,其与LPS易位及全身炎症相关,而膳食益生菌可恢复这些症状。
3.补充益生菌可恢复CD介导的肝脏炎症和胰岛素抵抗
免疫学上,LPS与TLR4结合,激活适配器MyD88,触发NF-κB和MAPK信号通路,从而增加促炎细胞因子的释放。Western blot结果显示,在CD组中,TLR4和MyD88表达水平升高,表明LPS被转移到肝脏并激活了相关的免疫反应。此外,CD处理增加了IκB和p65-NFκB的磷酸化,促进肝脏炎症,并通过磷酸化的JNK和p38进一步激活丝裂原活化蛋白激酶(MAPK)级联反应。此外,CD处理降低了AKT的磷酸化,导致胰岛素抵抗(IR),进而促进FOXO1和PCKI,促进糖异生。然而,补充益生菌几乎使这些生物标志物恢复到正常水平。
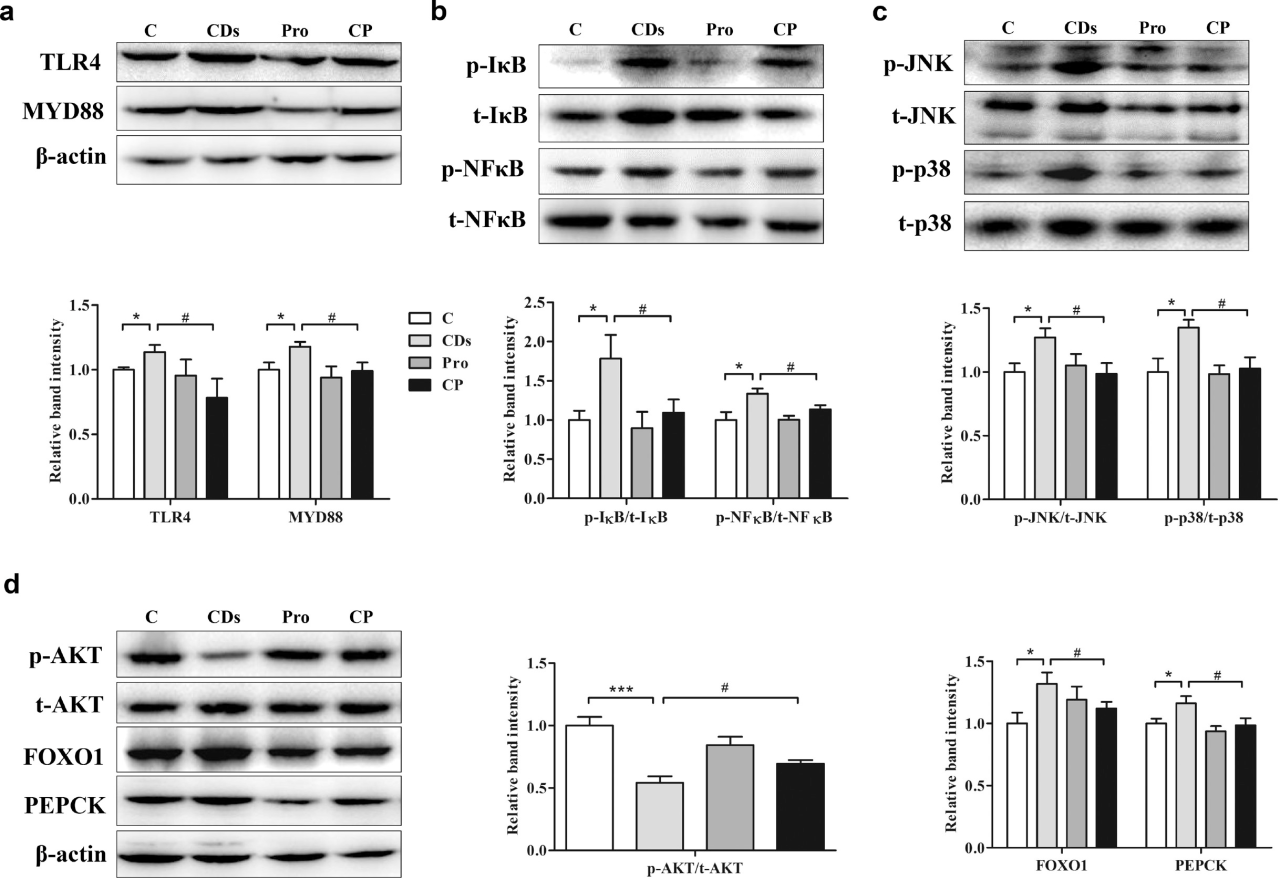
图4 CD暴露对小鼠肝脏中TLR4/NF-κB/MAPK和IR信号转导的影响
4.CD暴露通过影响肠−肝轴破坏糖代谢
采用粪菌移植(FMT)验证CDs通过改变肠道微生物群来诱导小鼠IR。结果表明,FMT-CD组的空腹血浆和葡萄糖耐受不良明显增加,而与FMT-C小鼠相比,空腹体重没有变化。同时,接受CD小鼠肠道微生物群处理的受体小鼠血清、肝指数、肝功能指标均有明显的升高趋势。这些结果表明,葡萄糖代谢紊乱和肝功能损伤与肠道微生物群一起转移到受体小鼠体内。
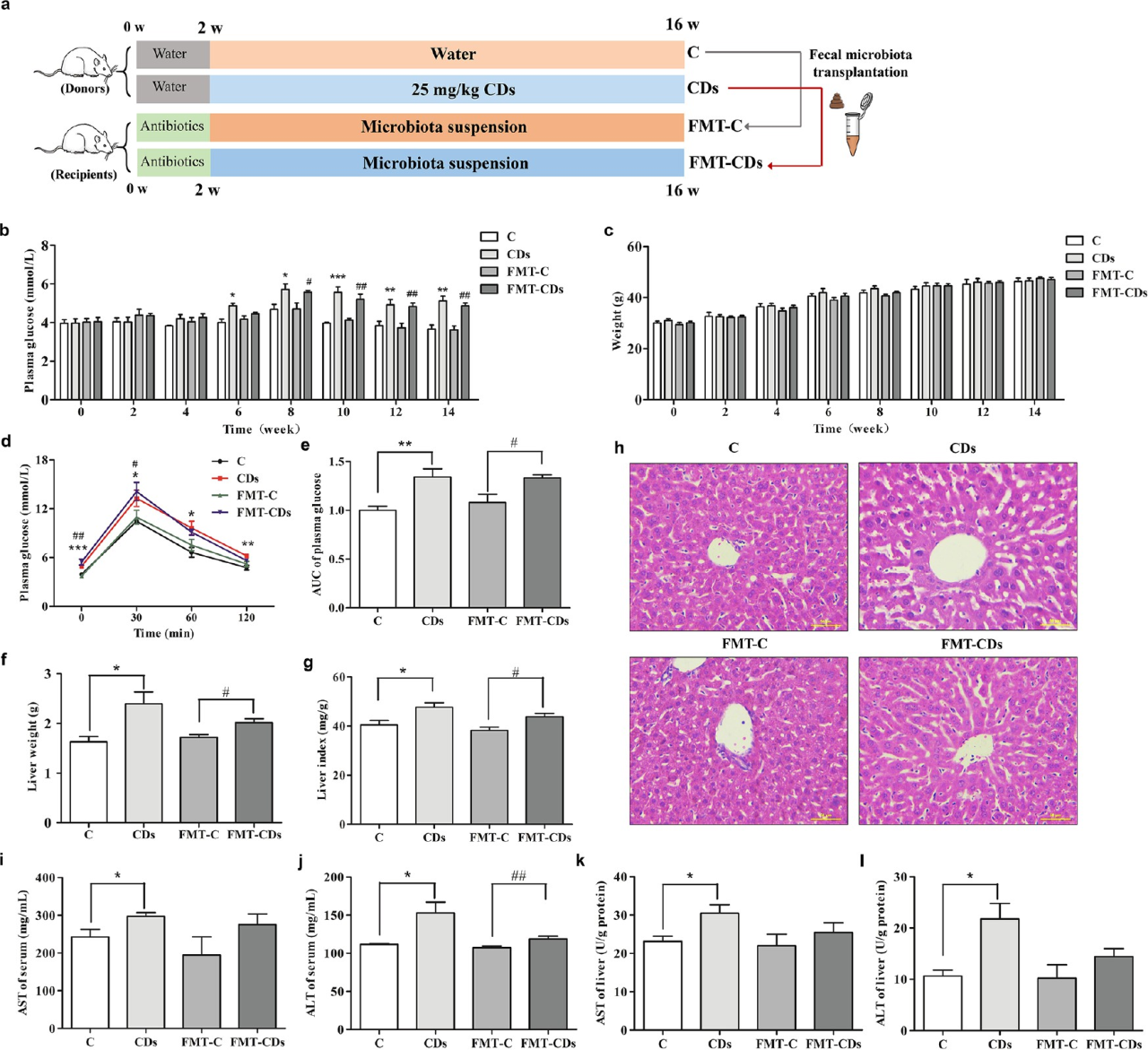
图5 CD暴露小鼠的FMT诱导了受体小鼠的葡萄糖稳态紊乱
接下来,运用16s rRNA基因测序揭示FMT对小鼠肠道菌群的影响。测序结果显示,FMT-C组和FMT-CD组之间的肠道菌群组成存在明显差异。来自CD小鼠的FMT有改变肠道微生物群α多样性的趋势,这与供体小鼠相似。β多样性结果显示,FMT-CD小鼠的肠道微生物群从FMT-C中分离出来。肠道微生物组成分析也显示了两组受体小鼠之间的显著差异。与FMT-C小鼠相比,来自CD小鼠的FMT增加了受体小鼠的肠道屏障通透性,以及与炎症相关的生物学指标水平。然而,暴露于CD的微生物群耗竭小鼠的这些生物标志物水平与微生物群耗竭对照小鼠一致,这表明肠道微生物群失调是导致CD诱导的炎症介导的胰岛素抵抗的原因。
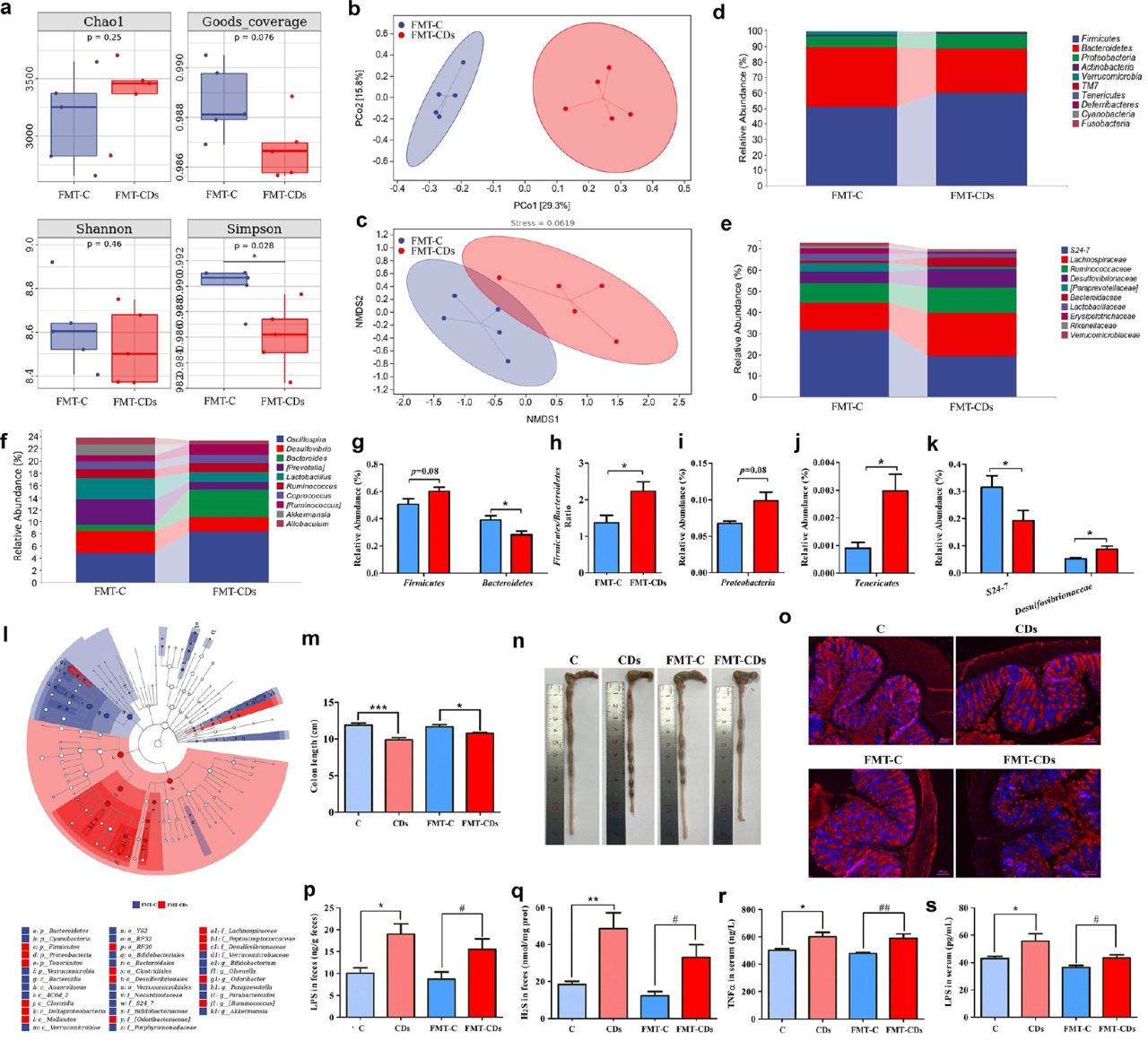
图6 CD暴露小鼠的FMT诱导肠道微生物群失调并使受体小鼠的LPS转移
研究结论
T2DM是一种严重的疾病,尤其是在发展中国家。最近的研究已经表明,饮食诱导的T2DM与肠粘液层、肠道微生物及其相互作用密切相关。上述工作表明,长期口服食源性CD会导致肠道微生物群失调,并破坏肠道屏障,进而导致全身炎症和糖代谢紊乱,益生菌的保护作用则可使其恢复。此外,这些发现支持了改善肠道微生物群作为治疗饮食诱导的T2DM的潜在策略的可能性。
文章索引:Zhang B, Fan X, Du H, et al. Foodborne Carbon Dot Exposure Induces Insulin Resistance through Gut Microbiota Dysbiosis and Damaged Intestinal Mucus Layer. ACS nano, 2023, 17(6): 6081-6094.