
2024-01-17
文章题目:Metabolic engineering of Paenibacillus polymyxa for effective production of 2,3-butanediol from poplar hydrolysate
技术手段:RNA-seq,代谢组学,qPCR
山东农业大学在著名杂志《Bioresource Technology》发表了关于多粘类芽孢杆菌利用杨树原水解液生产2,3-丁二醇的新机制,为多粘类芽孢菌低成本工业化生产2,3-丁二醇奠定了基础。本研究中转录组测序与代谢组检测及部分分析工作均由上海派森诺生物科技股份有限公司完成。
01、研究背景 2,3-丁二醇(2,3-BD)是一种重要的化合物,在可再生能源领域、制药行业和化学合成领域有着广泛的应用。大多数能够产生2,3-丁二醇的菌种都有致病性,然而研究发现,多粘类芽孢杆菌(P. polymyxa)是一种安全的天然细菌,可以有效地产生纯度≥98%的(R, R)-2,3-BD,因此,利用多粘类芽孢杆菌合成2,3-丁二醇的研究越来越受到人们的关注。本研究利用转录组学和代谢组学相结合的方法,鉴定了多粘类芽孢杆菌中葡萄糖衍生的2,3-丁二醇途径及其相关基因,并通过直接敲除或过表达以提高2,3-丁二醇的产量。最后,在添加spo0A的情况下,对多黏类芽孢杆菌株SC2-M1进行了利用杨树原水解液生产2,3-BD的试验,为多粘类芽孢杆菌低成本工业化生产2,3-BD奠定了基础,同时也为利用杨木原料水解物生产可再生燃料提供了一种新方案。
02、技术路线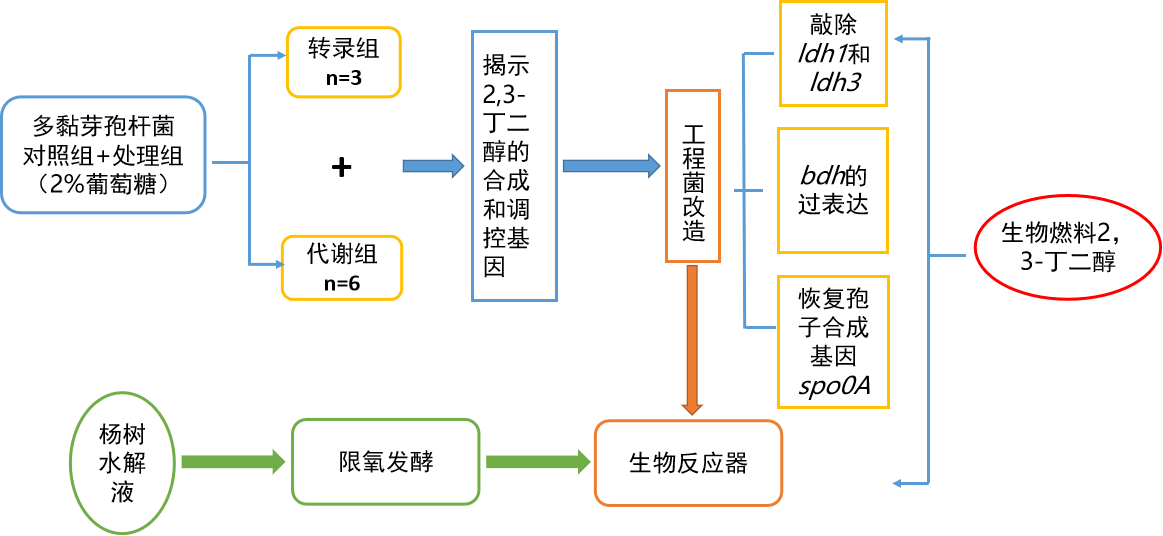
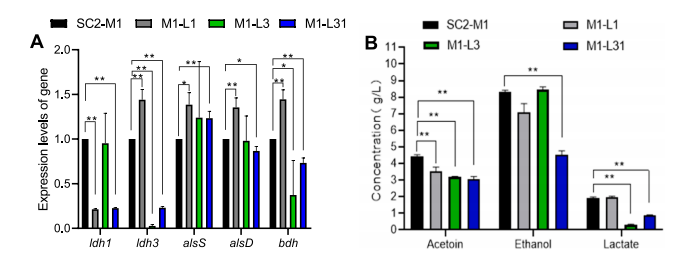
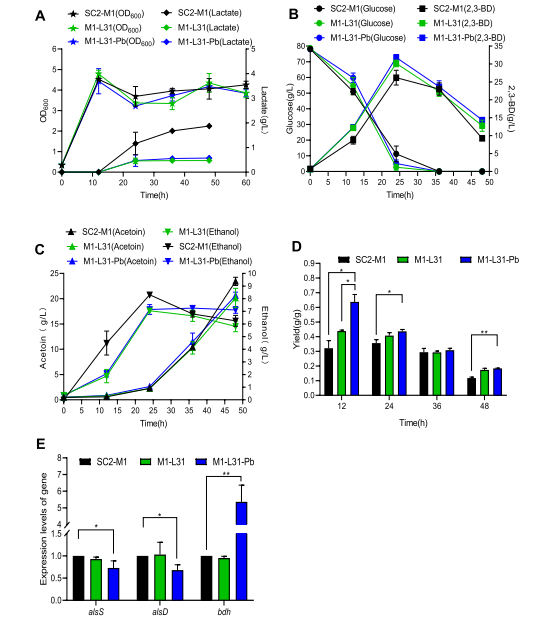
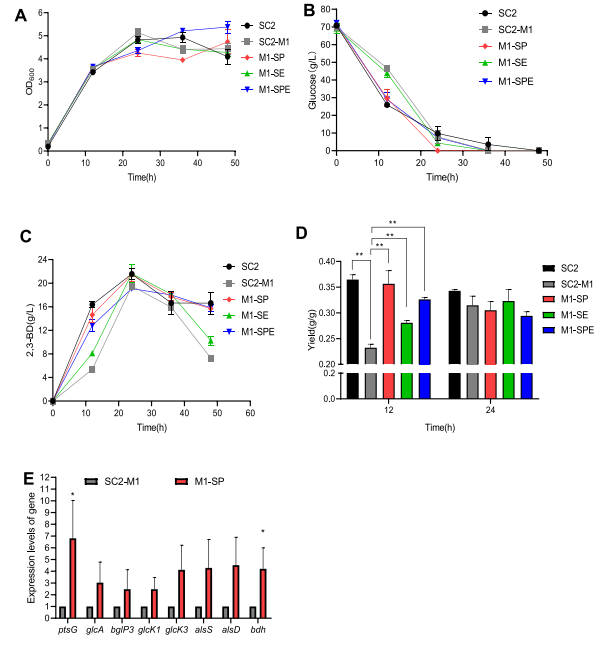
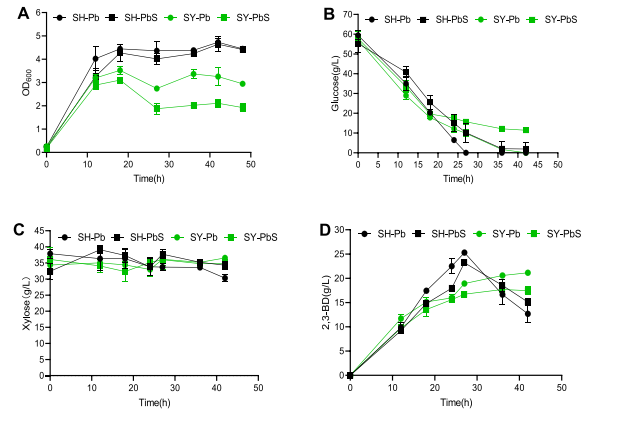
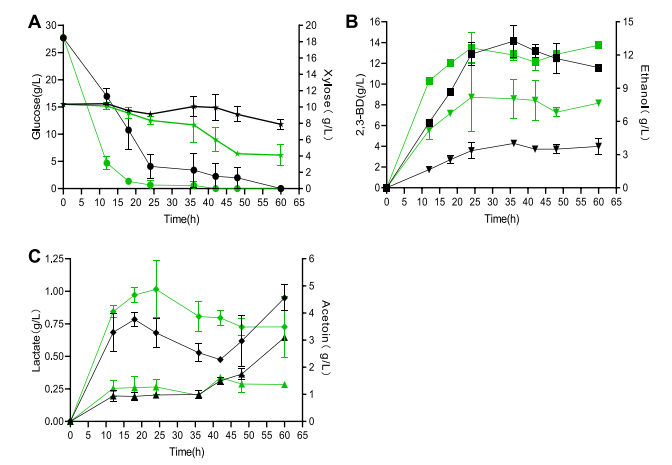
03、研究内容 1.转录组和代谢组联合分析揭示了P. Polymyxa SC2菌株生产2,3-丁二醇的合成和调控基因 将P.polymyxa SC2细胞在含0%葡萄糖(CK)和2%葡萄糖(SC)的LB培养基中培养。选择培养6小时的细胞悬浮液进行转录组和代谢组分析。对转录组和代谢组数据进行KEGG富集分析发现,添加2%葡萄糖后对碳水化合物和能量代谢等通路有显著影响,同时发现,P. polymyxa SC2在葡萄糖代谢、2,3-BD和副产物合成方面的基因发生了差异显著(图1)。值得注意的是,在丙酮酸生成2,3-BD的代谢途径中,编码乙酰乳酸合成酶(alsS)和乙酰乳酸脱羧酶(alsD)的基因转录水平显著上调,而编码丁二醇脱氢酶(bdh)的基因转录水平显著下调。qPCR验证后同样发现bdh下调。分析发现,2,3-BD的合成过程中,有许多副产物如乳酸以及乙酸的产生与限制了编码丁二醇脱氢酶(bdh)的基因的表达,导致2,3-BD的产生受到限制。 图1糖酵解途径、戊糖磷酸途径、三羧酸循环、2,3-BD合成途径及部分副产物的转录调控分析 2.敲除乳酸脱氢酶基因能增加2,3-丁二醇的合成 在以葡萄糖为主要碳源培养P. polymyxa SC2的过程中,除了2,3-BD外,还产生了副产物。乳酸是一个重要的副产物,代谢组结果显示其增加了1.3倍(图1)。在P. polymyxa SC2中鉴定了两个乳酸脱氢酶基因ldh1和ldh3。为了研究这两个基因与乳酸和2,3-BD产生的关系,本研究对这两个基因进行了敲除实验。结果发现,仅敲除ldh3可显著降低乳酸合成,增加2,3- BD产量。然而,ldh1的单一缺失并不影响乳酸的合成,而是促进了2,3-BD的产生,会略微上调ldh3和2,3-BD合成基因alsS、alsD和bdh的表达水平(图2A),ldh1和ldh3共缺失菌株的2,3-BD产量略低于单缺失菌株,但产量较高比原菌株SC2-M1高出21%。此外,乙酰胆碱、乳酸盐和乙醇含量显著降低(图2B)。 图2 ldh1和ldh3基因敲除后菌株合成基因alsS、alsD和bdh的表达水平及代谢物变化 3.基因bdh的过表达进一步促进2,3-丁二醇的合成 转录组结果表明,bdh的下调可能是限制2,3-BD产生的因素之一,为了进一步提高2,3-BD的合成,我们在P. polymyxa M1-L31中过表达bdh基因。得到的菌株P. polymyxa M1-L31- Pb在相对需氧和弱酸性培养条件下生长良好(图3A)。2,3-BD和乙醇合成初期使用葡萄糖作为营养物质(图3B-C),随着介质中的营养物质的消耗,菌株往往将2,3-BD乙偶联,从而形成NADH维持其生理活动(图3C)。过表达bdh菌株M1-L31- Pb的2,3-BD产量比菌株SC2-M1提高了22%,达到最大理论值的87%(图3D)。 图3 多黏芽孢杆菌M1-L31、M1-L31- Pb和SC2-M1在相对好氧和弱酸性培养条件下对葡萄糖的代谢能力 4.孢子形成基因spo0A和spoIIE对多粘芽孢杆菌细胞形态、代谢能力和2,3-丁二醇合成的影响 有研究表明,多粘类芽孢杆菌孢子的形成通常会影响底物的利用效率,延长发酵过程,在P. polymyxa中,敲除spo0A基因以丢失孢子会显著降低2,3-BD的合成。为了探究孢子形成对多粘类芽孢杆菌合成2,3-BD的影响进行了以下研究。我们在葡萄糖以及充足氧气的培养条件下发现,SC2(野生型)、SC2-M1(自然突变型)、M1-SP(spo0A基因恢复型)、M1- SPE(M1-SP菌株敲除spoIIE基因)和M1- SE (菌株SC2-M1中spoIIE基因的单缺失)5株菌株在培养初期表现出相同的生长趋势(图4A)。结果发现,在培养初期恢复菌株M1-SP和M1- SPE的spo0A基因,可大大提高菌株SC2的葡萄糖消耗量(图4B-D)。培养12 h后,SC2和M1-SP的葡萄糖消耗量显著高于菌株SC2-M1,菌株M1- SPE的葡萄糖消耗量显著高于菌株M1-SE。结合转录组学数据推测,恢复spo0A可以增强葡萄糖的跨膜转运,从而增加2,3-BD的产生(图4B)。与菌株SC2-M1相比,与葡萄糖转运相关的亚基基因在菌株M1-SP中显著上调(图4E)。结果表明,spo0A基因的恢复改善了葡萄糖的跨膜转运,提高了细胞内葡萄糖含量,从而提高了2,3- BD的产量。虽然spoIIE的缺失使菌株M1-SPE在培养中后期促进了微生物的生长,但与菌株M1-SP相比,它不利于2,3-BD的合成。 图4 多粘菌SC2、SC2- M1、M1-SP、M1-SE和M1-SPE的代谢能力以及葡萄糖跨膜转运基因的转录水平 5.不同碳源和条件下工程多粘菌合成2,3-丁二醇的特性 培养基中氧的浓度对菌株的生长和发酵产物的合成有显著影响。有研究表明,严格的好氧或厌氧条件不利于2,3- BD的合成。在好氧条件下,M1-L31-Pb和M1-L31-PbS在培养约27 h后均达到2,3-BD的最大产量(图5D)。在限氧条件下,菌株的生长有所下降(图5A),而2,3-BD的合成趋于稳定,2,3-BD的还原量明显减少(图5D),乙醇和乳酸的合成增加,但乳酸含量仍然很低(图5F- G)。综上所述,在好氧培养条件下,P. polymyxa生长较好,2,3-BD产量较高,但2,3-BD在后期容易被菌株分解且副产物浓度显著升高,不利于培养后期2,3-BD的分离纯化。虽然在限氧条件下,菌株的生长速度下降,但相同数量的细胞表现出良好的发酵性能,并且2,3-BD在发酵后期不易分解,副产物浓度低。 图5 多粘菌M1-L31-Pb和M1-L31-PbS在好氧或限氧条件下对葡萄糖和木糖的代谢能力 本研究以杨树的水解液为发酵底物,对工程菌株M1-L31-Pb和M1-L31-PbS在培养基的高密度发酵性能进行了评价。这两种菌株在杨树的原始水解液中生长良好,其发酵性能受不同发酵条件的影响较大。与菌株M1-L31-Pb相比, M1-L31-PbS对葡萄糖和木糖的利用效率和2,3-BD的合成效率更高,但2,3-BD的产量较低。然而,菌株M1-L31-PbS使更多的碳源用于乙醇合成(图6B)。同时,葡萄糖和木糖也提高了菌株M1-L31-PbS的乙醇合成能力。使用杨木水解液的两种工程菌株的2,3-BD产量普遍高于使用纯葡萄糖和木糖的菌株,本研究中使用的工程菌株能产生纤维素酶,并继续分解杨木原水解液中的大分子纤维素,以产生额外的碳源,如葡萄糖,最终达到更高的2,3-BD产量。本研究中,在缺孢菌株SC2-M1中添加Spo0A显著提高了杨树水解液中碳的利用效率,减少了长期发酵造成的碳损失,并阻止了野生型菌株SC2因孢子形成而导致的2,3-BD的分解。适度的孢子形成有利于2,3-BD的合成。菌株M1-L31-PbS利用杨木原水解液,2,3-BD的最大产量达到理论最大值的93%。 图6 菌株M1-L31-Pb和M1-L31-PbS在生物反应器中利用杨树水解液进行高密度发酵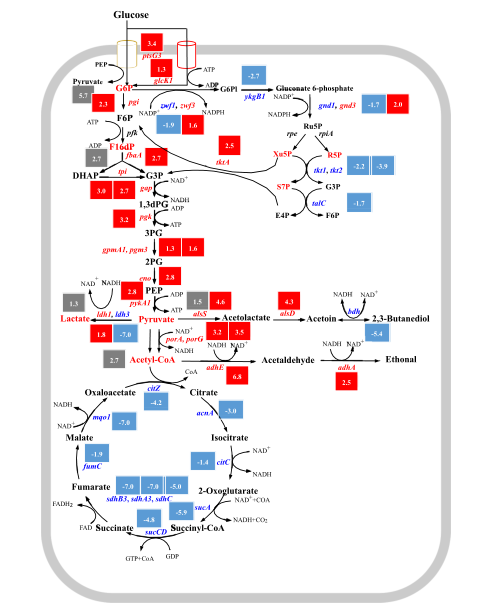
04、结 论 本研究通过对多粘类芽孢杆菌转录组和代谢组的联合分析,揭示了2,3-BD的合成途径和一些限制因素。通过对多粘类芽孢杆菌基因组中的ldh1、ldh3、bdh、spo0A和spoIIE进行基因修饰,提高了2,3-BD的产量。该工程菌株通过发酵杨树原水解液,2,3-BD产量最高可达0.465 g/g。2,3-丁二醇和乙醇的总得率为21.7 g/L。本研究为多粘类芽孢杆菌发酵生产2,3-丁二醇和乙醇提供了一种新的改进方法。
原文索引: Zhang Jikun,Zhao Jianzhi,Fu Quanbin et al. Metabolic engineering of Paenibacillus polymyxa for effective production of 2,3-butanediol from poplar hydrolysate.[J] . Bioresource Technology, 2024, 392: 130002.