
2024-04-28
文章题目:Integrated gut microbiome and metabolome analysis reveals the inhibition effect of Lactobacillus plantarum CBT against colorectal cancer
技术手段:代谢组、16s
江苏大学医学院《Food &Function》上发表了一篇关于植物乳杆菌CBT通过诱导肠道微生物群组成和相关代谢物的改变结直肠癌。
本研究的代谢组、16s和部分数据分析工作由上海派森诺生物科技股份有限公司完成。
研究背景 结直肠癌(CRC)是全球癌症相关死亡的第二大主要原因。肠道菌群的微生态稳定性在预防和治疗结直肠癌(CRC)中起着关键作用。植物乳杆菌虽然具有安全性和潜在的健康优势,但其在结直肠癌中的影响机制仍缺乏全面的了解。 本研究探讨了Lactobacillus plantarum CBT(LP-CBT)是否通过诱导肠道微生物群组成和相关代谢物的改变来预防结直肠癌。通过对肠道微生物组和代谢组的分析,结果表明,LP-CBT通过修复肠道屏障功能抑制AOM/DSS处理小鼠结直肠肿瘤的发生。此外,LP-CBT还降低了促炎细胞因子和抗炎细胞因子。重要的是,LP-CBT通过增加益生菌(粪球菌属、黏液螺旋菌属和乳酸杆菌属)和减少有害菌(多尔氏菌属、志贺菌属、另枝杆菌、副普雷沃氏菌属、拟杆菌属、萨特氏菌属、Turisibacter属、双歧杆菌属、梭菌属、Allobaculum属)来影响肠道稳态,显著影响精氨酸的生物合成。因此,LP-CBT处理调节了精氨酸途径相关的转化酶和代谢物。此外,利用MC38皮下肿瘤模型进一步证实了LP-CBT对结直肠癌的抑制作用。总的来说,这些发现提供了令人信服的证据,支持LP-CBT作为预防CRC的可行策略的潜力。
技术路线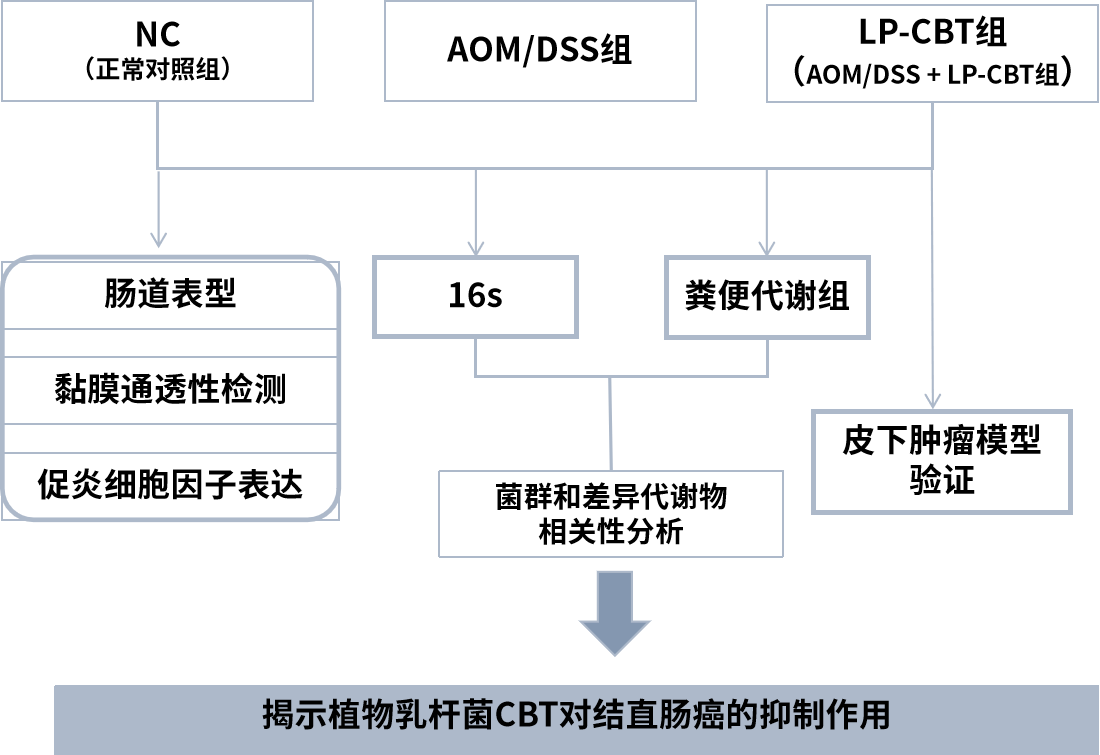
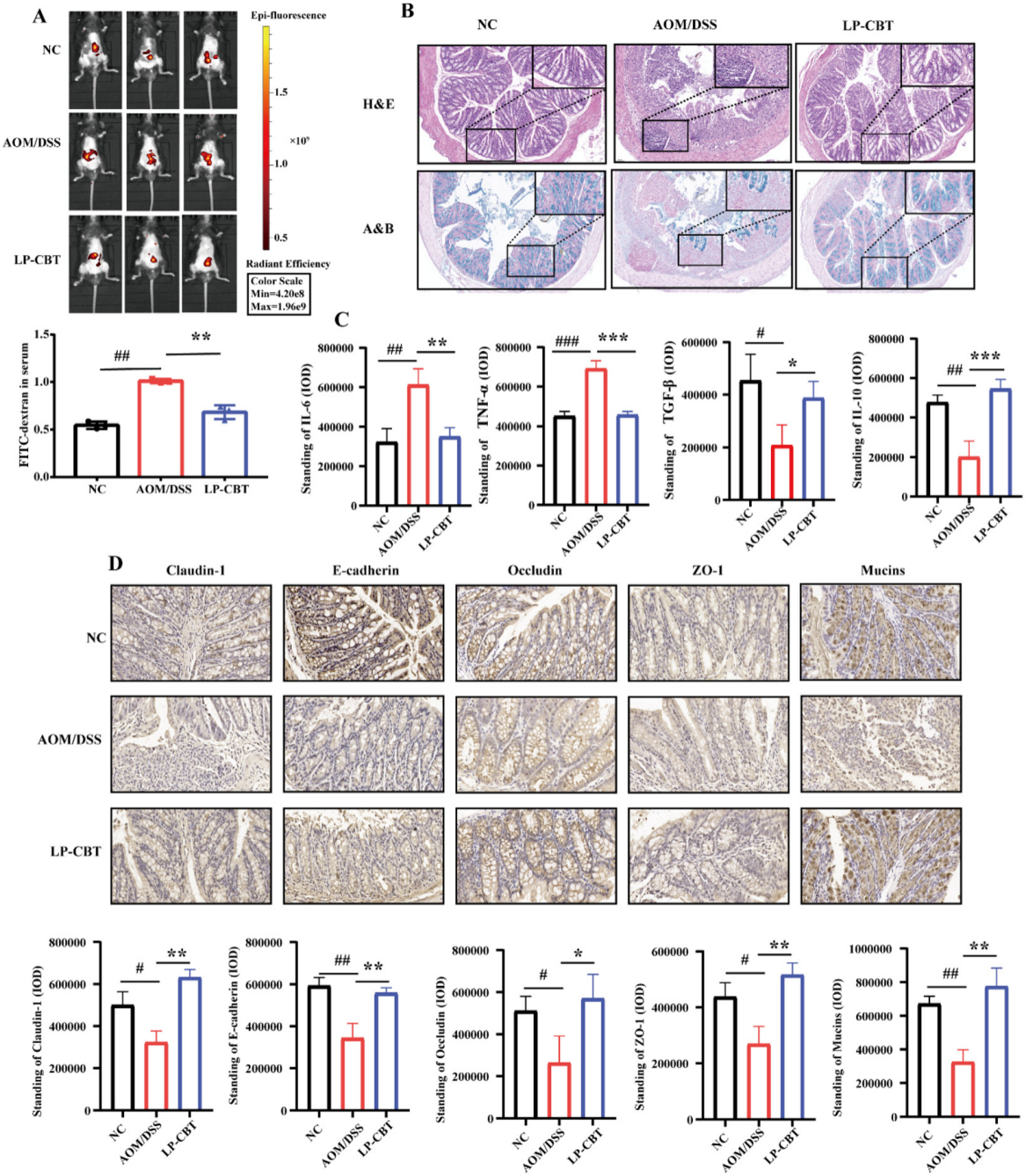
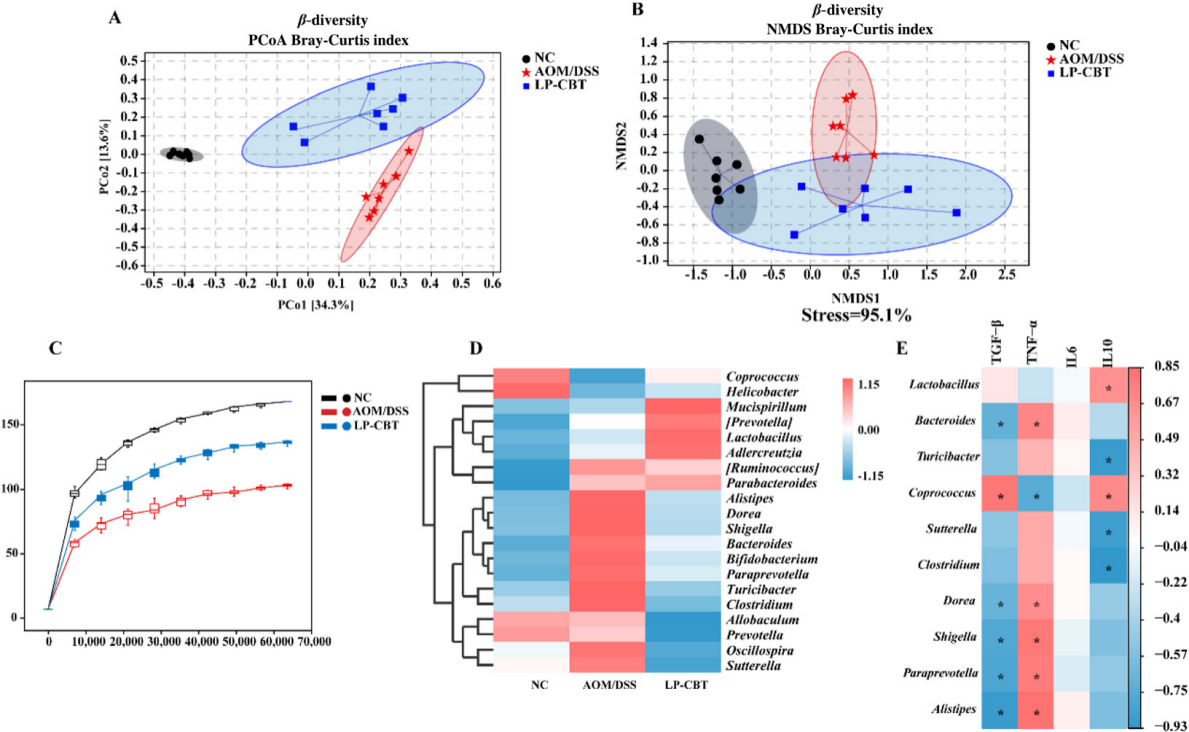
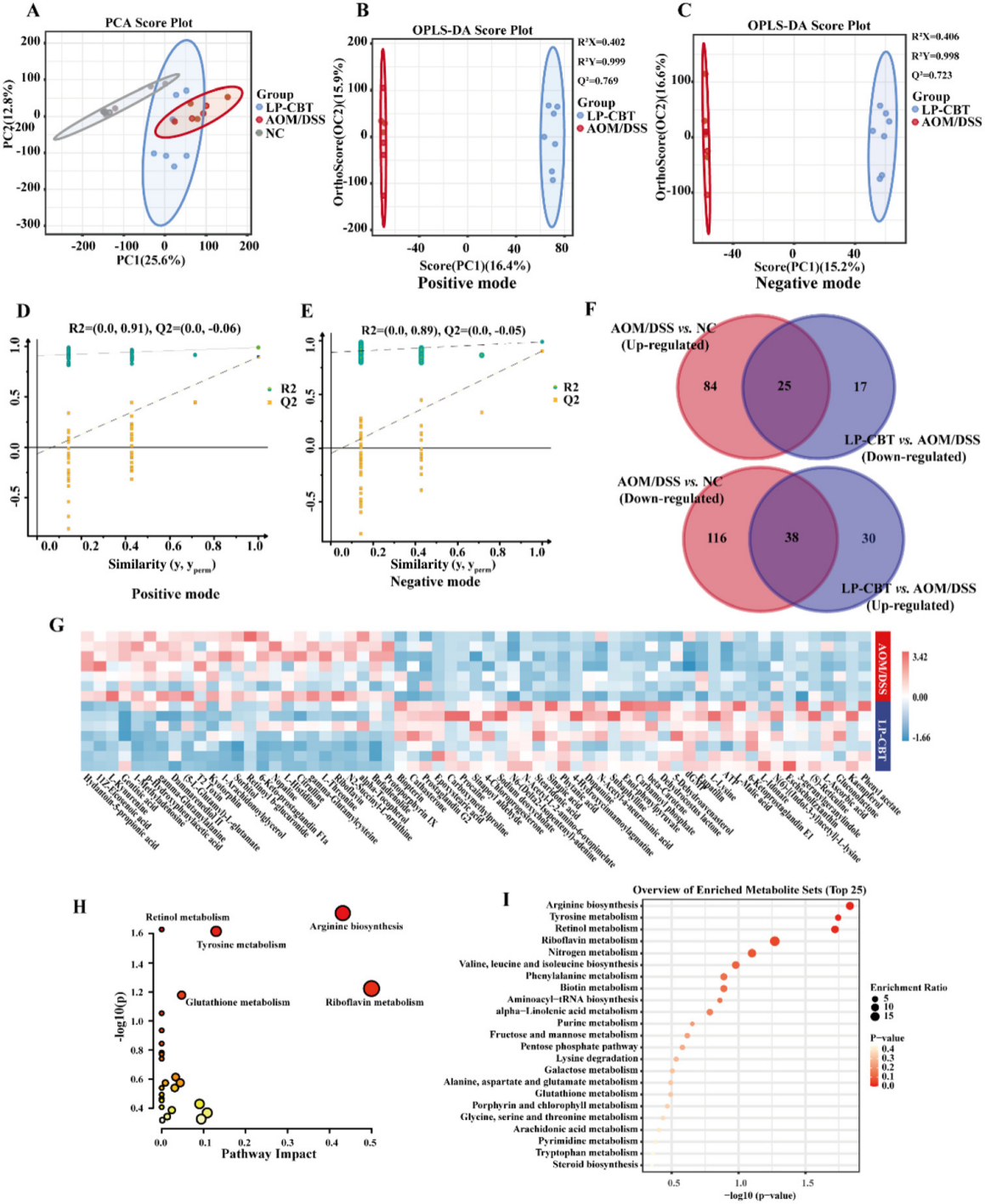
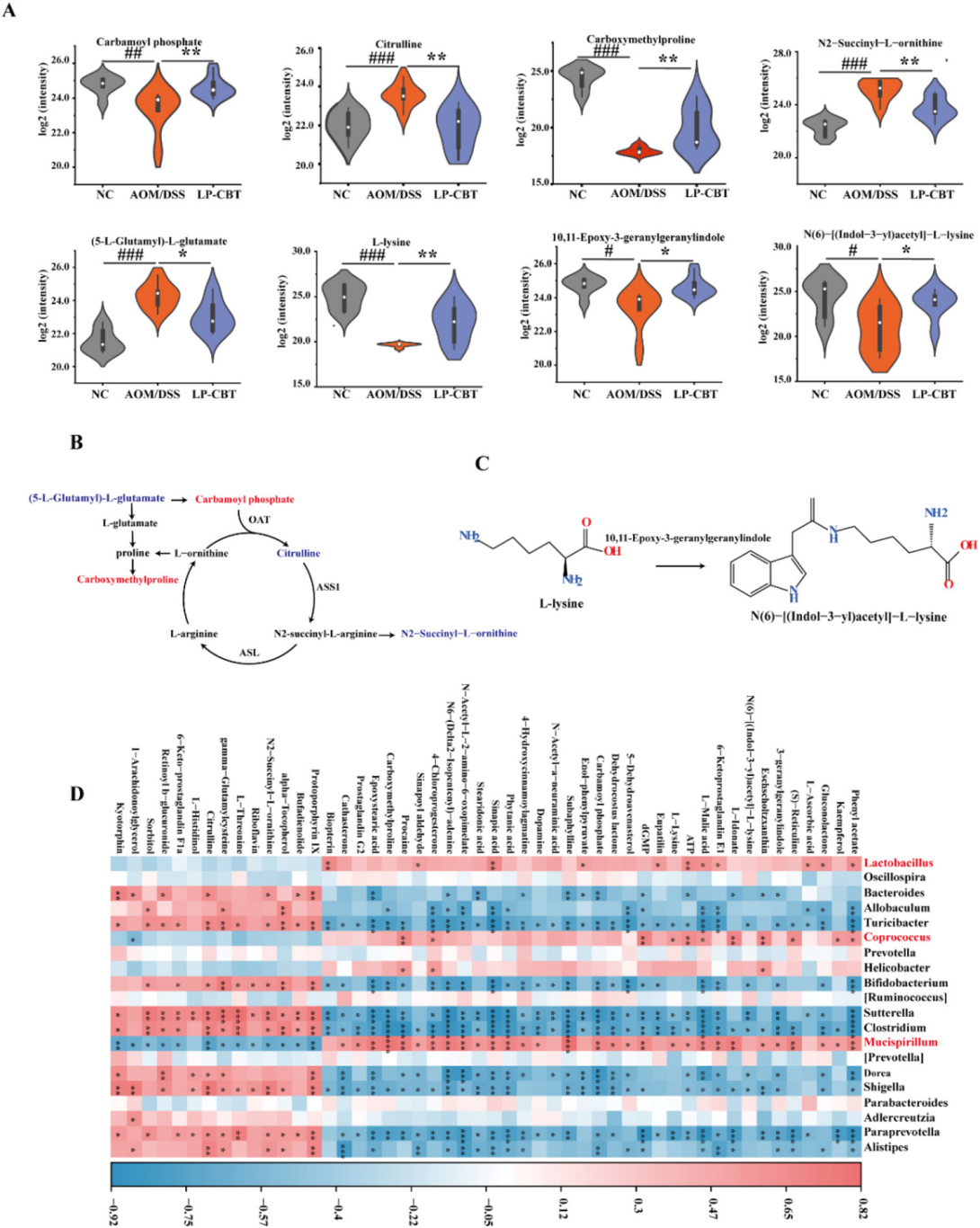
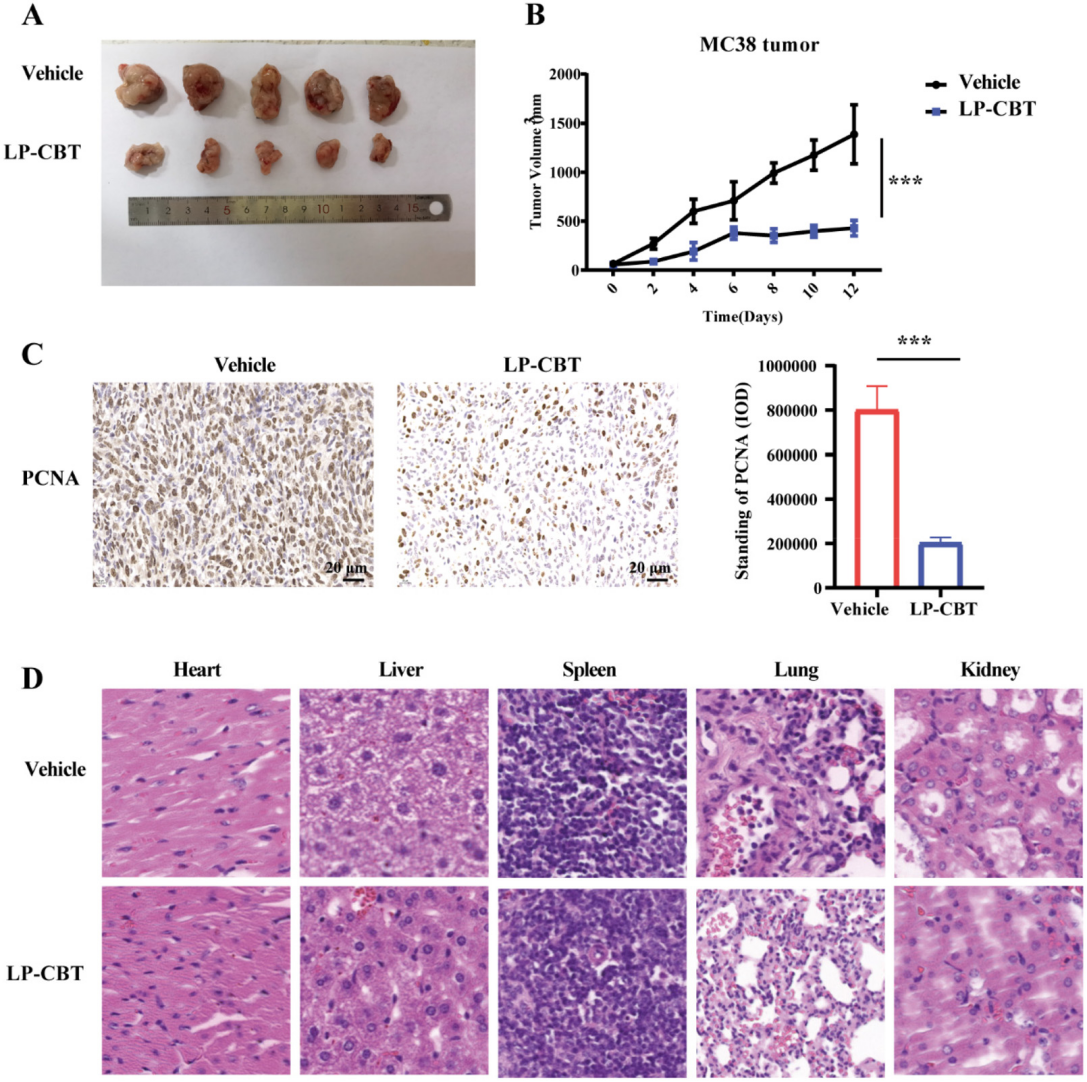
分析结果 1. LP-CBT对直肠癌小鼠的肠道影响 LP-CBT处理后,AOM/DSS诱导的结直肠癌模型小鼠的结直肠肿瘤数量显著减少,LP-CBT可从体重减轻和结肠长度的减少中快速恢复,存活率曲线显示,LP-CBT组的存活率明显提高(图1)。 为了评估LP-CBT治疗对小肠黏膜通透性的影响,测量了FITC葡聚糖的浓度,结果表明AOM/DSS组的FD4渗漏量大幅度增加,LP-CBT处理后FD4渗漏明显减少;经LP-CBT处理后肠壁的结构和细胞形态有明显改善。AOM/DSS组内黏液明显减少,LP-CBT组的黏液显著增加。这些发现表明,LP-CBT干预增强了黏膜屏障功能。此外,对细胞因子进行了IHC(免疫组织化学)染色,AOM/DSS处理后促炎细胞因子的表达水平会增加,LP-CBT处理后显著抑制了促炎细胞因子的表达(图2)。 图1 LP-CBT对AOM/DSS诱导的结直肠癌模型有抑制作用 图2 LP-CBT修复肠道屏障功能 2、LP-CBT对CRC小鼠肠道菌群的影响 为了检测LP-CBT是否会影响CRC小鼠肠道细菌组成,进行了16s rRNA扩增子测序。与AOM/DSS组相比,LP-CBT处理后,前20位细菌中的13种有显著差异。LP-CBT治疗后,多尔氏菌属、志贺菌属、另枝杆菌、拟杆菌属、双歧杆菌属、副普雷沃氏菌属、Turisibacter属和梭菌属的水平与NC组的趋势相同。因此,肠道菌群的重组可能协同促进肠道屏障功能的恢复。微生物群与促炎或抗炎细胞因子相关性分析表明,IL-10与乳酸菌和粪球菌呈显著正相关,与梭菌、旋转杆菌和梭状芽胞杆菌呈负相关。 为了探索细菌群落中的相互联系,对结肠微生物构建微生物网络,创建了三个共现网络。并对这写细菌群落进行了富集分析,其中前五大富集途径包括核苷和核苷酸生物合成、氨基酸生物合成、维生素生物合成、脂肪酸生物合成和脂质生物合成途径(图4)。 图3 LP-CBT对小鼠肠道微生物群组成的影响 图4 LP-CBT对肠道微生物丰度和功能改变的影响 3、LP-CBT对粪便代谢组学的影响 AOM/DSS组和NC组中有263种差异代谢物。在LP-CBT组和AOM/DSS组之间有110种代谢物。Venn图显示,经LP-CBT处理后,AOM/DSS组有38个差异代谢产物表达上调,LP-CBT处理使AOM/DSS组中25个代谢物的表达下调。通过对共有63种差异代谢物进行富集分析,发现精氨酸合成是最重要的信号通路(图5)。 微生物菌群与差异表达代谢物相关性分析结果表明,黏液螺旋菌属与氨甲酰磷酸、羧甲基脯氨酸、L-赖氨酸、10,11-环氧-3-香叶基香叶苷和N-乙酰-L-赖胺基乙酸呈正相关,与瓜氨酸、N2-琥珀酰-L-鸟氨酸和(5-L-glutamyl)-L-glutamate呈负相关。Coprococcus 和Lactobacillus与Mucispirillum有相似的趋势,结果表明,Coprococcus 、Lactobacillus与Mucispirillum及其肠道代谢物在CRC小鼠的LP-CBT干预中起着关键作用(图6)。 图5 LP-CBT改变肠道微生物相关代谢物 图6 LP-CBT在精氨酸合成途径中的代谢物 4、LP-CBT抑制MC38结肠癌模型的生长 在皮下MC38肿瘤模型中,LP-CBT处理后肿瘤体积的减小,PCNA(增殖细胞核抗原)的表达降低、抑制了MC38细胞的生长,同时对心脏、肝、脾、肺、肾等重要器官的形态均无明显变化。结果表明LP-CBT对结直肠癌有有效的抑制作用和无毒性反应。 图7 LP-CBT可抑制肿瘤生长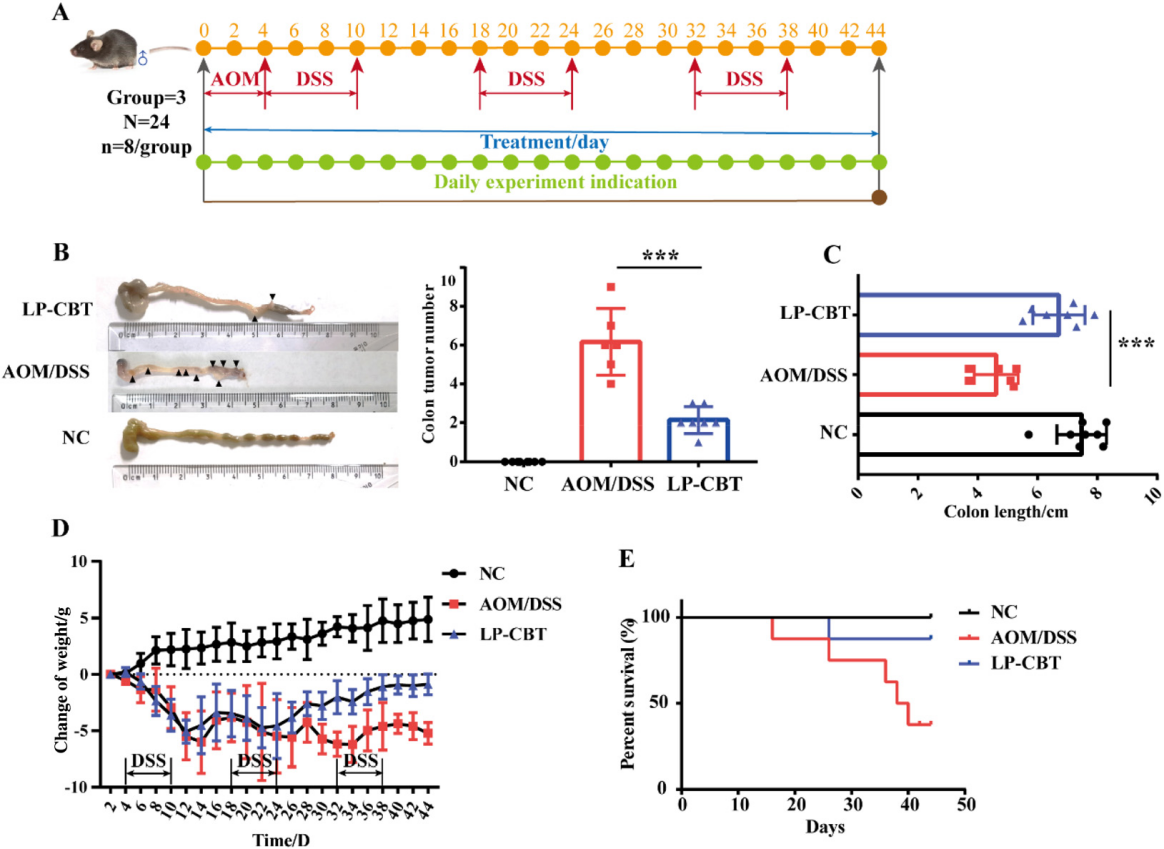

结 论 作者发现LP-CBT对AOM/DSS诱导的结直肠癌(CRC)小鼠的肠道肿瘤发生有抑制作用。这种作用似乎源于LP-CBT通过增加益生菌(粪球菌属、黏液螺旋菌属和乳酸杆菌属)来重塑肠道稳态,这些益生菌显著影响精氨酸的生物合成。LP-CBT治疗后,精氨酸途径相关的转化酶和代谢物可能通过改变肠道菌群的组成,从而促进肠黏膜屏障功能的恢复。这些结果可能为制定利用LP-CBT预防结直肠癌发生的治疗策略铺平了道路。
文章链接: DOI: https://doi.org/10.1039/d3fo04806c
原文索引: Chen, Yan-Yan, et al. "Integrated gut microbiome and metabolome analysis reveals the inhibition effect of Lactobacillus plantarum CBT against colorectal cancer." Food & Function 15.2 (2024): 853-865.