
2024-05-20

文章题目:Breaking Iron Homeostasis: Iron Capturing Nanocomposites for Combating Bacterial Biofilm
技术手段:RNA-seq等
吉林大学研究小组开发了一种新的抗菌策略,通过纳米复合材料靶向细菌铁摄入并使其饥饿。为细菌感染的治疗提供了一种全面的解决方案。研究结果发表在《Angewandte Chemie International Edition》上。本研究中转录组测序及部分分析工作由上海派森诺生物科技股份有限公司完成。
名词解释 INIT:铁营养免疫疗法 Ga-CT:Ga/Cu-TCPP,镓,铜掺杂四(4-羧基苯基)卟啉金属 MOF:金属有机框架 PAMAM PDs:多胺-胺聚合物点 NCs/NSs:纳米复合材料/纳米片 PDT:光动力疗法 PTT:光热治疗法 DFT:密度泛函理论 DEG:差异表达基因 OMR:外膜受体 PBP:周质结合蛋白 ATP:三磷酸腺苷
研究背景 细菌感染是当前最具挑战性的问题之一,也是临床感染性死亡的主要原因。细菌感染后,宿主会限制铁离子,导致一种被称为营养免疫的现象。在与宿主共同进化后,细菌发展出了适应途径,如氯化血红素摄取系统,以避免缺铁。铁竞争发生在感染的所有阶段,长期控制快速生长的细菌对宿主来说是具有挑战性的。因此,开发一种新的策略来应对铁捕获细菌的进化对抗菌营养免疫治疗至关重要。 受此启发,本文提出了一种铁营养性免疫疗法(INIT)的新策略,利用镓(Ga),铜(Cu)掺杂四(4-羧基苯基)卟啉(TCPP)金属有机框架(MOFs)和多胺-胺聚合物点(PAMAM PDs)构建的Ga-CT@P纳米复合材料(NCs)来靶向细菌铁摄入并使其饥饿。最终促进生物膜根除和组织修复。本研究从营养学角度提出了一种创新的抗菌策略,为难治性细菌感染的治疗及其未来的临床应用提供了启示。
技术路线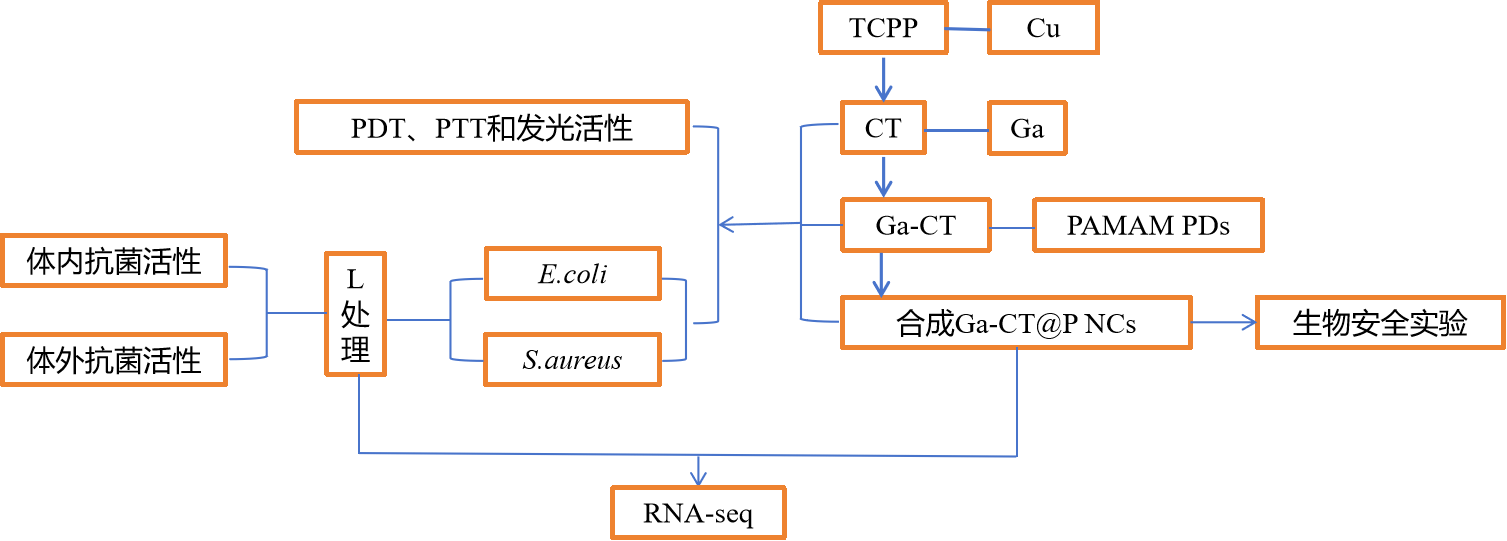
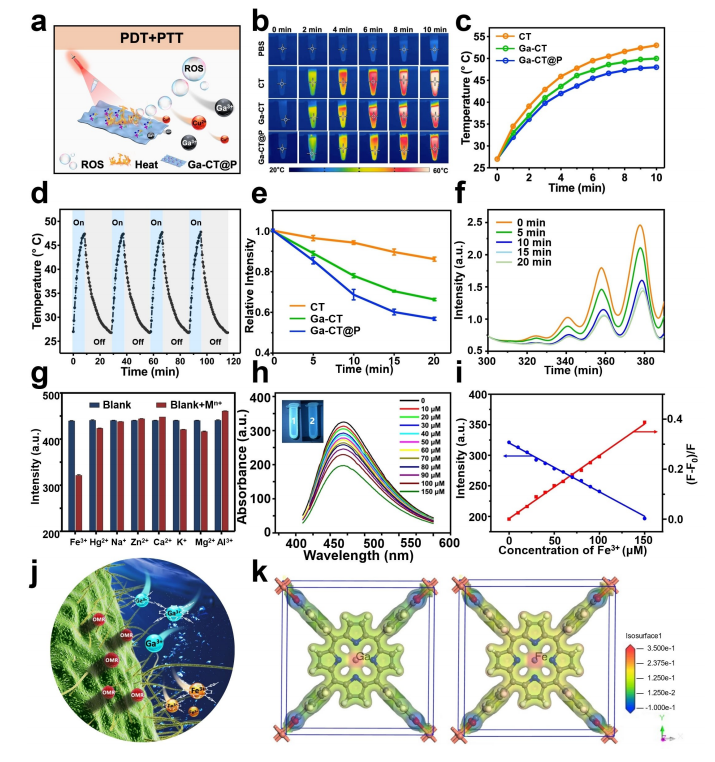
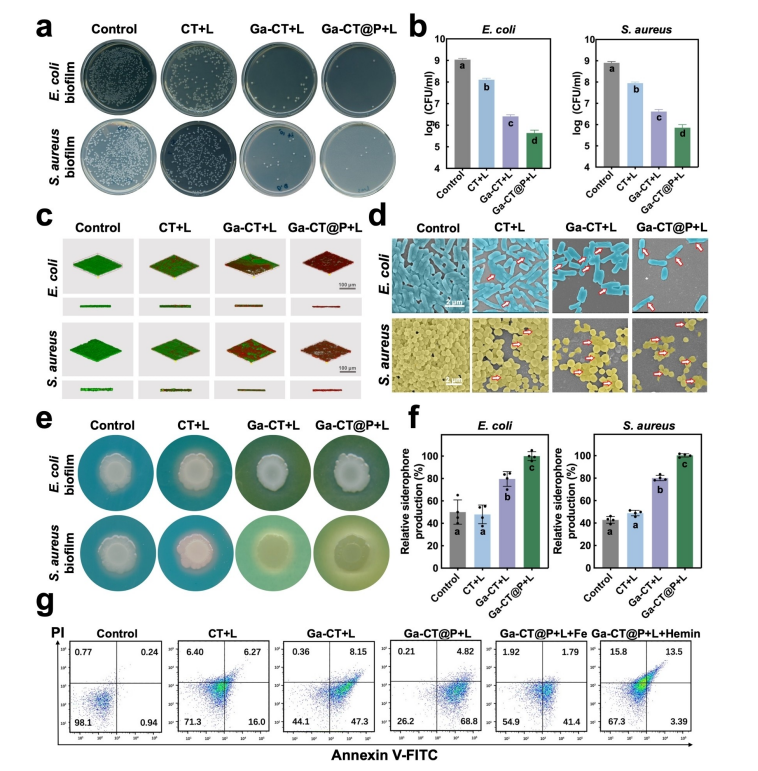
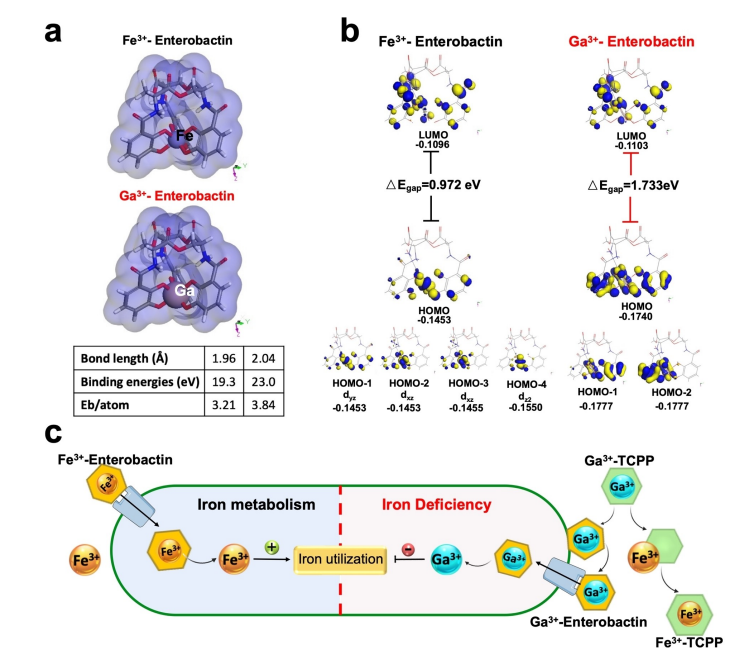
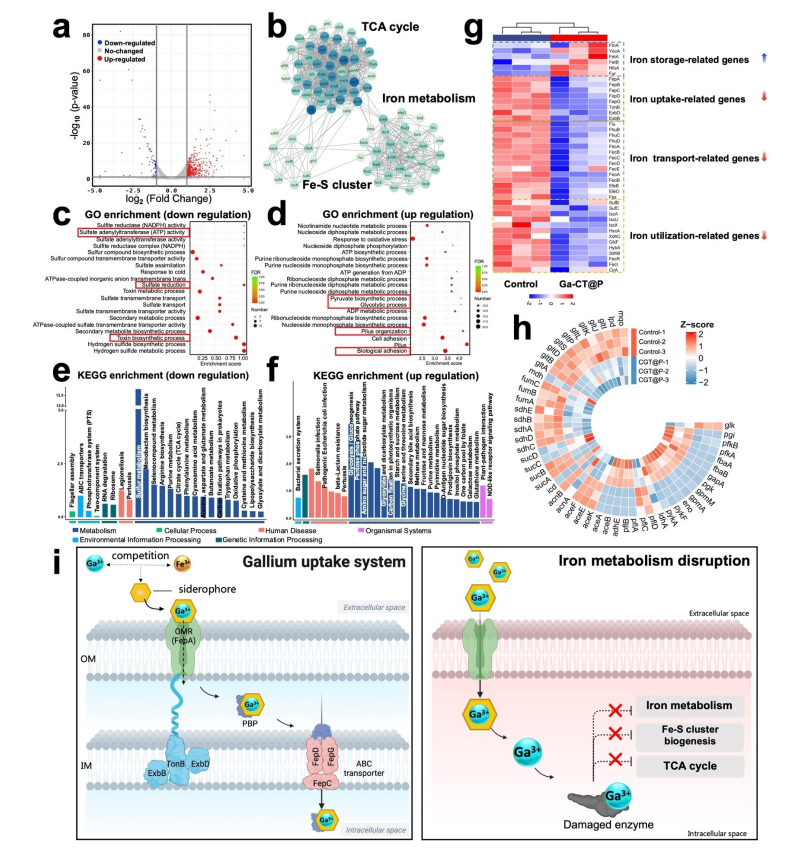
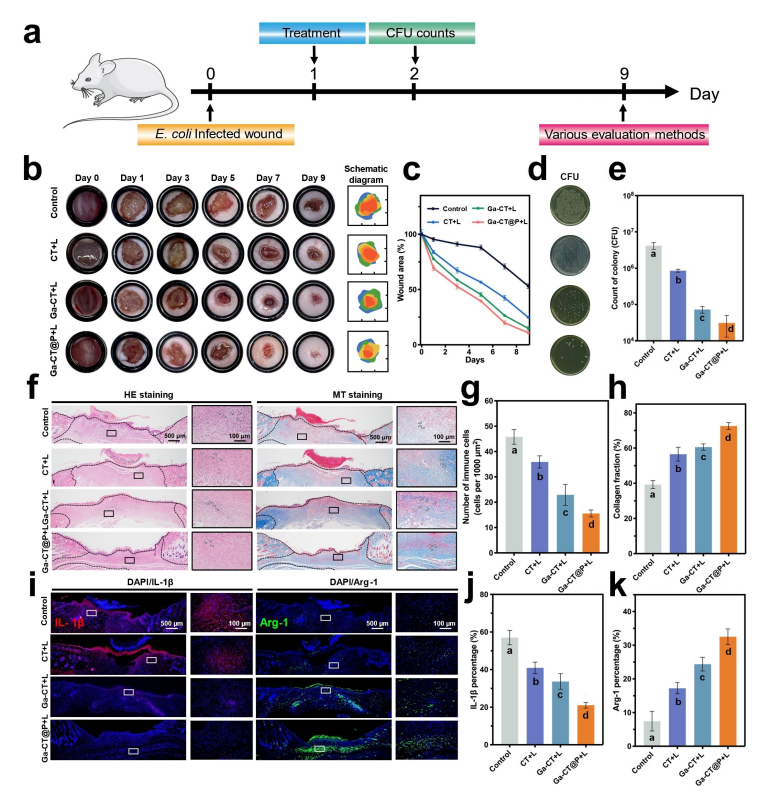
研究内容 1、Ga-CT和Ga-CT@P的合成与表征 采用溶剂热法成功地制备了超薄Ga-CT@P NCs(图1a)。其中Ga-CT NSs表现出典型的二维形态,PAMAM PDs分布在2D Ga-CT NSs上。虽然 Ga3+和Cu2+同时被引入到结构中,但分析表明它们在结构中占有不同的位置。具体来说,Cu2+组装成二维MOF结构,作为连接体,而Ga3+整合到卟啉环中,形成Ga-CT NCs。因此,利用简单的材料及其有效的组合来实现了载流子的形成和有效的离子负载。 图1 CT、Ga-CT和Ga-CT@P NCs的表征 2、体外光热、光动力学和发光活性 Ga-CT@P NCs的PDT、PTT和发光活性如图2a所示。在光照射下,通过分子热运动证明了Ga-CT@P中Ga3+的有效释放。带正电的PAMAM PDs可以赋予Ga-CT@P与带负电的细菌进行静电相互作用的能力,为Ga-CT@P靠近细菌提供动力。Ga-CT@P具有协同PDT/PTT和短期抗菌作用。对于剩余的难降解细菌,卟啉环将Ga3+提供到细菌表面,并从细菌附近去除Fe3+,导致长期的铁饥饿和死亡。 图2 光热、光动力和Fe3+传感效应的评价 3、体外抗菌活性测定 用500μgmL-1的NCs处理大肠杆菌(ATCC 47076)和金黄色葡萄球菌(ATCC 29213)的生物膜,然后用激光照射(L)进一步处理。图3a显示与对照组相比,所有实验组在照射下的大肠杆菌和金黄色葡萄球菌菌落数显著减少。含有PAMAM PDs的Ga-CT@P+L组对大肠杆菌和金黄色葡萄球菌表现出最强的抗生素膜作用,与对照组相比减少了约3倍。活体染色和扫描电镜和SEM图像显示Ga-CT@P+L组中的细菌最少。 图3 Ga-CT@P NCs的抗生膜特性 4、Ga3+-肠杆菌素的密度泛函理论计算 当面临缺铁困境时,大肠杆菌进化分泌肠杆菌素。利用DFT计算研究Ga3+和Fe3+之间的铁载体结合竞争(图4)。肠杆菌素与Ga3+形成的配位键长度更均匀,结合能更大。此外,Ga3+-肠杆菌素比Fe3+-肠杆菌素更稳定。设计的Ga-CT@P NCs可以通过卟啉环内的Ga3+/Fe3+交换来靶向细菌铁营养代谢。在缺铁条件下,Ga3+与Fe3+竞争大肠杆菌分泌的肠杆菌素表现出极大的优势。 图4 DFT计算结果总结 5、Ga-CT@P通过INIT靶向铁稳态 采用RNA-seq技术对Ga-CT@P+L处理过的大肠杆菌的DEGs进行分析。PPI网络显示(图5b),DEGs在三种途径中密切富集:TCA循环、铁硫簇代谢和TCA循环。GO富集分析(图5c和5d)揭示了与菌毛组织相关的DEGs上调,特别是与铁饥饿反应有关的传感器调节蛋白。与铁硫簇代谢、TCA循环和ATP结合盒(ABC)转运体相关的DEGs下调。KEGG富集分析(图5e和5f)显示,与TCA循环相关的DEGs下调,而与糖酵解相关的DEGs上调。 许多DEGs与细菌铁代谢有关(图5)。与铁摄取(exbB、exbD、tonB和fepA)、运输(feoB和efeO)相关的基因显著下调。相反,与铁储存相关的基因(ftnA、nfuA和fur)显著上调。这些结果表明,Ga-CT@P铁阻断处理后,细菌生物膜中的铁利用显著下调。Ga-CT@P处理后,DEGs(如pgi、pfk、fba和gapA)显著上调,与铁饥饿时糖酵解的全体性上调一致。此外,结果表明乳酸代谢途径和丙酮酸途径DEGs分别增加和减少。Ga-CT@P+L组乳酸产量高于对照组,导致细菌糖代谢紊乱。 Ga-CT@P诱导的INIT的确切机制如图5i所示。在革兰氏阴性菌中,释放的Ga3+与Fe3+竞争,与无铁的铁载体结合,形成Ga3+-铁载体复合物。Ga3+-铁载体复合物被OMR、PBP和内膜ATP结合盒(ABC)转运蛋白内化。TonB系统由TonB, ExbB和ExbD蛋白组成,将细胞质膜的质子动力与外膜的质子动力偶联,为该过程提供所需的能量。TonB跨越细胞质和外膜之间的质周空间,并与与Ga3+-铁载体结合的OMR相互作用。这种相互作用诱导TonB的构象变化,并将其传递给细胞质膜定位的ExbB和ExbD蛋白。这种构象改变从质子动力中释放能量,从而促进了Ga3+-铁载体复合物进入细菌细胞。一旦Ga3+-铁载体被细胞吸收,Ga3+-铁载体就可以作为Fe3+模拟物与需铁酶结合。在氧化还原循环中,Ga3+不能替代Fe3+。因此,用Ga-CT@P NCs处理的细菌表现出缺铁状态,破坏铁代谢、铁硫簇生物合成和TCA循环。 图5 Ga-CT@P处理大肠杆菌的RNA序列分析 6、体内抗菌活性测定 利用大肠杆菌感染小鼠皮肤伤口模型,探索Ga-CT@P NCs在体内的抗菌能力(图6)。Ga-CT@P+L组连续使用Ga-CT@P NCs治疗后,感染创面迅速修复,几乎完全消失。Ga-CT@P+L组炎症细胞数量最少,促炎因子IL-1β表达降低,抗炎细胞因子Arg1水平升高。总体而言,Ga-CT@P NCs具有强大的抗菌能力,通过协同PDT/PTT/INIT修复感染创面,抵抗细菌侵袭,抑制炎症反应,加速胶原沉积,导致感染耗散和再生恢复。 图6 Ga-CT@P NCs在体内消除伤口感染 7、Ga-CT@P生物安全试验 利用CCK8测定和主要器官的H&E组织学分析评估细胞毒性,结果表明,Ga-CT@P NCs(500μgmL-1)符合细胞毒性要求。利用体内荧光成像技术评价Ga-CT@P的代谢,结果表明Ga-CT@P NCs主要通过肝脏代谢,小部分通过肾脏代谢。这些结果表明Ga-CT@P NCs具有良好的生物安全性,在临床治疗中具有进一步应用的前景。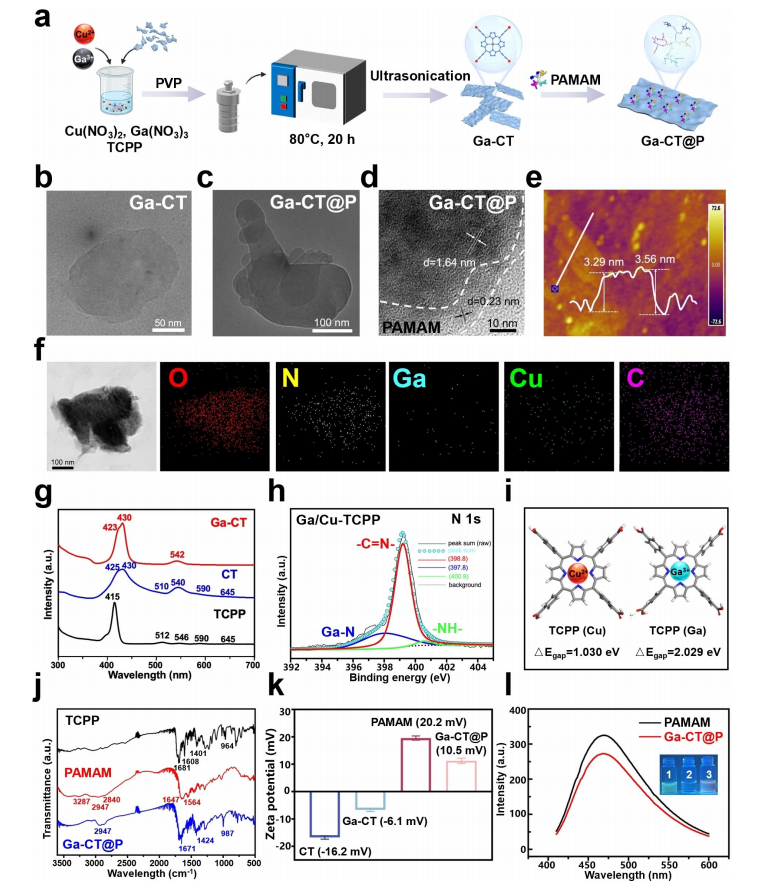
研究结论 在这项研究中,成功地合成了新的Ga-CT@P NCs用于抗菌感染和生物膜的形成。结果证实Ga-CT@P NCs通过协同光热/光动力/铁营养免疫治疗成功对抗生物膜感染并靶向细菌铁营养代谢。首先,Ga-CT@P NCs利用带正电的PAMAM PDs在带负电荷的表面捕获细菌。它们具有显著的协同光热和光动力能力。然后,结合了Ga3+的卟啉在照射后释放出Ga3+离子,欺骗细菌吸收,通过卟啉环从周围的细菌环境中提取Fe3+离子。这种策略使细菌处于缺铁的环境中,并使它们饿死,这被称为铁营养免疫疗法。同时,所设计的Ga-CT@P NCs中的PAMAM PDs可作为监测细菌中动态铁限制的监测器。进一步从转录组水平研究了其抑菌机制。INIT策略有助于破坏铁硫簇代谢、TCA循环和ATP代谢。总之,Ga-CT@P所体现的INIT策略为未来通过破坏细菌营养稳态来治疗细菌感染提供了新的视角。 方案:Ga-CT@P NCs的形成(左)和抗菌机制(右)示意图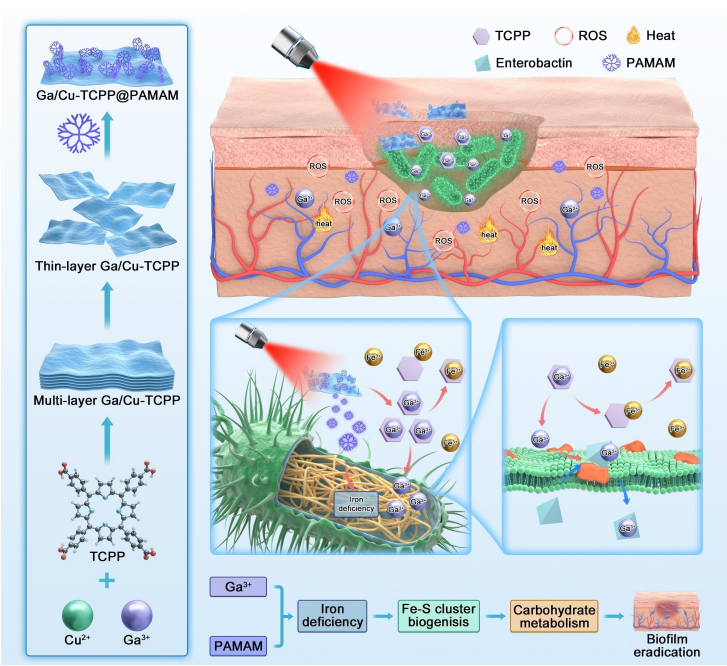
文章链接 DOI:https://doi.org/10.1002/anie.202319690
参考文献 Sun, Wenyue, et al. "Breaking Iron Homeostasis: Iron Capturing Nanocomposites for Combating Bacterial Biofilm." Angewandte Chemie International Edition (2024): e202319690.