
2024-06-09
文章题目:Gold core@CeO2 halfshell Janus nanocomposites catalyze targeted sulfate radical for periodontitis therapy 吉林大学在《Journal of Controlled Release》上发表了金核@CeO2半壳Janus纳米复合材料催化硫酸根自由基靶向治疗牙周炎的研究成果。本研究中转录组检测及部分数据分析工作由上海派森诺生物科技股份有限公司完成。
1、研究背景 牙周病是第六大最常见的慢性感染性炎症疾病,与许多慢性非传染性疾病密切相关,引起了相当大的关注。由于牙周结构独特的解剖复杂性,包括深牙周袋和牙根解剖结构的特异性,加上抗生素耐药性日益严峻的挑战,显著限制了其治疗效果。近年来,光催化抗菌治疗(PCAT)在治疗微生物感染的前瞻性方法中占有突出地位。通过利用光催化产生的活性氧(ROS)的能量,有效地湮灭了微生物。其中,硫酸盐自由基(SO4•-)以其高反应活性和长寿命而闻名,已成为一种有效的抗菌剂。然而,尽管它有潜力,高效地生成这种自由基仍然是一个巨大的挑战,特别是通过涉及纳米酶和光催化的方法。
2、技术路线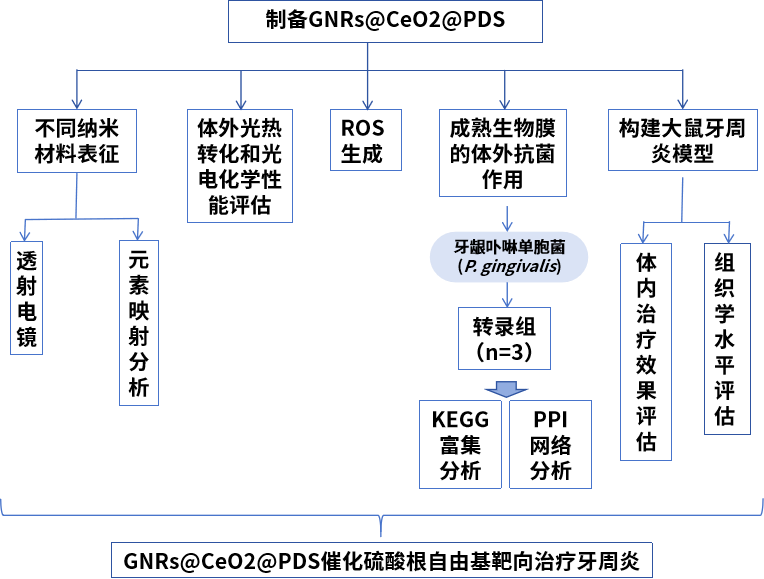
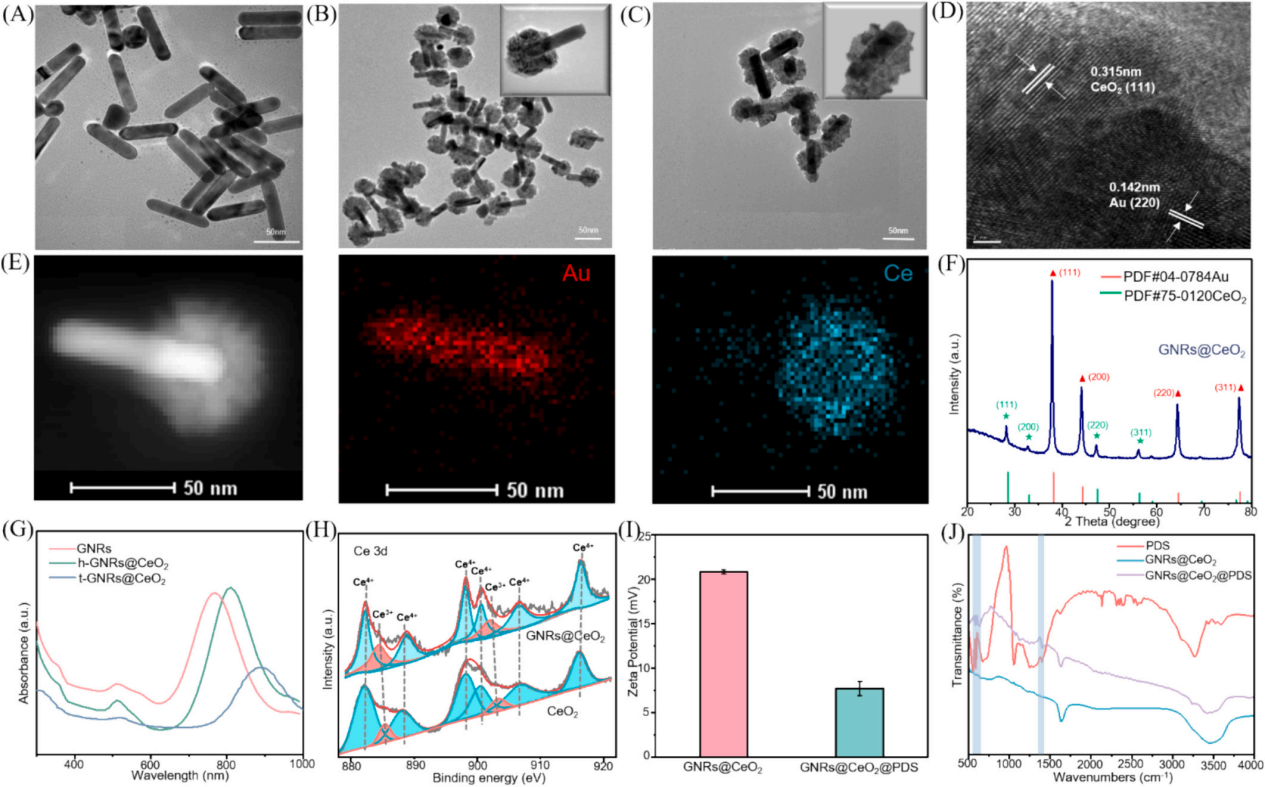
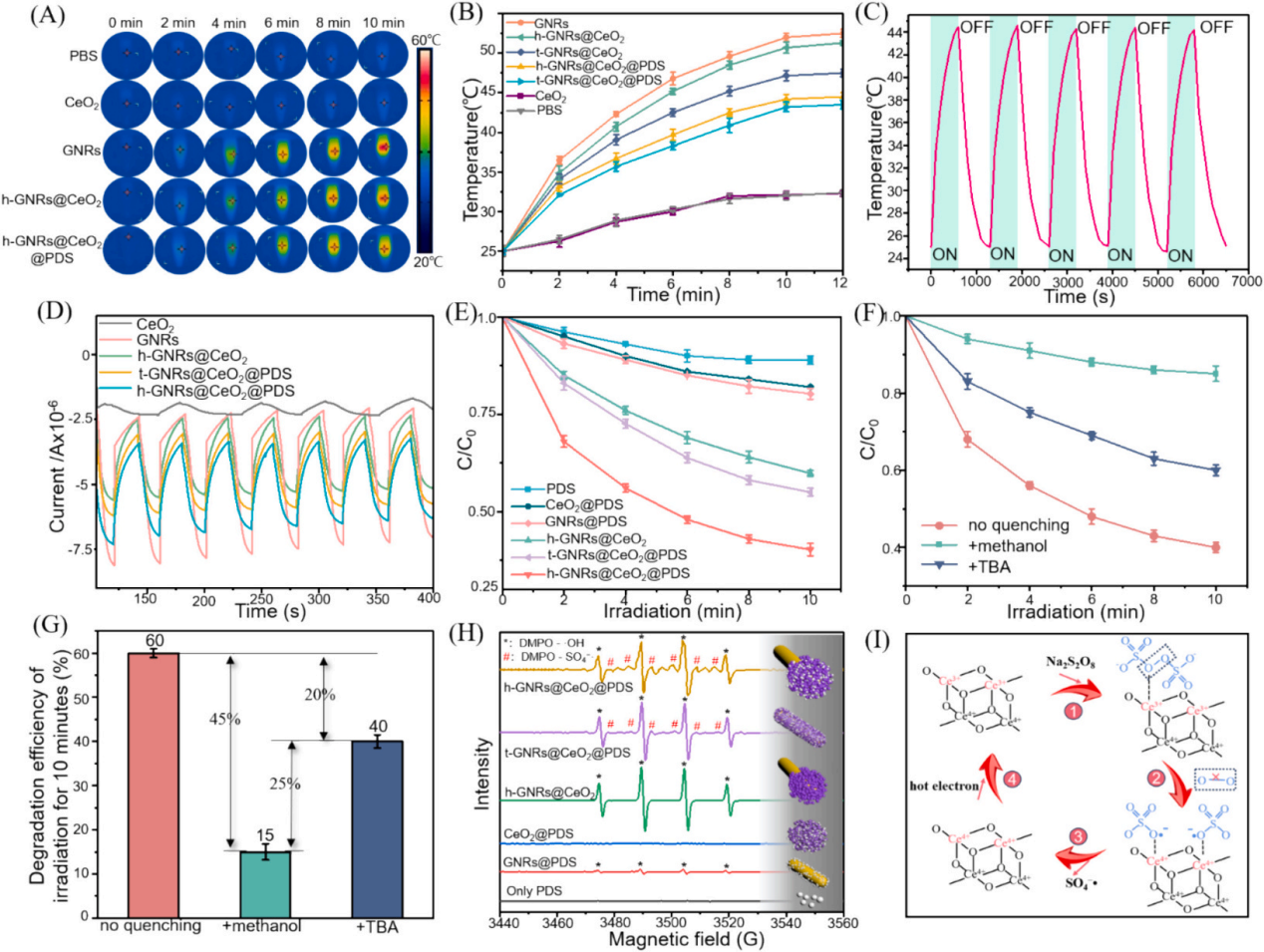
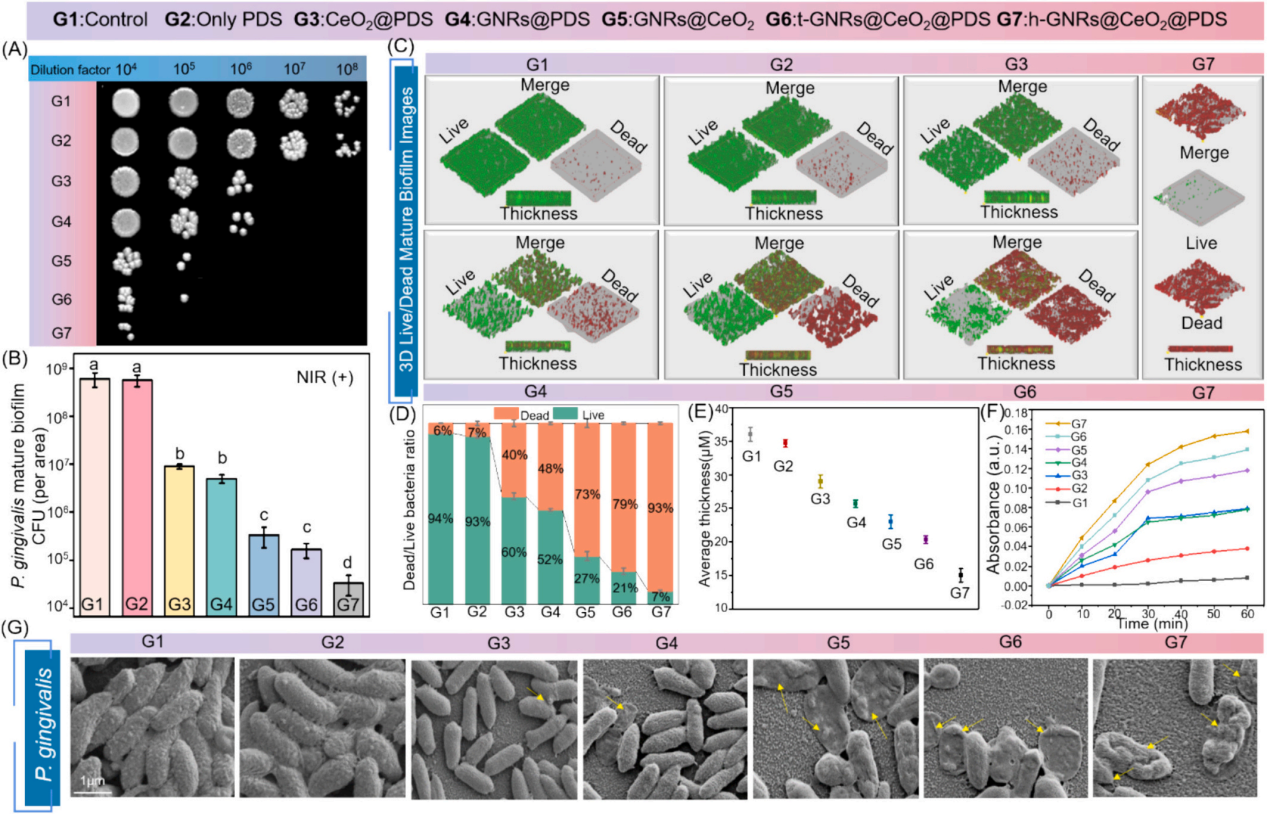
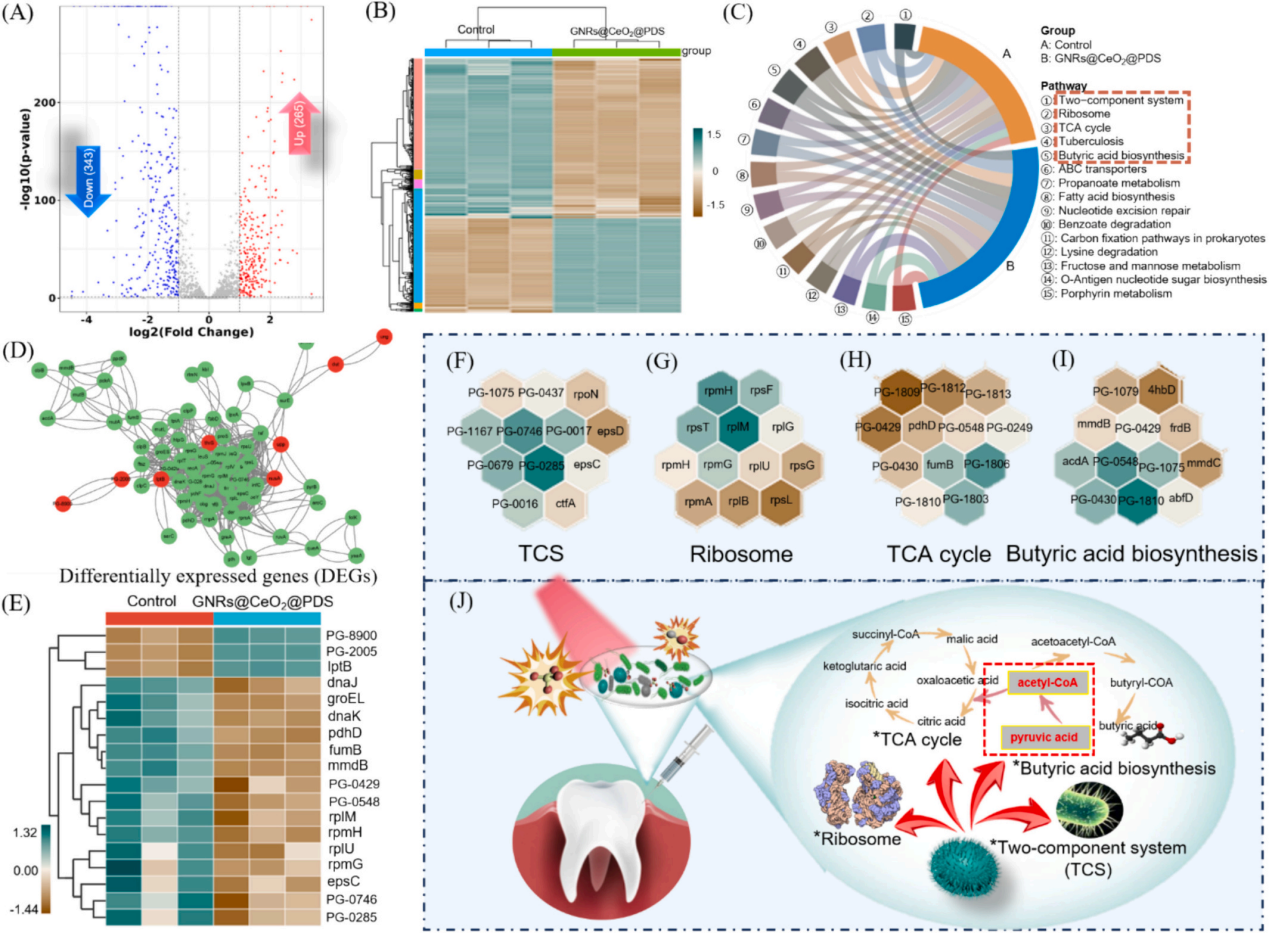
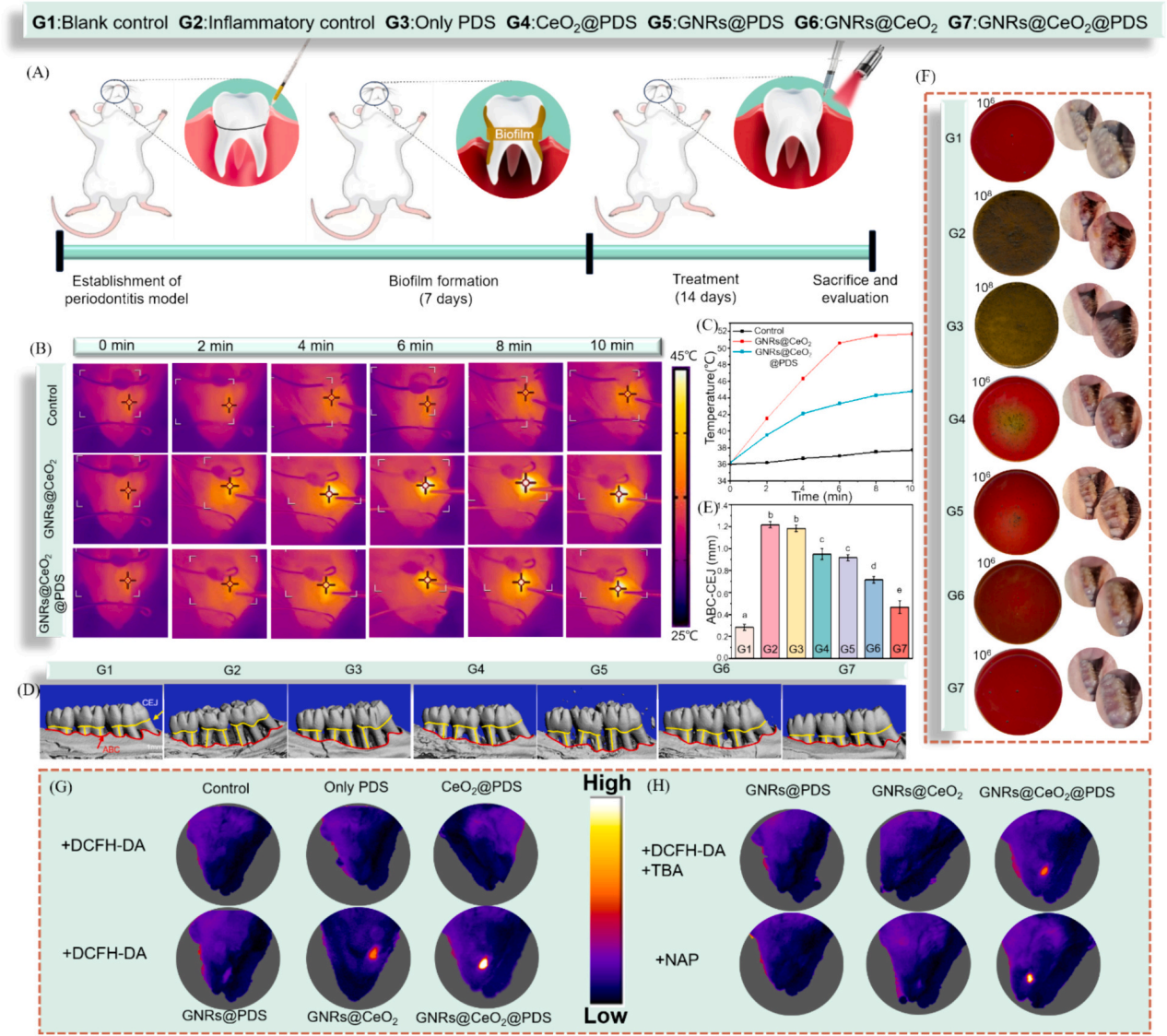
3、研究内容 GNRs@CeO2@PDS的制备表征 利用氧化铈(CeO2)纳米酶的过氧化物酶(POD)模拟活性和光催化特性,与等离子体金纳米棒(GNR)的增强概念相结合,开发了一种负载过硫酸盐的半封装核壳GNRs@CeO2 Janus异质结构(图1)。 图1 h-GNRs@CeO2@PDS NCs的设计示意图 图2A、B、C显示了GNR的透射电子显微镜(TEM)图像,h-GNRs@CeO2和t-GNRs@CeO2分别地GNR呈现出长度为50-100 nm的均匀棒状。CeO2在GNR上实现定向单端外延生长,形成蘑菇状结构h-GNRs@CeO2全方位封装成型t-GNRs@CeO2分别地CeO2在两者上均表现出多孔壳结构,这有利于PDS的有效负载。样品在水溶液中表现出良好的分散性,无聚集迹象。HRTEM图像显示了其独特的平面结晶特征(图2D)。元素映射分析表征了Ce和Au在纳米结构中的元素分布。结果清楚地表明,只有一端被CeO2壳层覆盖。X射线粉末衍射(XRD)结果表明,CeO2壳层和GNRs具有晶体结构(图2E-F)。GNRs@CeO2的XRD谱图与CeO2和Au的谱图吻合较好(图2G)。图2H表示CeO2和GNRs@CeO2的x射线光电子能谱(XPS),用于检测表面元素及其价态。 如图2I所示,确定GNRs@CeO2的电势为+20 mV。同时,PDS里的S2O82−具有很强的负电荷特性,通过静电吸引很容易加载到GNRs@CeO2的正电荷表面,使GNRs@CeO2表面的正电荷减少,表明PDS加载成功。此外,GNRs@CeO2@PDS以其阳离子表面为特征,主要通过与带负电的细菌膜的静电相互作用表现出显著的抗菌活性。这种相互作用强调了它们作为有效抗菌材料的潜力。此外,我们进一步进行了傅立叶变换红外光谱(FTIR)分析,以验证PDS封装的有效性。 图2 各种纳米材料的表征 GNRs@CeO2@PDS的体外光热转化和光电化学性能 图3A和B描绘了光热图像和相应的温度测量结果,表明温度随着照射时间的推移而升高,这一现象在纯GNR中最为明显。此外,PDS和热电子的存在增强了电子传递效率,促进了铈的价态转变,催化活性提高。如图3C所示,在相同条件下,h-GNRs@CeO2@PDS的光热性能在连续五个照射周期中保持一致,表明具有强大的光热稳定性。光致电流-时间(i-t)曲线(图D)清楚地表明,与单独使用CeO2相比,引入GNR会导致电流显著上升。 GNRs@CeO2@PDS的体外ROS生成 在808 nm近红外照射下,PDS无法产生可观的SO4•-,CeO2@PDS和GNRs@PDS组表现出有限的降解能力。而h- GNRs@CeO2@PDS组件表现出显著增强的降解性能可能是由于GNR激发的热电子转移到CeO2上,促使Ce4+广泛转化为Ce3+,这有效地激活了PDS,从而产生了大量的SO4•-。同时,水分子被SO4•-氧化生成额外的•OH。因此,该体系中存在大量的•OH和SO4•-,形成了“自由基风暴”。如图F和G所示,添加TBA后10 min, MB的降解率从60%下降到40%,而甲醇的存在导致MB的降解效率仅为15%,说明h-GNRs@CeO2@PDS可以同时生成SO4•-和•OH。 随后,采用电子顺磁共振(EPR)分析来检测直接来自不同纳米材料的活性SO4•-和•OH自由基的特征,结果表明h-GNRs@CeO2可以激活PDS并促进活性自由基以及•OH和SO4•-自由基的形成(图3H)。与完全封装的GNR相比,半封装态表现出更好的光吸收能力,从而能够更有效地将电子转导到CeO2,并在PDS的活化中表现出更强的催化和酶促功效。 图3 各种纳米材料的光热转换、光电化学性能和活性氧生产能力 GNRs@CeO2@PDS NCs对成熟生物膜的体外抗菌作用 为了测试纳米材料光催化性能的治疗效果,进一步评估了GNRs@CeO2@PDS对口腔致病性厌氧菌的影响。图4A和B绘制了不同纳米材料在808 nm近红外照射下处理的成熟牙龈卟啉单胞菌(P. gingivalis)生物膜的菌落形成单位(CFU)计数。h-GNRs@CeO2@PDS + NIR在所有测试组中表现出最高的抗生素膜效率。 此外,我们通过活/死染色构建了3D图像,以直观地评估不同材料处理后成熟生物膜厚度的变化和深层细菌的生存状态。从图4C-4E可以看出,CeO2@PDS、GNRs@PDS和GNRs@CeO2基团的抗生物膜作用是不可忽视的,它取决于CeO2本身的抗菌性能、光热效应和•OH氧化。在此基础上,我们利用扫描电镜(SEM)对不同纳米材料在808 nm近红外照射下的抗菌膜效果进行了定性评价。如图4G所示,与对照组和其他实验组相比,受益于aPTT和ROS风暴联合处理的h- GNRs@CeO2@PDS + NIR组的生物膜面积减少最为显著,t-GNRs@CeO2@PDS + NIR组和GNRs@CeO2 + NIR组紧随其后。细胞膜的破坏导致细胞内成分(如DNA和RNA)释放到周围环境中,最终导致细菌死亡。如图F所示,h- GNRs@CeO2@PDS组与其他组相比,OD260值升高,表明核酸泄漏更广泛,抗菌活性更高。因此,h-GNRs@CeO2@PDS被808 nm近红外激光激活后,显示出显著的抗菌活性,有效地破坏了生物膜,从而为根除牙周菌斑生物膜进而有效根除病原体。 图4 近红外辐照下不同纳米材料对牙龈假单胞菌生物膜的抵抗能力 GNRs@CeO2@PDS NC治疗后牙龈卟啉单胞菌的转录组学分析 为了深入研究基于硫酸盐自由基的抗菌机制,选择牙龈卟啉单胞菌作为模型生物,并对对照组和GNRs@CeO2@PDS组进行了转录组学分析。暴露于GNRs@CeO2@PDS后,共发现608个显著差异表达基因,其中343个下调基因,265个上调基因(图5A-B)。KEGG通路分析发现相关的途径包括双组分系统(TCS)、核糖体生物发生、三羧酸(TCA)循环和丁酸生物合成,每种途径都有助于生物体对处理诱导的强大ROS环境的反应(图5C)。研究证实牙龈卟啉单胞菌在牙周感染中的毒力很大程度上依赖于菌毛的表达。图D-5F所示的相互作用热图和蛋白-蛋白相互作用(PPI)网络揭示了TCS内关键基因的下调,表明长毛和短毛均受到抑制。这种抑制限制了牙龈卟啉单胞菌形成生物膜的能力及其传染性,损害了其检测和调节环境变化的能力。此外,在核糖体途径中,我们的研究发现了与30S和50S亚基相关的一组基因的下调(图5E-5G),这种核糖体损伤会导致细菌死亡。 此外,当细菌重要的内部和外部结构被破坏时,支持重要生命过程的能量供应的重要代谢途径TCA循环也被抑制了。作为专性厌氧菌,牙龈卟啉单胞菌主要依靠TCA循环维持和增殖。在使用GNRs@CeO2@PDS处理后,与该循环相关的基因显著下调(图5E和5H),表明强健的ROS环境限制了细菌的能量供应,严重损害了细菌的生存能力。此外,我们的分析表明,TCA循环中丙酮酸转化为乙酰辅酶a的代谢途径与细菌丁酸生物合成途径部分相交,两者之间存在潜在的相互作用动力学,如图5J所示。 图5 使用RNA-seq对GNRs@CeO2@PDS治疗后牙龈卟啉单胞菌生物膜的整体评估 GNRs@CeO2@PDS对牙周感染的体内治疗效果 最后,我们研究了利用GNRs@CeO2@PDS在感染牙周病原体的动物模型中通过PCAT在体内治疗牙周炎的可行性。大鼠牙周炎模型的详细治疗步骤如图6a所示。感染后7天,将不同的纳米材料放入牙周袋,在治疗第一天进行808 nm近红外成像,通过红外成像监测温度变化(图6B-C)。GNRs@CeO2@PDS组在10分钟内达到43.7 ℃的温度,这种最佳光热反应有利于体内生物膜的消耗, 经过14天的治疗方案,在几个组(空白对照组,炎症对照组,PDS, GNRs@PDS, CeO2@PDS, GNRs@CeO2, GNRs@CeO2@PDS)中,显微计算机断层扫描(Micro-CT)提供了上颌磨牙的3D重建(图6D)。通过测量牙骨质连接(CEJ)和牙槽骨嵴(ABC)之间的距离来量化牙槽骨吸收,结果如图6E所示。GNRs@CeO2@PDS组(0.46±0.05 mm)由于光热效应对牙周生物膜的耗散以及•OH和SO4•-对牙周病原体的共同作用,牙槽骨的修复效果最为显著,从而显著降低了致病性,有效地治疗了牙周炎。 为了直观地评估治疗效果,拍摄了大鼠模型的口腔照片。GNRs@CeO2@PDS NCs处理的牙龈组织呈现健康外观,而阳性对照则表现出明显的红肿(图6F)。此外,为了验证活性氧,特别是SO4•-在牙周环境中的功能存在,我们进行了体内荧光分析。如图G所示,利用探针2 ',7 ' -二氯二氢荧光素二乙酸酯(DCFH-DA)来测量•OH和SO4•-的集体活性。添加SO4•-特异性探针NAP进一步增强了荧光,证实了我们之前的观察结果(图6H)。这些结果表明,aPTT和ROS风暴的协同作用不仅减少了牙周组织中的细菌菌落,而且显著缓解了相关的炎症状态。 图6 体内评价不同纳米材料治疗牙周炎的效果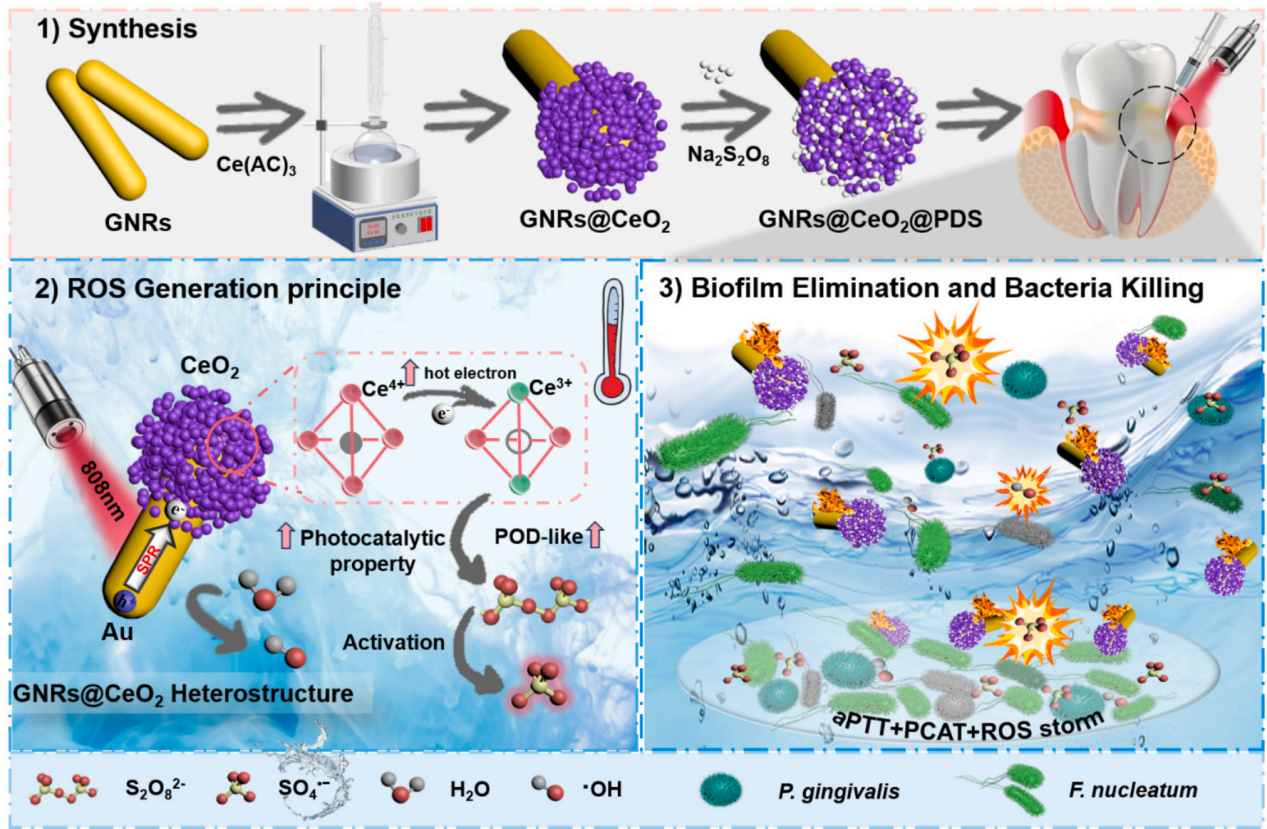
4、研究结论 本研究利用氧化铈(CeO2)纳米酶的过氧化物酶(POD)模拟活性和光催化特性,与等离子体金纳米棒(GNR)的增强概念相结合,开发了一种负载过硫酸盐的半封装核壳GNRs@CeO2 Janus异质结构。在近红外光照射下,GNR产生热电子,从而提高CeO2的类酶活性,并引发一个由 •OH和SO4•- 组成的强大ROS风暴。这种独特的纳米结构促进了功能专门化,其中异质结构和高效的光吸收确保了连续的热电子流,不仅增强了CeO2有效生产SO4•-的类酶活性,还贡献了显著的光热效应,破坏牙周菌斑生物膜进而有效根除病原体。此外,局部温度的升高协同增强了CeO2的POD酶活性。另外,转录组学分析以及动物牙周炎模型的实验表明,病原体在强大的ROS系统中经历遗传信息破坏、代谢紊乱和致病性变化,并在动物牙周表现出显著的抗炎和骨保存的治疗结果。本研究表明,能量转移以增强纳米酶的活性,特别是针对高效ROS的产生,成为了抗菌治疗的一个重要进展。随着进一步研究和试验的开展,这一新技术有望在未来改变牙周病的治疗景观。
原文索引: Li S, Ding Q, Zhang L, Shi F, Liu C, Li T, Shi Y, Qi M, Wang L, Dong B, Song S, Sun J, Kim JS, Li C. Gold core@CeO2 halfshell Janus nanocomposites catalyze targeted sulfate radical for periodontitis therapy. J Control Release. 2024 May 14;370:600-613. doi: 10.1016/j.jconrel.2024.05.016. Epub ahead of print. PMID: 38735394.