2024-07-01

文章题目: Lactobacillus plantarum-Derived Extracellular Vesicles Modulate Macrophage Polarization and Gut Homeostasis for Alleviating Ulcerative Colitis 技术手段:16s rRNA测序、非靶代谢组检测、免疫组织学和qRT-PCR等 江苏大学,龚爱华教授团队在《Agicultural and Food Chemistry》上发表了16s rRNA测序,非靶代谢质谱检测组学方法,阐明了LP-UJS来源的细胞外囊泡(LP-UJS-EVs)对小鼠溃疡性结肠炎(UC)的免疫机制。 本研究的16s rRNA测序分析,非靶代谢组检测分析和部分数据分析工作由上海派森诺生物科技股份有限公司完成。
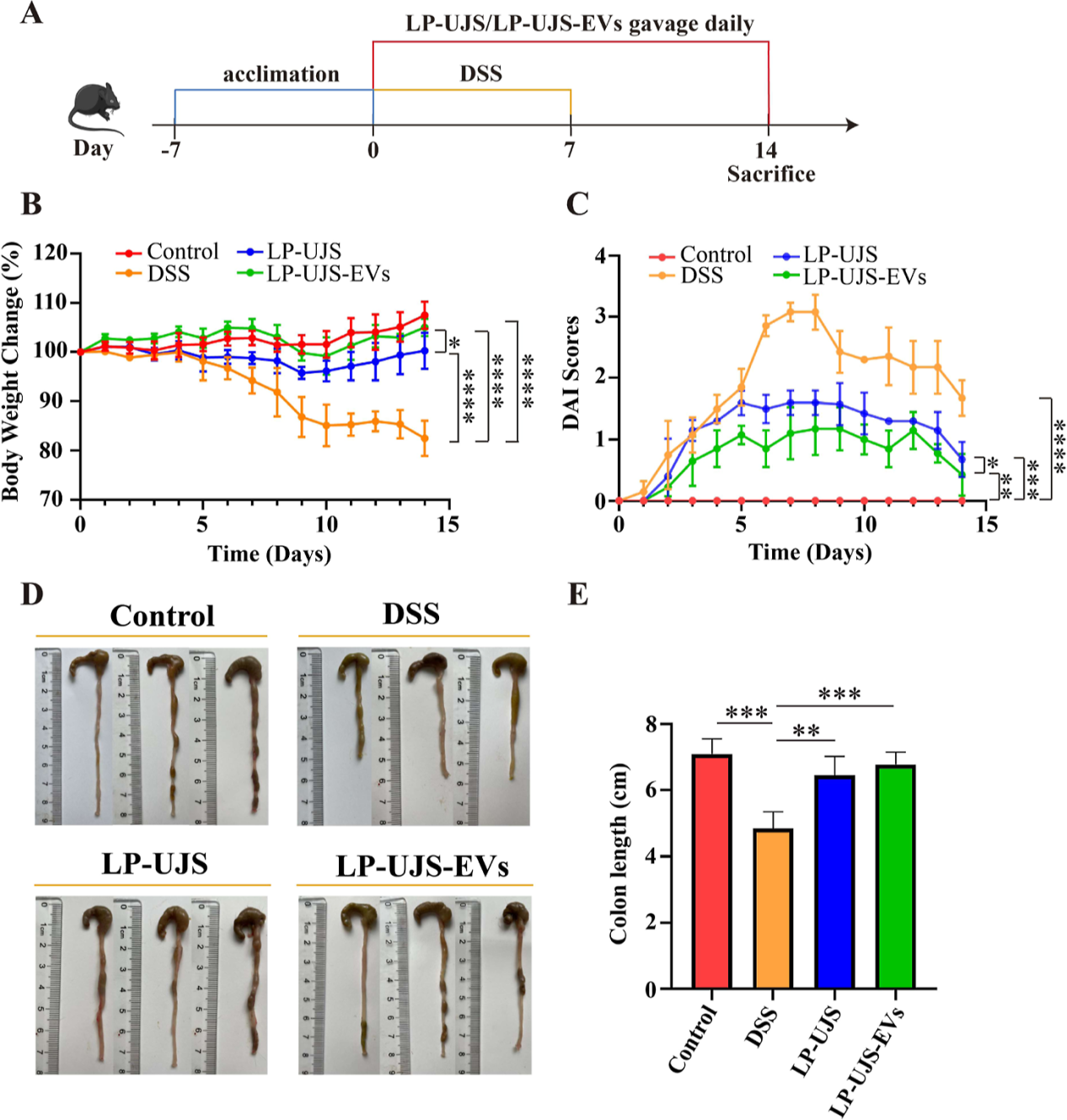
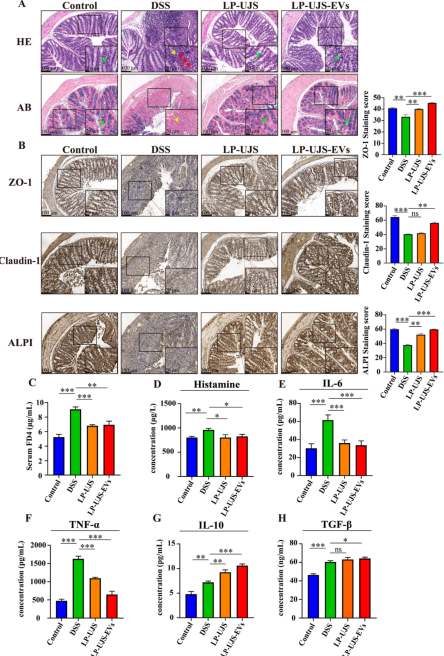
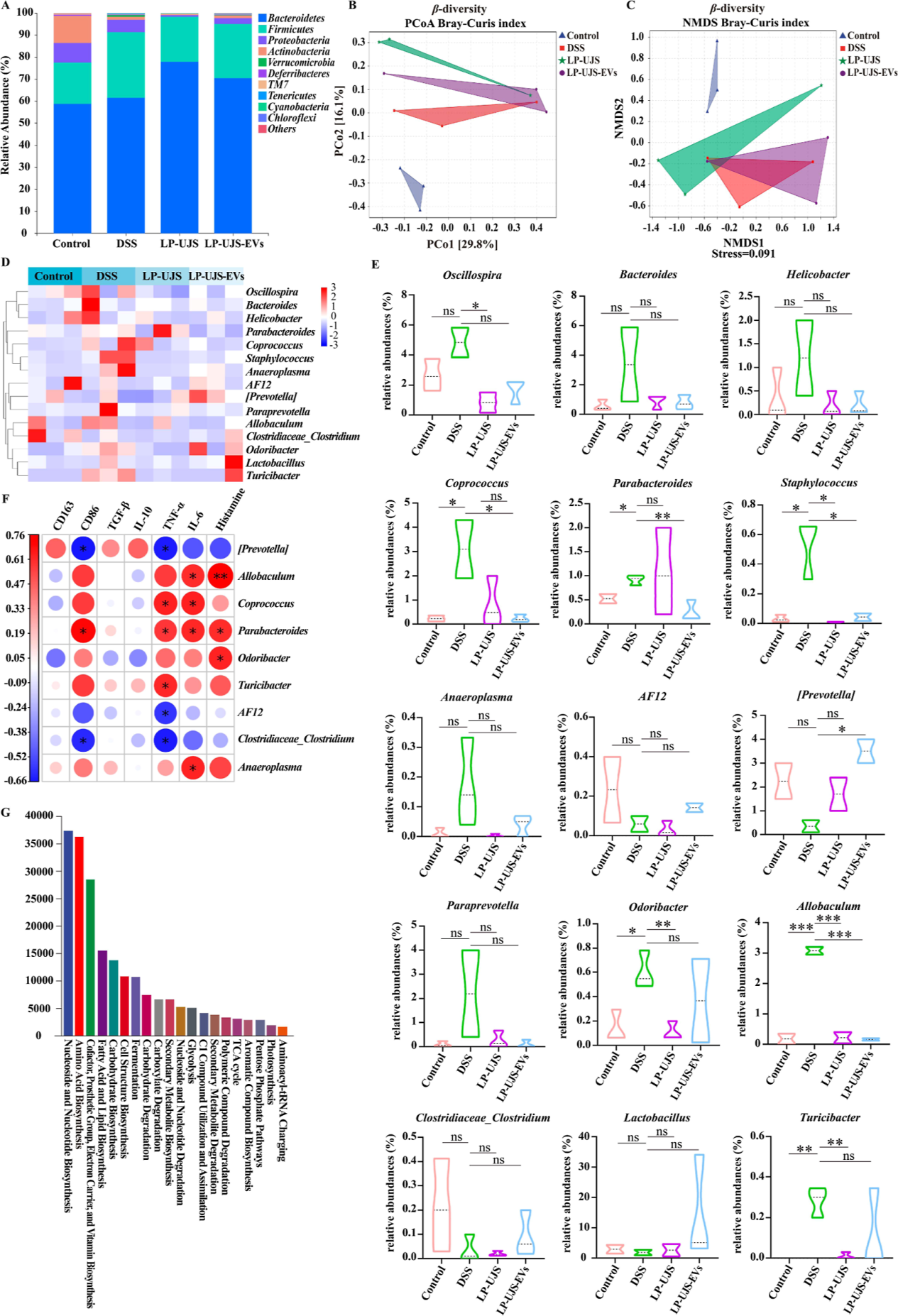
研究背景 溃疡性结肠炎(UC)是一种复杂的、动态的胃肠道疾病,UC的一个关键标志是肠道菌群组成的改变,专注于恢复肠道菌群平衡的策略是治疗干预的关键方面。 近年来,益生菌胞外囊泡(EVs)在生物医学上的应用引起了人们的极大兴趣。最近的报道强调了植物乳杆菌衍生的EV的免疫调节和抗炎作用,表明了解这些EV在形成免疫反应中的作用是很重要的。此外,益生菌EVs除了影响免疫应答外,还具有调节肠道菌群和纠正肠道疾病的双重作用。 本研究探讨了L. plantarum UJS001 (LP-UJS)衍生EV ((LP-UJS-EVs)缓解UC的机制。根据我们的研究结果,LP-UJS-EV治疗促进肠道屏障的修复,诱导巨噬细胞M2极化,上调白细胞介素-10 (IL-10)和转化生长因子β (TGF-β)调节肠道菌群组成,影响赖氨酸代谢途径。对EVs作用的探索为益生菌特别是其囊泡成分在UC治疗中的应用提供了一个新的视角。 主要研究结果 1.LP-UJS的纯化、鉴定及表征 本研究对菌株进行了初步纯化和鉴定。利用特异性引物扩增分离菌株的16S rDNA,发现分离菌株与L的相似性为99%。此外,系统发育树显示,菌株LP-UJS001与L. plantarum在同一分支,因此被鉴定为L. plantarum(图1D)。随后,从LP-UJS培养上清液中通过过滤浓缩(FC)联合超离心分离出EV。观察到,LP-UJS-EV为球形双层膜结构(图1E),带负电荷(图1F),此外,以每1010个颗粒3mg /mL的浓度检测LP-UJS-EV蛋白(图1G)。经FC和离心处理后,获得更高浓度的EV(图1H)。 图1:LP-UJS的纯化和鉴定 2.LP-UJS-EVs促进肠上皮细胞生长和巨噬细胞M2极化 为了探讨不同浓度的LP-UJS-EVs在炎症条件下对正常肠上皮细胞活性和巨噬细胞极化的影响。研究结果显示,LP-UJS-EVs促进HCoEpiC和IEC-6细胞的生长呈浓度依赖性,并且根据巨噬细胞M2标志物CD163、IL-10、TGF-β 的mRNA水平变化量,确认了在0.3 mg/mL时效果最显著(P < 0.05)(图2)。 图2:LP-UJS-EVs促进肠上皮细胞生长和巨噬细胞m2极化 3.LP-UJS-EVs减轻DSS诱导的小鼠UC 为了研究LP-UJS-EVs对UC的影响,通过1周DSS诱导建立UC模型,并在模型建立后开始治疗(图3A)。 根据体重变化评分,DAI和结肠长度评估小鼠UC程度。从第5天到第10天,其他三组小鼠的体重均较对照组下降,其中DSS组体重下降最明显(P < 0.0001)。从第11天到第14天,LP-UJS组和LP-UJS- EV组小鼠体重逐渐增加(P < 0.001)(图3B),其中LP-UJS- EV组小鼠体重增加更为显著(P < 0.05)。此外,DSS组的DAI评分高于其他三组。值得注意的是,LP-UJS-EVs组DAI评分略低于LPUJS组(P < 0.05)(图3C)。 以上结果表明,LP-UJS和LP-UJS- ev均能有效治疗UC,且LP-UJS- ev效果优于LPUJS。 图3:LP-UJS-EVs可减轻DSS诱导的小鼠UC 4.LP-UJS-EVs修复UC小鼠肠道屏障 本研究为了评估和比较LP-UJS-EVs处理对DSS诱导UC小鼠肠道屏障的影响,采用HE和Alcian染色进行组织学分析。 结果显示,P-UJS和LP-UJS-EVs均能显著恢复UC小鼠杯状细胞的数量,改善结构破坏,减少炎症细胞的浸润(图4A)。此外,免疫组化染色结果显示,LPUJS和LP-UJS-EVs均能恢复ZO-1、cludin -1和ALPI的表达,修复组织损伤,且LP-UJS-EVs效果优于LP-UJS (P < 0.01)(图4B)。血清FITC -葡聚糖4 (FD4)浓度表明,LP-UJS和LP-UJS-EVs均能显著降低DSS引起的肠黏膜通透性增加(P < 0.01)(图4C)。LP-UJS-EVs组大鼠血清IL-10、TGF-β浓度显著高于DSS组(P < 0.01)。LP-UJS-EVs组IL-6、TNF-α、组胺水平明显低于DSS组(P < 0.05)(图4D-H) 综上,LP-UJS和LP-UJS-EVs在降低炎症引起的肠通透性增加、修复肠黏膜结构、抑制炎症进展等方面均有显著作用。并且LP-UJS-EVs的效果优于LP-UJS。 图4:LP-UJS-EVs修复UC小鼠肠道屏障 5.LP-UJS-EVs通过驱动巨噬细胞M2极化减轻肠道炎症 观察到LP-UJS-EVs对DSS诱导的 UC小鼠的治疗作用与免疫应答之间的相关性,并观察到LP-UJS-EVs治疗UC小鼠MLNs中CD4+/CD8+ T细胞比例降低的逆转(P < 0.05)(图5A)。与DSS组相比,LP-UJS组和LP-UJS- ev组Treg细胞比例均降低(P < 0.01)。 进一步分析巨噬细胞比例,DSS组M1巨噬细胞较对照组显著增加(P < 0.05)。LP-UJS和LP-UJS- ev治疗后,M1巨噬细胞比例显著降低(P < 0.01),且LP-UJS- ev组比LP-UJS组下降更明显。相比于DSS组,CD163+ M2巨噬细胞的比例LP-UJS组和LP-UJS- EV组均显著升高(P < 0.01),其中LP-UJS- ev组升高更为明显(P < 0.001)。值得注意的是,LP-UJS-EVs组M2巨噬细胞的比例与对照组相比增加了约6倍,与DSS组相比增加了近3倍。这强调了驱动巨噬细胞M2极化是LP-UJS-EVs减轻UC小鼠炎症的关键机制,且LP-UJS-EVs的效果优于LP-UJS (P < 0.05)(图5C)。 图5:LP-UJS-EVs通过驱动巨噬细胞M2极化减轻肠道炎症 6.LP-UJS-EVs对UC小鼠肠道菌群组成的影响 在确定了LP-UJS-EVs的免疫调节作用后,本研究试图通过16S rRNA基因序列分析来研究它们对UC小鼠肠道微生物群的潜在影响。拟杆菌门和厚壁菌门是小鼠肠道中相对丰度最高的两个门。与其他三组相比,DSS组Bacteroidetes与Firmicutes的比例最低,Verrucomicrobia的相对丰度最高,而LP-UJS-EVs组Chloroflexi的相对丰度最高(图6A)。其次,通过β-多样性分析分析不同组间的多样性差异。基于Bray - Curtis指数的主坐标分析(PCoA)表明,DSS组与LP-UJS和LP-UJS-EVs组有显著差异。PC1占总变化的29.8%,PC2占16.1%(图6B)。此外,非度量多维尺度(NMDS)显示出与PCoA结果相似的结果,应力值为0.091(图6C)。值得注意的是,当应力小于0.2时,NMDS分析结果被广泛认为是更可靠的。因此,PCoA和NMDS分析都是可靠的。 物种组成热图上看,DSS组Coprococcus、parabobacteroides、Staphylococcus、Odoribacter、Allobaculum和Turicibacter的丰度显著高于对照组(P < 0.05)。LP-UJS-EVs治疗导致Coprococcus、parabobacteroides、Staphylococcus和Allobaculum丰度显著下降,恢复了与对照组相似的组成形式(图6D,E)。 根据细菌标记基因单独测序数据进一步预测功能单元组成,发现最丰富的三个功能通路是核苷和核苷酸生物合成、氨基酸生物合成以及辅因子、假基、电子载体和维生素生物合成(图6G)。为了研究肠道菌群、炎症物质和M1/M2巨噬细胞标志物蛋白表达之间的潜在相关性,相关性分析结果显示,Prevotella和Clostridiaceae_Clostridium的丰度与TNF-α和CD86的表达呈负相关(P < 0.05), AF12的表达与TNF-α呈负相关(P < 0.05)。相反,副拟杆菌的丰度与组胺、IL-6、TNF-α、CD86的表达呈正相关(P < 0.05),异杆菌与组胺、IL-6的表达呈正相关(P < 0.05),粪球菌与IL-6、TNF-α的表达呈正相关(P < 0.05), Turicibacter与TNF-α的表达呈正相关(P < 0.05)(图6F)。 图6:LP-UJS-EVs对UC小鼠肠道菌群组成的影响 7.LP-UJS-EVs影响UC小鼠粪便代谢组学 为了阐明LP-UJS-EVs对UC小鼠代谢的潜在影响,对小鼠粪便样本进行了非靶代谢组学检测,通过对LP-UJS组和DSS组之间以及LP-UJS- ev组和DSS组之间差异代谢物的富集分析,发现通路赖氨酸降解是两个比较组中最关键的共同代谢通路(图7B,C)。 此外,两个比较组共有13个共同差异代谢物,其中上调4个,下调9个(P < 0.05, VIP > 1, fold change >2或<0.5)(图7D)。在两组的13种共有差异代谢物中,LP-UJS和LP-UJS-EV处理显著提高了1-棕榈酰甘油磷胆碱、3-酮鞘醇、氧己酸、香草扁桃酸、n1乙酰亚精胺、3-羟基苄基醇糖苷、12OPDA、25-羟基胆固醇和GMP水平(P < 0.05)。相反,别嘌呤醇、甲氧二烯、二十二碳六烯酸和氯氰菊酯水平明显下调(P < 0.05)。 肠道微生物菌群与代谢物之间的相关性分析结果显示,葡萄球菌与n1 -乙酰精胺和氧己二酸呈负相关(P < 0.05)(图7F)。这些发现强调了葡萄球菌和肠道代谢物(如n -乙酰精胺和氧己二酸)在UC小鼠炎症发病机制中的重要作用。 图7:LP-UJS-EVs对UC小鼠粪便代谢水平的影响 研究结论 最近的研究表明,多种乳杆菌种类分泌的EV可以促进动物模型炎症性肠病的恢复。植物EVs在体外实验中可诱导巨噬细胞M2极化22,但在体内是否也能诱导巨噬细胞M2极化尚无文献报道。在这项研究中。作者全面从体内和体外研究揭示了LP-UJS-EVs在协调巨噬细胞向M2表型极化和调节免疫反应方面的实质性影响。 UC的发展与肠道微生物群多样性的减少和病原体丰度的增加有着复杂的联系,本研究,将特定细菌与炎症标志物联系起来的相关性分析为肠道生态系统内复杂的相互作用网络提供了有价值的见解,LP-UJS-EVs选择性影响益生菌和致病菌丰度的能力为靶向治疗干预开辟了道路,并为UC治疗提供了个性化的方法。 一些研究证明,肠道菌群在人体赖氨酸代谢中起着重要作用,本研究也验证了这一结论,并且通过微生物菌群和代谢组相关性分析,发现了差异代谢物n1 -乙酰精胺与葡萄球菌之间呈现显著负相关,n1 -乙酰精胺在治疗结肠炎和增强对癌症(包括结肠癌)的抵抗力方面具有显著的治疗作用。经LP-UJS-EVs治疗后,观察到n1 -乙酰精胺水平显著升高,这间接证实了肠道微生物群组成和代谢物的调节是LP-UJS-EVs发挥其治疗作用的关键途径。 总体而言,本研究在EV水平上对LP-UJS治疗UC的机制有了全面的了解,此外,LP-UJS-EVs与氧己二酸和巨噬细胞极化之间的关联为进一步探索开辟了道路,并可能为治疗肠道炎症性疾病的创新治疗策略提供新的途径。 原文链接:https://pubs.acs.org/doi/10.1021/acs.jafc.4c01758