2024-08-02

四川大学华西医院钱志勇团队在国际著名杂志《Signal Transduction and Targeted Therapy》发表题为“Genetically programmable cell membrane-camouflaged nanoparticles for targeted combination therapy of colorectal cancer”的研究论文,该研究介绍了一种称为MPB-3BP@CM NPs的细胞膜仿生纳米药物平台,为结直肠癌的靶向治疗提供了一种全新高效的策略,影响因子40.8分。本研究的RNA-seq测序以及部分分析工作由上海派森诺生物科技股份有限公司完成。 1、技术路线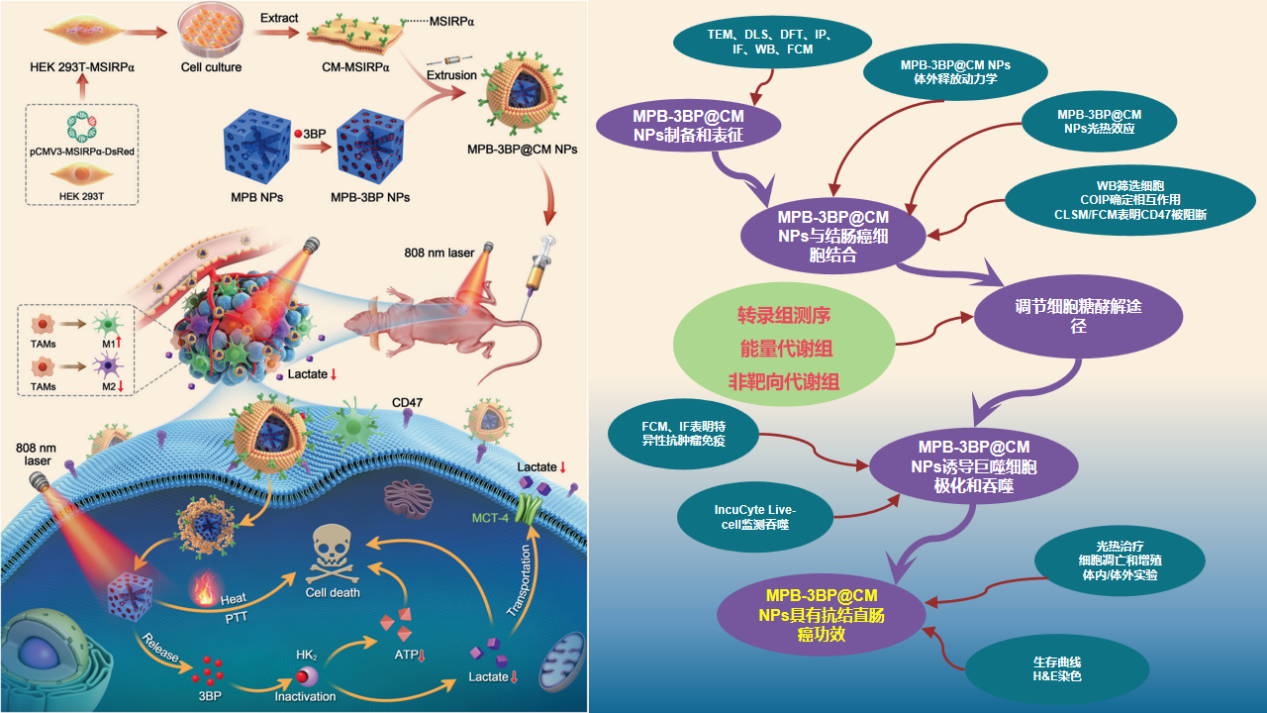
2、研究背景
由于CRC(结直肠癌)早期无症状,因其高发病率和高死亡率,预计到2030年,全球发病例将超过220万例,死亡人数将达到110万例。目前,手术干预联合化疗和放疗是中晚期结直肠癌的主要策略。虽然传统的治疗方法有一定的效果,但副作用明显。因此,迫切需要设计更安全、更有效的结直肠癌治疗方法。 3、研究材料与方法
1. 实验材料、结直肠癌细胞系HCT116
2. 测序平台、Illumina novaseq6000
3. 分析方法、RNA-Seq (https://www.genescloud.cn)、能量代谢组、LC-MS,TEM、DLS、DFT、IP、IF、WB、ELISA、FCM等 4、研究结果
1. MPB-3BP@CM NPs的制备和表征 制备MPB-3BP@CM NP的第一步是合成MPB NPs ,然后将3BP加载到MPB NPs腔中,得到MPB-3BP NPs。研究进一步制备、纯化了CM-MSIRPα,然后将其涂覆在MPB-3BP NPs的表面,得到MPB-3BP@CM NPs。 图1. MPB-3BP@CM NPs的表征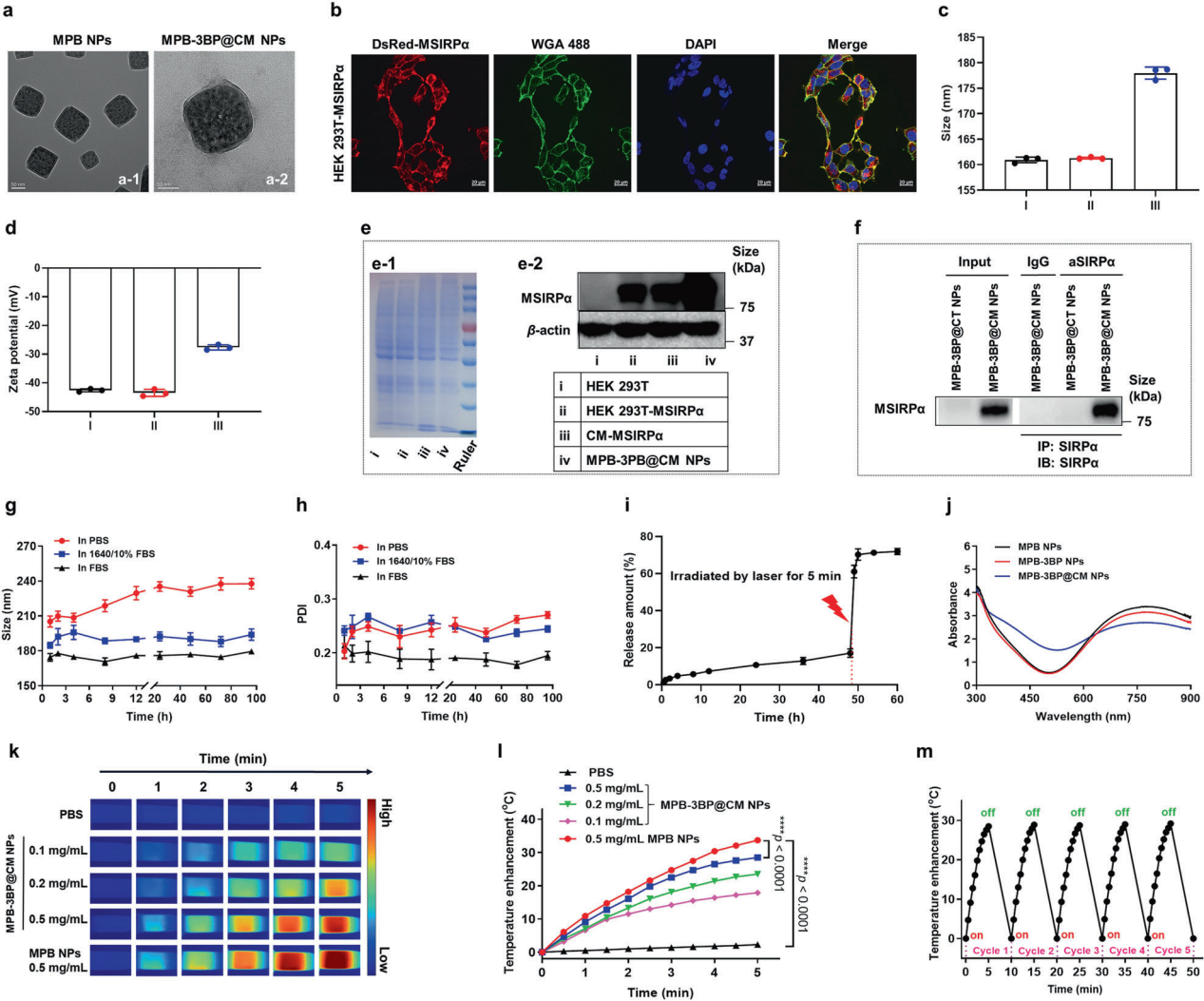
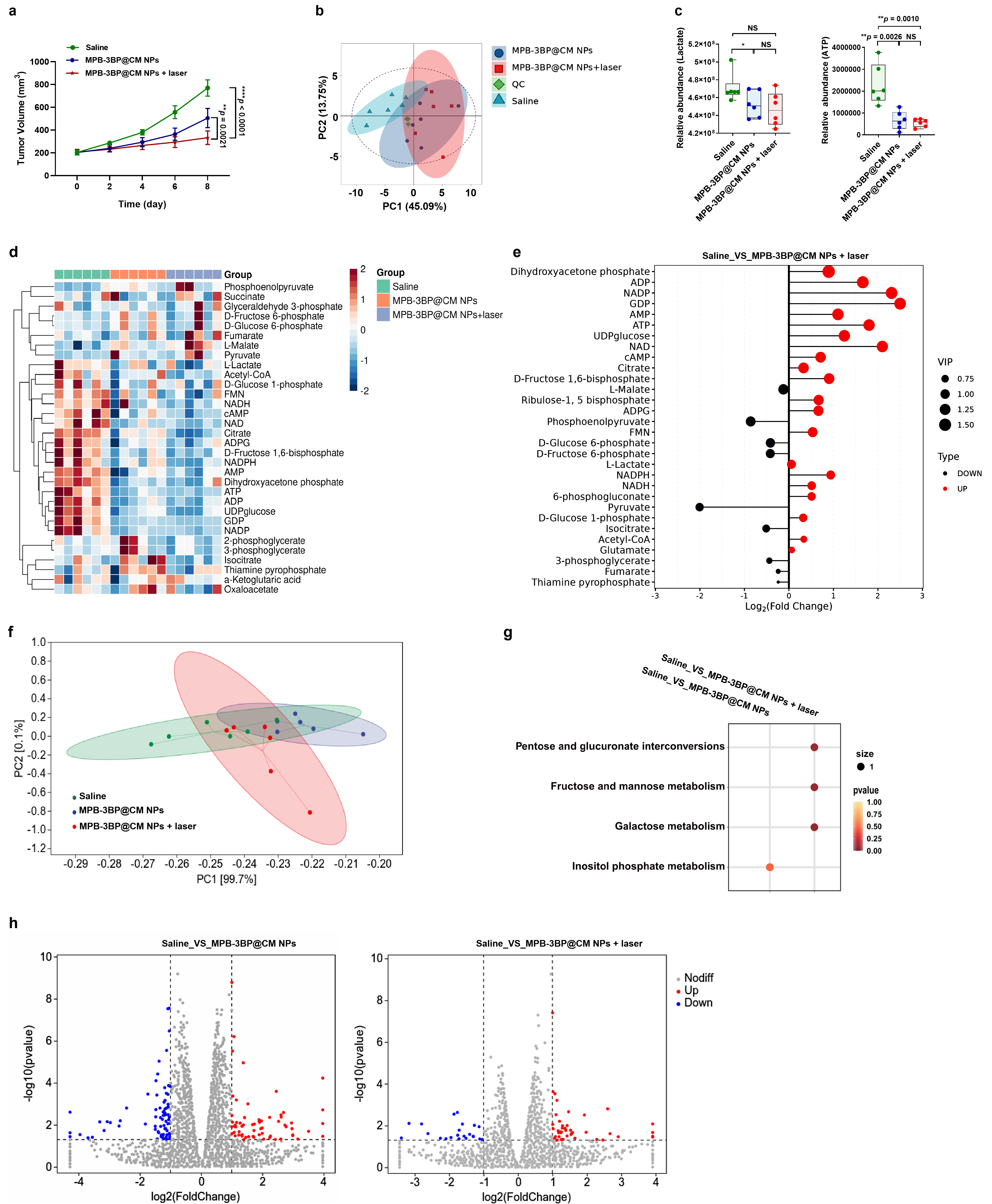
2. 细胞结合与细胞摄取 为了研究MPB-3BP@CM NPs是否可以通过MSIRPα-CD47相互作用与CRC细胞结合,通过WB实验选择细胞系HCT116(图2b),然后在体外培养MPB-3BP@CM NPs,结果显示,在孵育2小时后,MPB-3BP@CM NPs与HCT116细胞的细胞膜表面有牢固的结合。此外,共免疫沉淀法(CO-IP)进一步证实MSIRPα与CD47之间的分子相互作用。总的来说,这些结果证实了MPB-3BP@CM NPs通过MSIRPα和CD47的结合进而与HCT116细胞之间产生有效的相互作用(图2e-f)。 图2 MPB3BP@CM NPs的作用途径 3. 体外细胞毒性及抗肿瘤效果 在体内治疗前,先对MPB-3BP@CM NPs进行体外细胞毒性评价。溶血试验和甲基噻唑四氮唑(MTT)试验均证实其良好的血液和生物相容性。然后将MPB-3BP@CM NPs作为光热剂,用于近红外激光照射下的体外癌细胞消融,结果显示MPB-3BP@CM NPs联合激光照射具有较强的抗癌活性,通过IF和FCM实验(图2g)评估各种处理对细胞活力的影响,14小时后细胞表现出明显的凋亡,同时ATP和乳酸水平显著降低。研究结果表明,MPB3BP@CM NPs具有调节肿瘤糖酵解代谢的能力,并有效地减弱HCT116细胞中ATP和乳酸的产生(图2g-i)。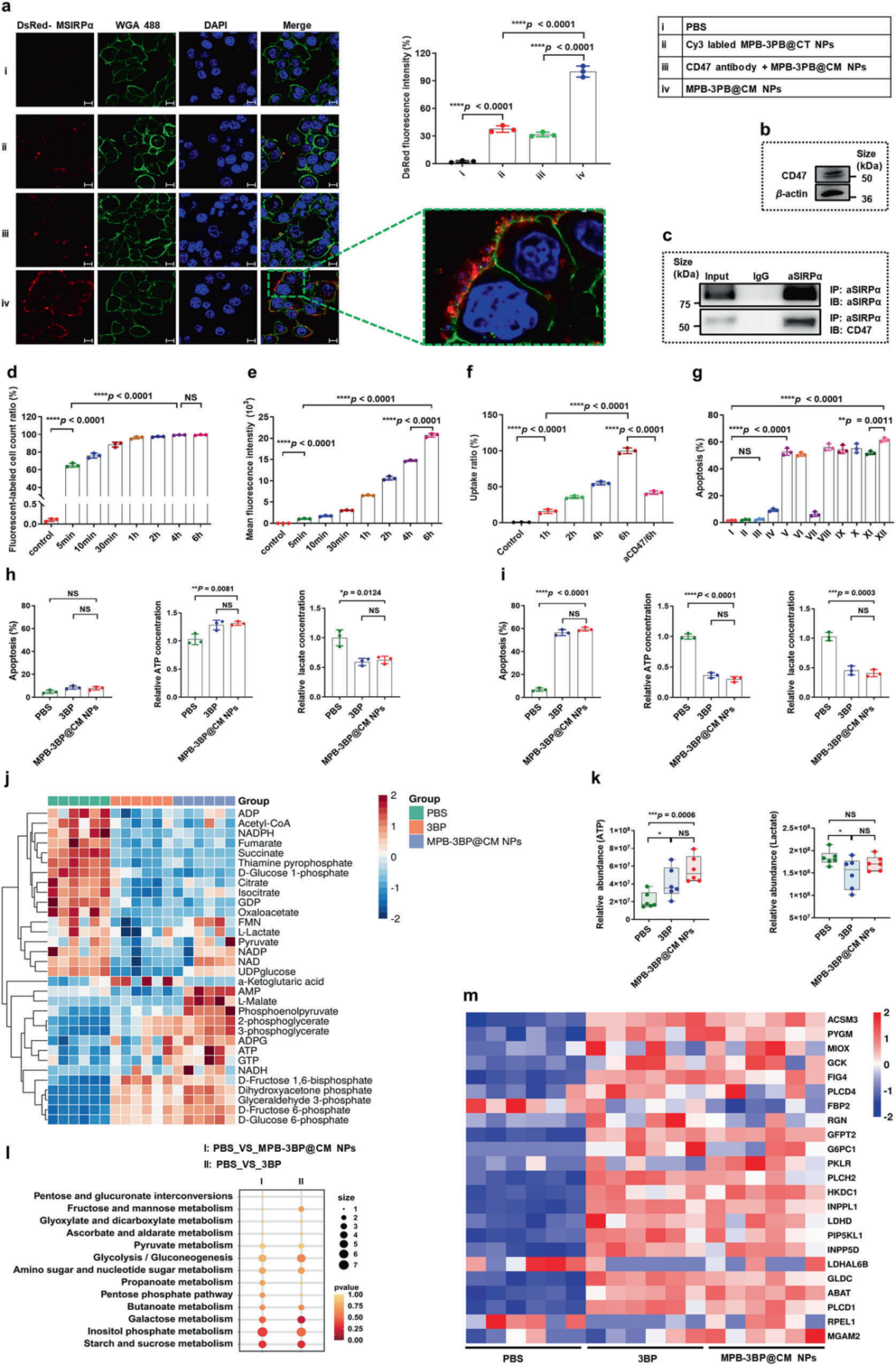
4. 细胞糖酵解途径的调节 大多数肿瘤细胞被认为依赖于有氧糖酵解来满足高能量和生物质的需求。为了验证MPB-3BP@CM NPs抑制了肿瘤糖酵解途径,研究评估了MPB-3BP@CM NPs治疗后不同时间培养的HCT116细胞中ATP和乳酸水平。另外还对MPB3BP@CM NPs (200 μg/mL)作用8小时的HCT116细胞进行了代谢组分析和转录组分析(图2j-m,图3,4)。KEGG通路分析结果显示差异表达基因主要富集在蔗糖代谢、肌醇磷酸代谢、糖酵解/糖异生和半乳糖代谢等通路上。这些结果进一步证明了MPB-3BP@CM NPs组中葡萄糖代谢物的差异。总之,体外和体内研究一致表明MPB-3BP@CM NPs能有效调节肿瘤糖代谢。 图3.代谢组结果 图4.RNA-seq及LC-MS结果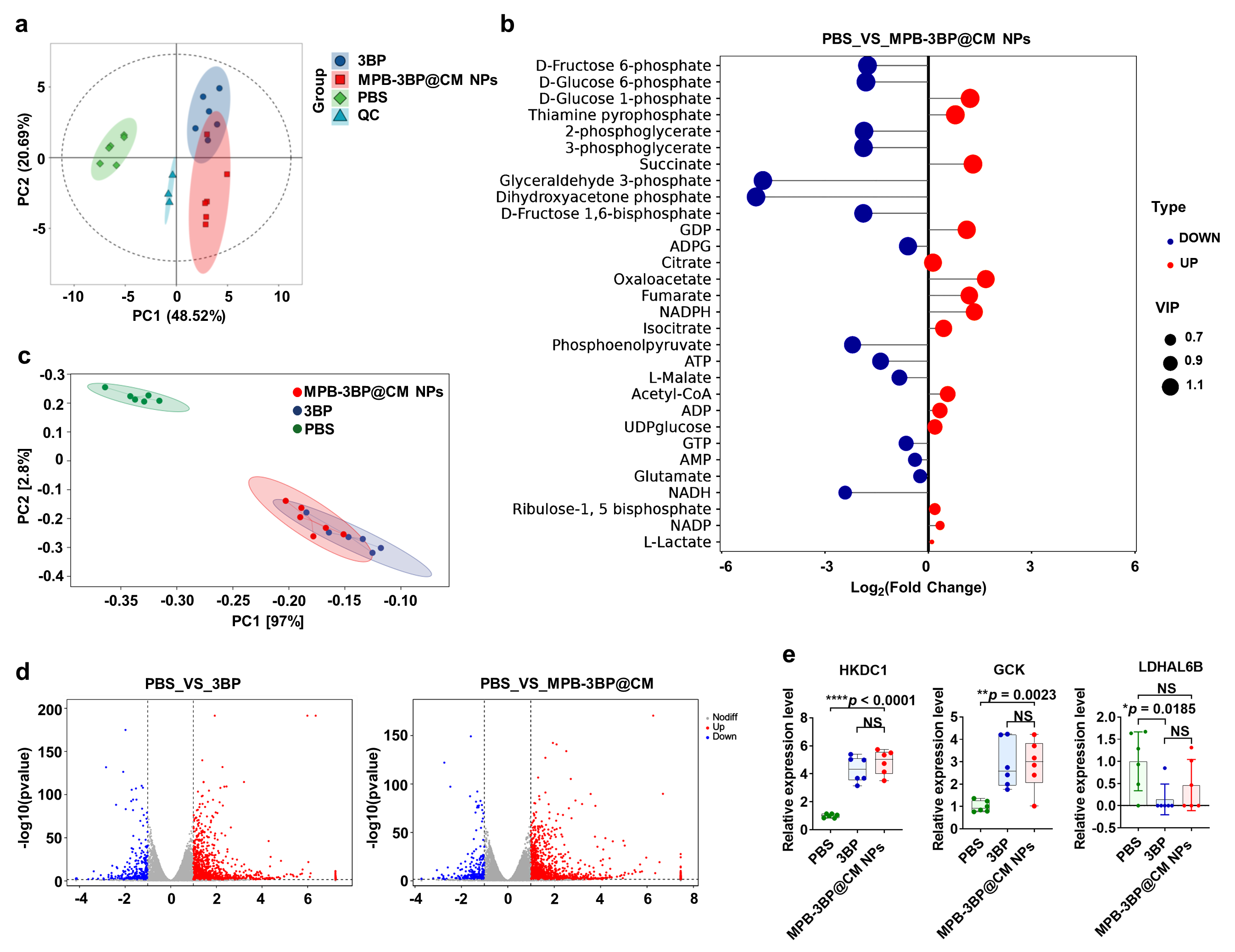
5. 诱导免疫反应和体内抗肿瘤 肿瘤微环境(TME)中乳酸水平升高与促进血管生成、转移和免疫抑制有关,然而MPB-3BP@CM NPs能抑制HCT116细胞乳酸生成,所以研究又分别检测了MPB-3BP@CM NPs在体外/体内诱导的巨噬细胞极化和吞噬作用(图5)。结果表明MPB-3BP@CM NPs均可诱导强效免疫反应。随后作者又对MPB-3BP@CM NPs的药代动力学、组织分布和肿瘤富集情况(图6),以及MPB-3BP@CM NPs的抗结直肠癌功效进行了进一步研究。结果显示,使用MPB-3BP@CM NPs后能显著延长生存时间,毒性也没有蔓延全身,表明MPB-3BP@CM NPs对结直肠癌具有良好的疗效和安全性。 图5.MPB-3BP@CM NPs在体外/体内诱导的巨噬细胞极化和吞噬作用 图6.MPB-3BP@CM NPs的药代动力学、组织分布和肿瘤富集情况 5、小 结 本研究开发了一种新型细胞膜仿生纳米药物平台MPB-3BP@CM NPs,该纳米平台可通过阻断CD47,显著增强巨噬细胞对CRC细胞的吞噬能力,为治疗结肠癌提供了更有效更安全的新方法,也为其他癌症疾病的治疗提供了新思路。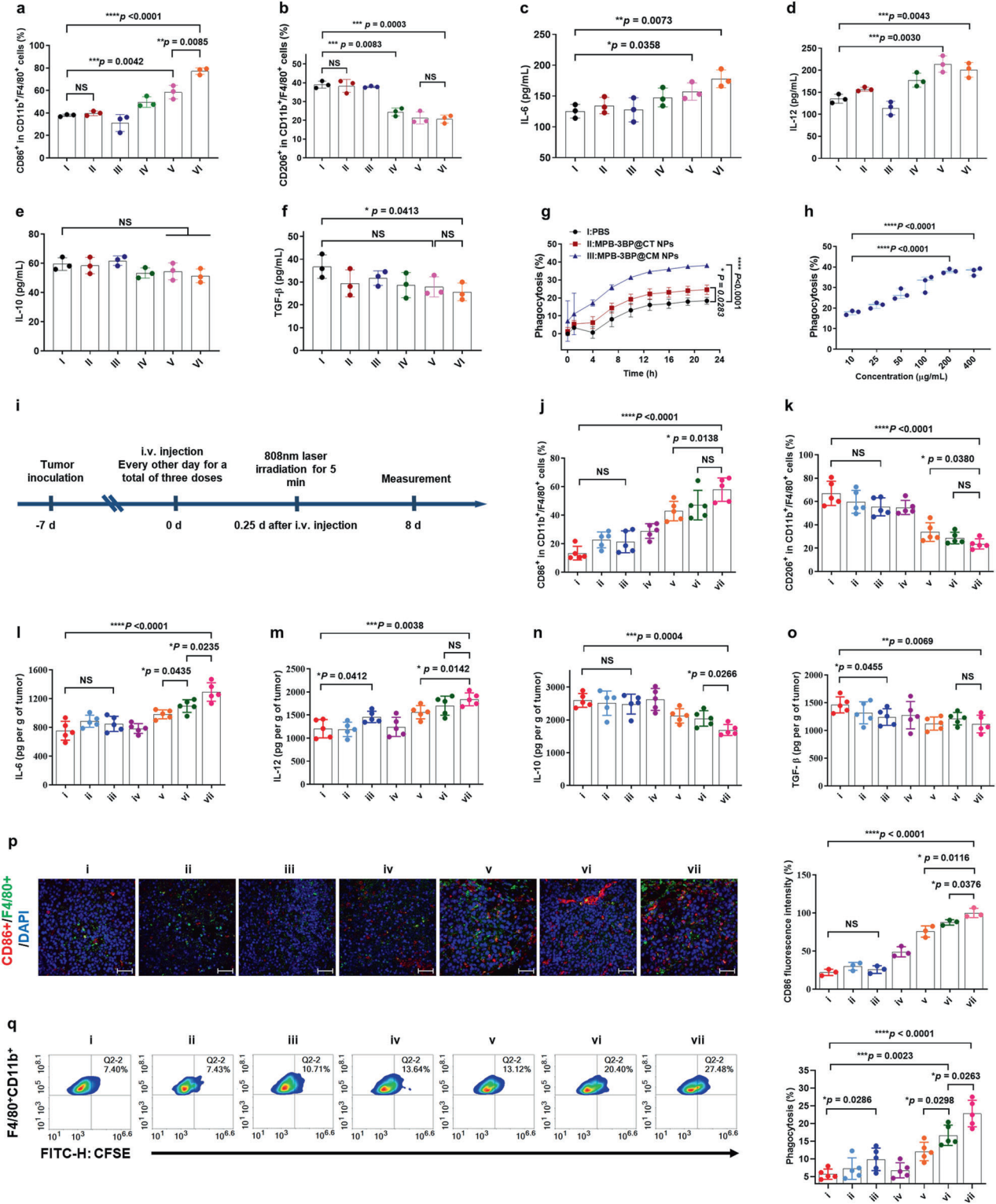

原文链接:https://doi.org/10.1038/s41392-024-01859-4


