
2024-08-12

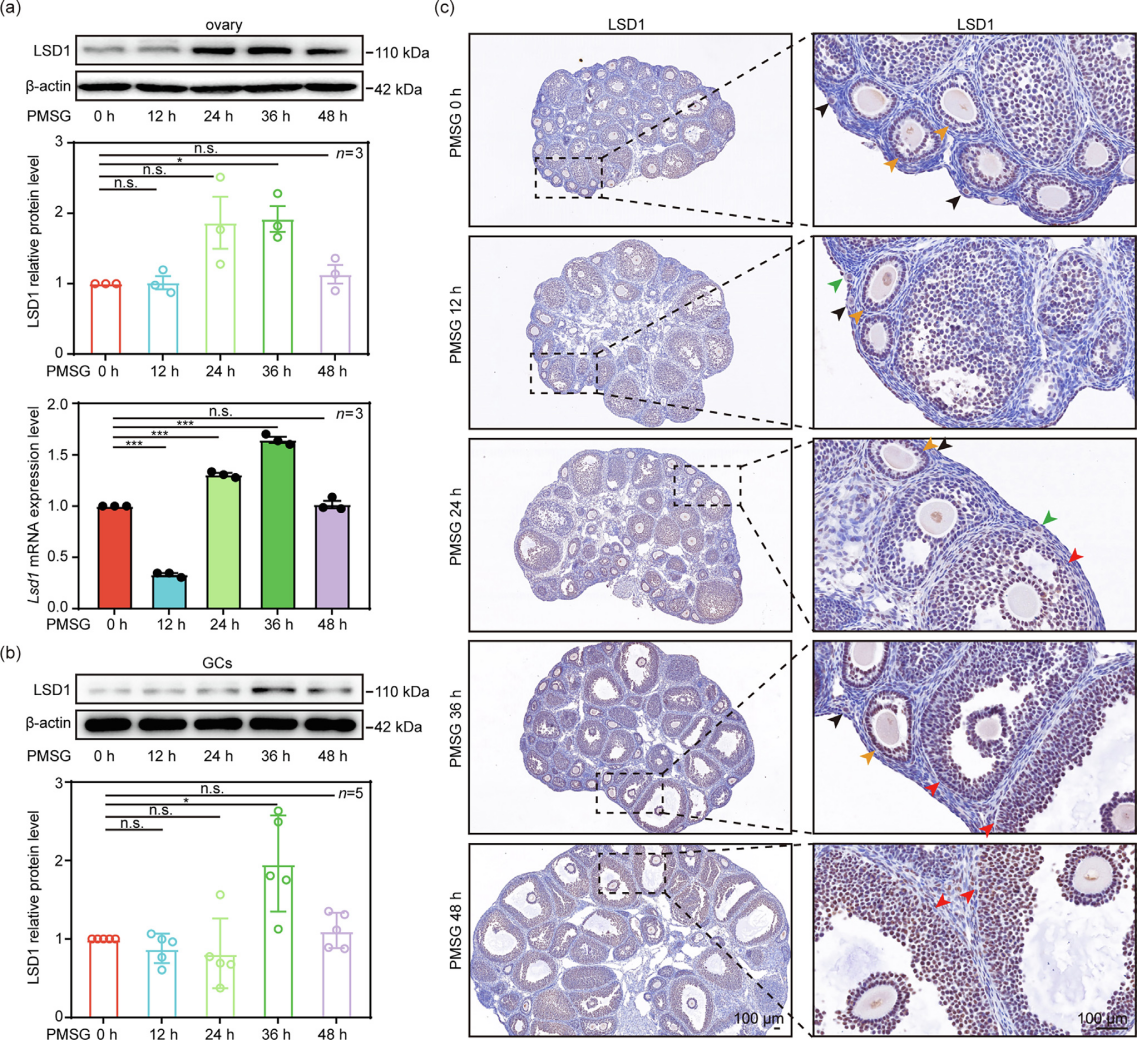
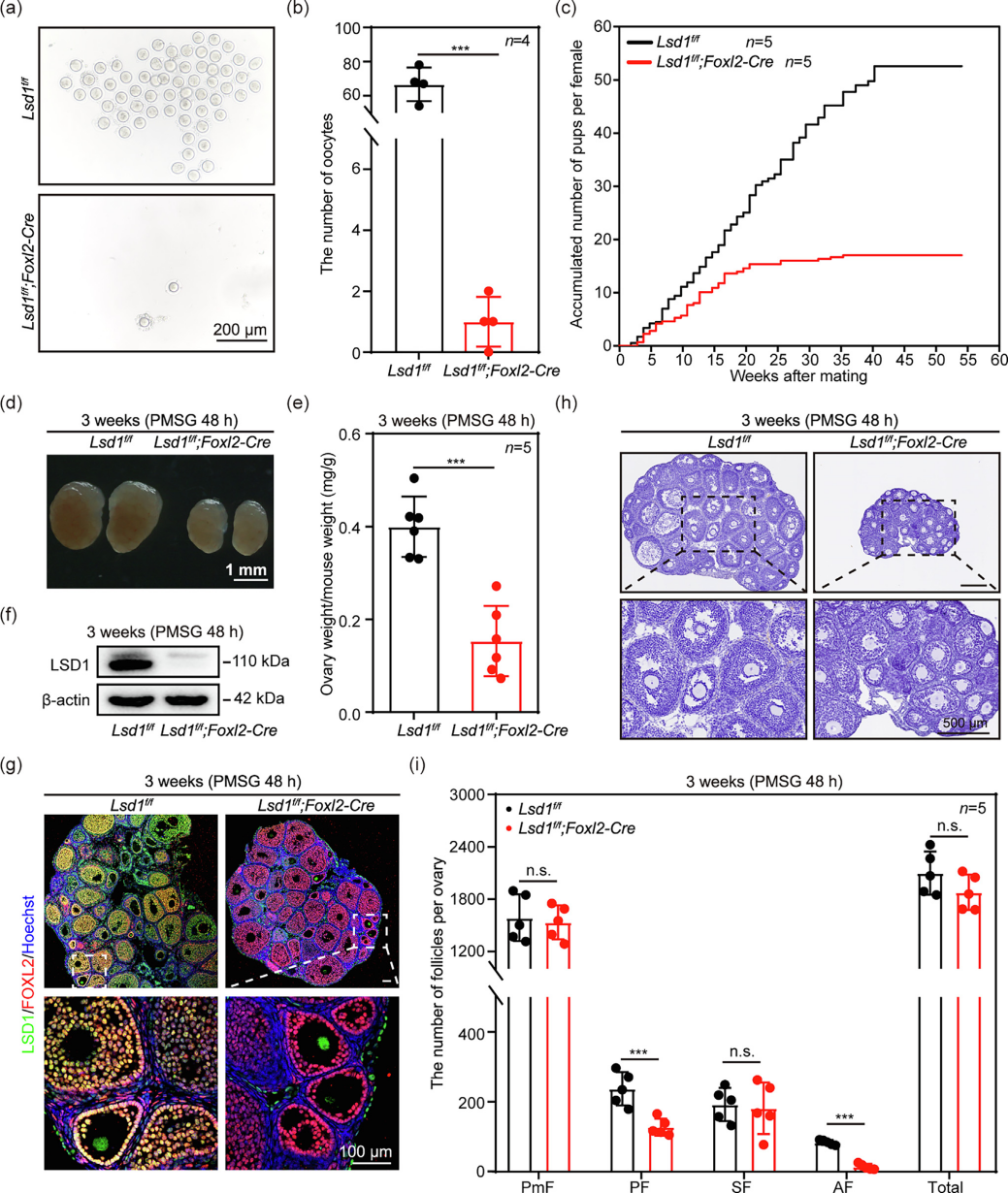
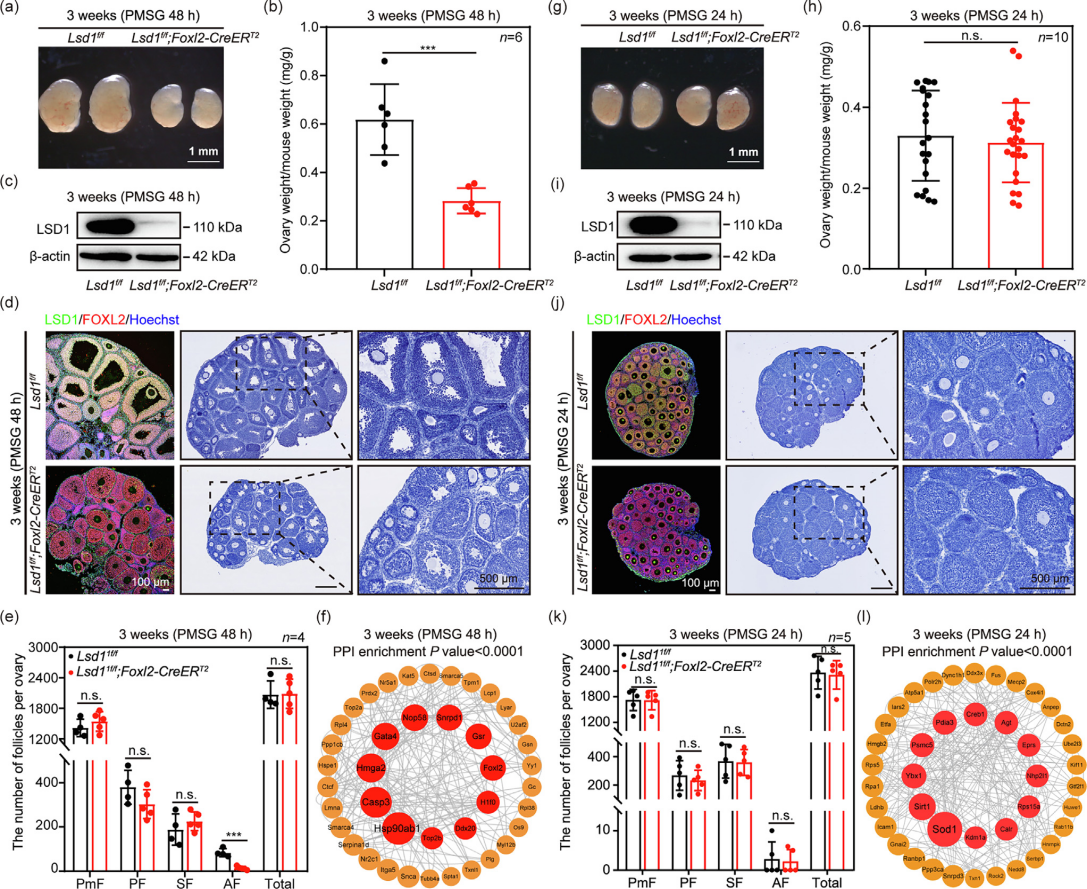
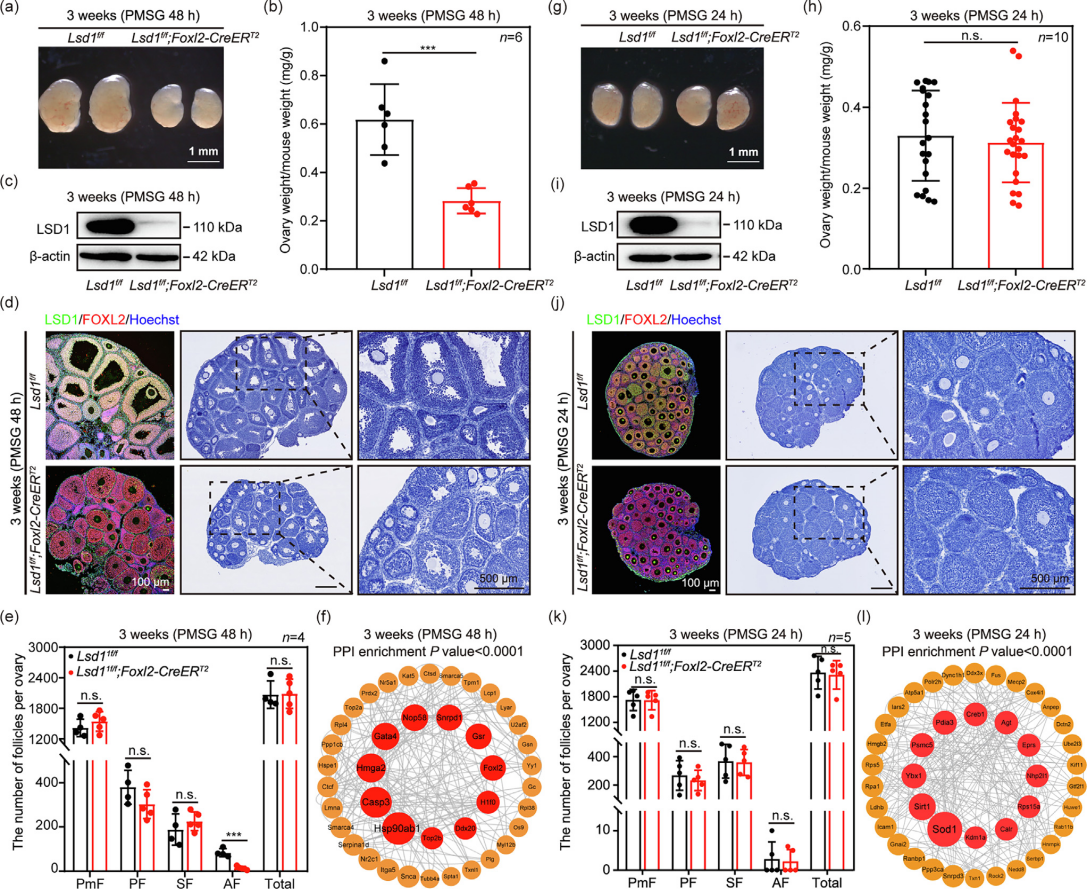
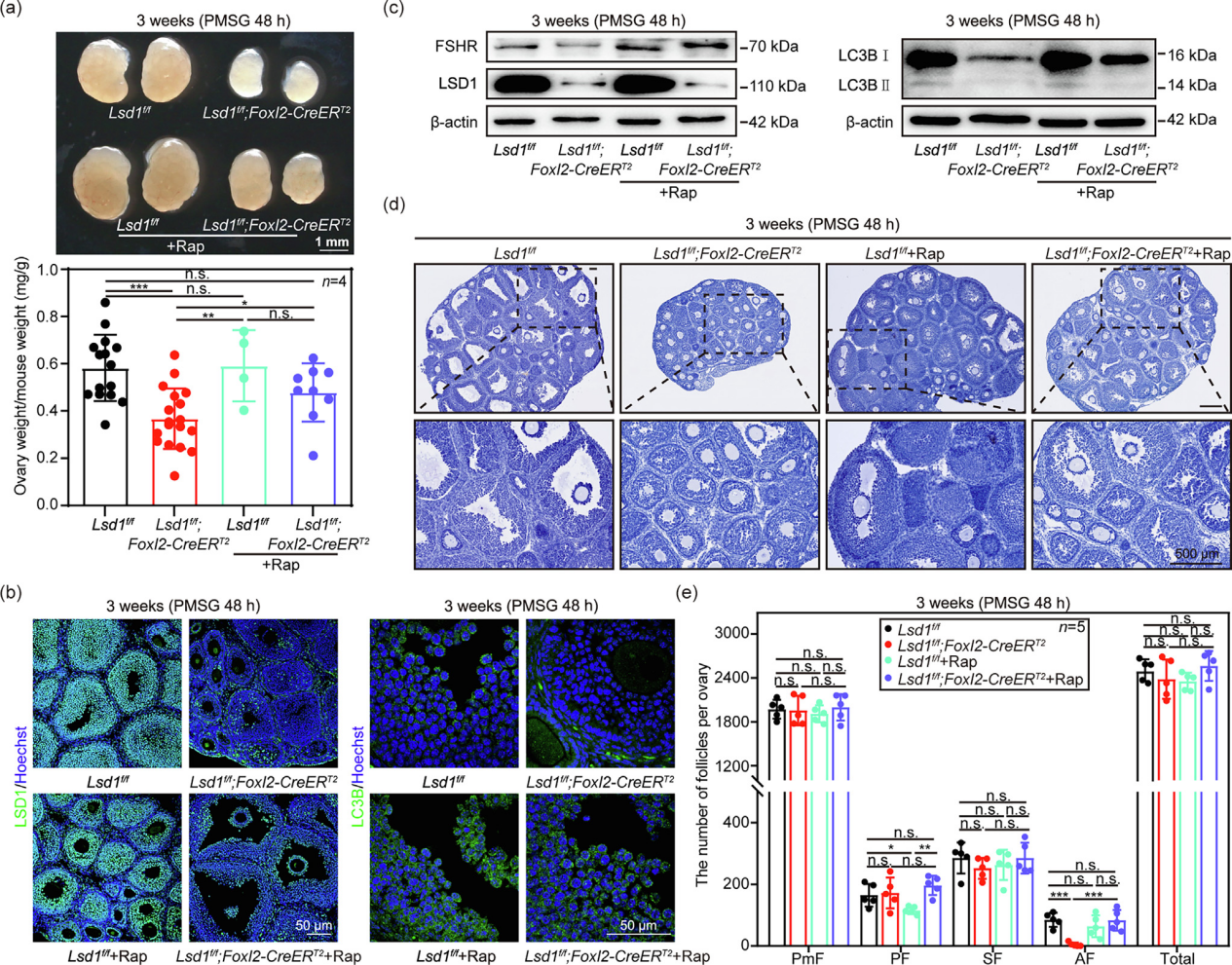
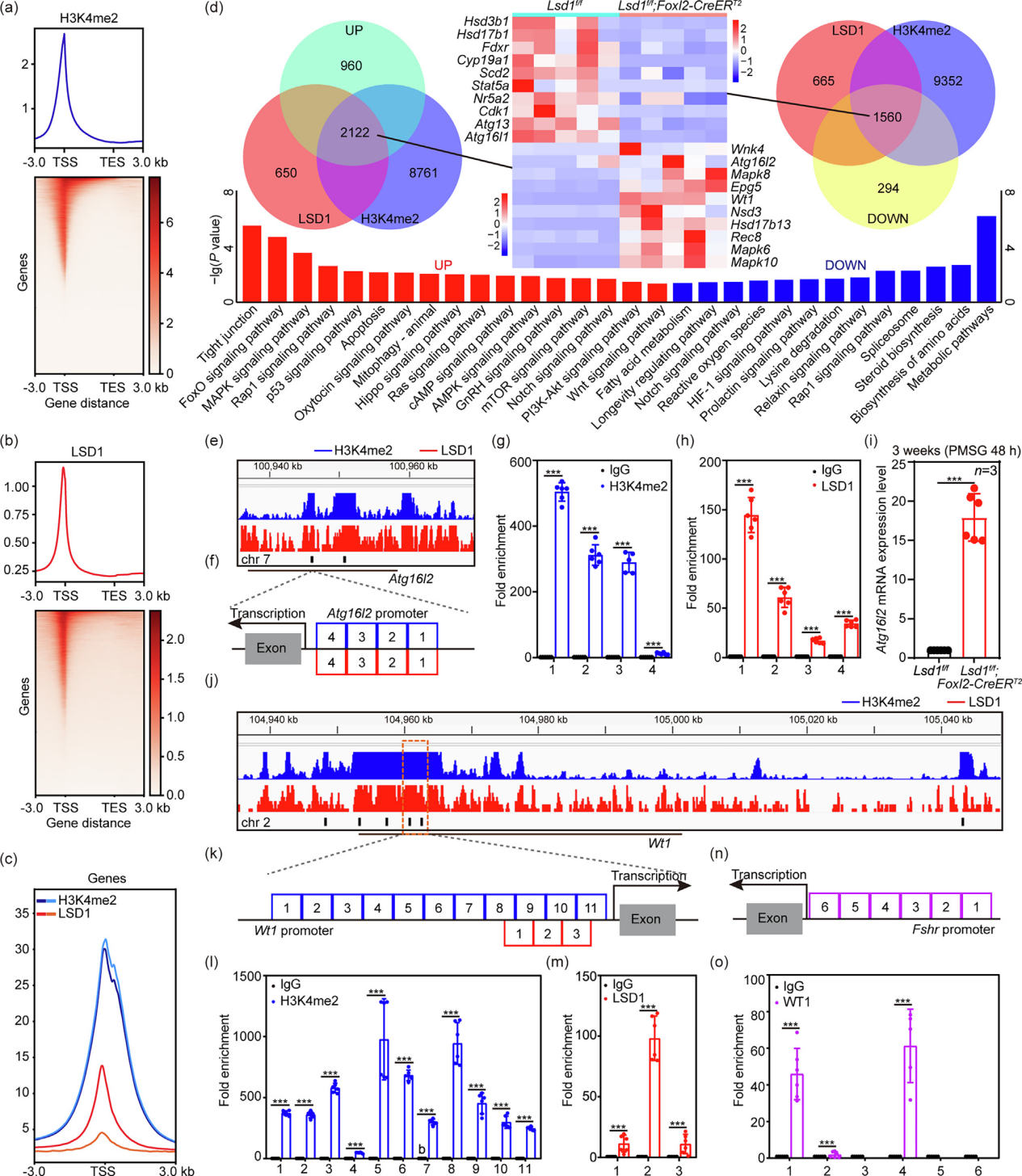
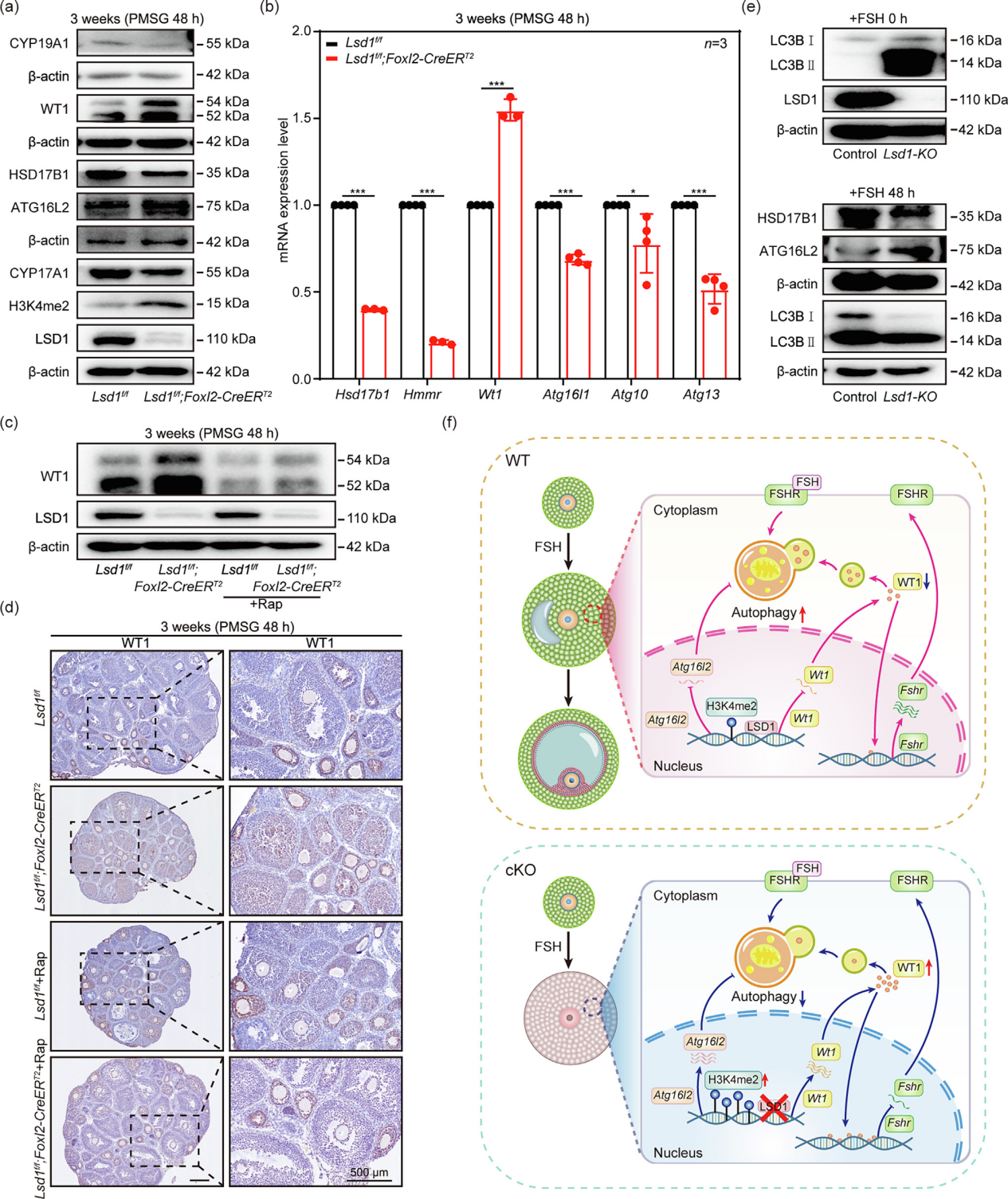
文章题目:LSD1 promotes the FSH responsive follicle formation by regulating autophagy and repressing Wt1 in the granulosa cells 中国农业大学在《Science Bulletin》上发表了LSD1通过调节颗粒细胞中的自噬和抑制Wt1来促进FSH反应性卵泡形成的研究成果,影响因子18.9。本研究中转录组检测及部分数据分析工作由上海派森诺生物科技股份有限公司完成。 1、研究背景 在生长中的卵泡中,卵母细胞的存活和成熟很大程度上依赖于体细胞的支持,以促进FSH诱导的相互信号传导和化学通讯。尽管体细胞中的细胞凋亡和自噬参与FSH诱导的卵泡发育过程,但其潜在机制需要大量研究。 表观遗传修饰,如DNA甲基化、翻译后组蛋白修饰和非编码RNA调控,可以独立或协同影响细胞命运。作者之前的研究表明,在胎儿卵巢卵母细胞中,LSD1调节自噬接头p62的转录,并在小鼠原始卵泡形成过程中通过其H3K4me2去甲基化酶活性影响自噬。然而,目前尚不清楚GC中的LSD1是否在成人卵泡生长的发育中起关键作用。 2、技术路线 3、研究内容 在FSH反应阶段,LSD1在GC中的表达增加 为了研究LSD1在小鼠卵泡发育过程中的生理作用,作者先明确了LSD1在FSH诱导的卵泡生长过程中的表达。为了确定 LSD1 水平是否与促性腺激素诱导的激活相关,施用了功能类似于 FSH 的 PMSG 来刺激卵泡生长。如图1a所示,当小鼠注射PMSG时,PMSG处理后24 h至36 h卵巢中LSD1的蛋白质和mRNA水平均显著增加,然后在48 h后略有下降。接下来,在PMSG注射后的不同时间点分离卵巢GC,通过WB分析研究卵泡发育过程中GC中LSD1的表达。此外,还对卵巢切片进行了IHC 染色。简而言之,随着卵泡的发育,PMSG处理后从12小时到36小时GCs中LSD1的表达水平逐渐增加(图1b-c)。这些结果表明LSD1可能在窦卵泡(Afs)的形成中发挥重要作用。 图1 GCs中LSD1表达的增加与小鼠卵泡发育阶段有关 Lsd1的GC特异性敲除导致雌性小鼠生育能力低下 为了研究LSD1在生长卵泡GC中的功能,通过杂交产生了具有GC特异性缺失Lsd1的小鼠模型Lsd1f/f;Foxl2-Cre。首先,在用PMSG和hCG诱导17小时后,评估Lsd1缺失对排卵的影响。与对照小鼠相比,Lsd1敲除小鼠排出成熟卵母细胞数量显著减少(图2a-b)。接着,作者研究了Lsd1被特异性删除后雌性的生殖能力。评估Lsd1-null小鼠的生育能力,发现Lsd1f/f;Foxl2-Cre雌性在交配后七个月时未能产生后代(图2c),这表明其生殖寿命显着缩短并获得不育表型。 LSD1参与促性腺激素依赖性卵泡发育 鉴于Lsd1敲除小鼠的生育能力受损,作者又进一步研究了生长卵泡GC中Lsd1缺失对FSH的影响。注射PMSG后48 h,3周龄 Lsd1敲除小鼠的卵巢明显小于对照小鼠(图2d),且卵巢重量与体重的比值显着降低(图2e)。此外,WB(GCs样本)和IF(卵巢样本)证实了卵巢的敲除效率(图2f-g)。根据组织学和统计分析,在GCs中Lsd1缺失后,包括初级卵泡(PFs)和AFs在内的生长卵泡的数量显着减少(图2h-i)。 图2 GCs中特异性敲除Lsd1导致低生育能力 为了研究LSD1在卵巢中的精确功能并排除GC特异性Lsd1敲除对原始卵泡池的可能影响,其可能会影响生长卵泡的募集,通过杂交生成了一种具有GC特异性缺失Lsd1的新小鼠模型Lsd1f/f;Foxl2-CreERT2,21-23天的小鼠接受PMSG注射以刺激卵泡生长。48小时后,与相应的对照小鼠相比,Lsd1敲除小鼠的卵巢大小和卵巢重量与体重之比明显降低(图3a-b)。此外,通过免疫印迹(GCs样品)和IF(卵巢样品)证实了敲除效率(图3c-d)。组织学和统计分析结果表明,Lsd1f/f;Foxl2-CreERT2小鼠在卵巢中观察到的AF数量可以忽略不计(图3e)。此外,在PMSG处理后48小时通过蛋白质质谱分析了GC中Lsd1条件敲除后蛋白质水平的变化。然后,KEGG富集分析表明,Lsd1的耗竭导致蛋白质表达发生显着变化,与参与蛋白质合成、雌激素产生等的信号通路有关(图3f)。 为了更准确地分析LSD1蛋白功能对卵泡发育的影响,作者对Lsd1f/f;Foxl2-CreERT2小鼠注射PMSG 24 h后的样品进行了分析。出乎意料的是,Lsd1f/f;Foxl2-CreERT2小鼠和Lsd1f/f小鼠的卵巢大小和卵巢重量体重比都非常相似(图3g-h),在任何发育阶段的卵泡数量均无显著差异(图3k),并且证实了基因敲除的有效性(图3i-j)。根据蛋白质组学分析,在此期间表现出表达变化的蛋白质参与了与细胞代谢、激素反应和细胞死亡相关的信号通路(图3l)。总之,在小鼠GCs中敲除LSD1蛋白导致卵泡在高度依赖FSH的快速生长期发育不正常。 图3 LSD1对于从胃前到心房颤动阶段的过渡尤为重要 LSD1通过诱导GCs自噬促进AFs的形成 为了研究LSD1蛋白缺失后卵泡发育的模式,收集了3周龄Lsd1f/f小鼠和Lsd1f/f;Foxl2-CreERT2小鼠的卵巢,这些小鼠经PMSG处理(48小时),冷冻并切片。采用结晶紫染色检测卵泡形态,选择含有多层GC的大SFs的GC进行分析。LCM捕获的卵泡GC用于转录组分析。通过KEGG分析和GSEA分析,与对照组小鼠相比,PMSG处理后48小时在Lsd1敲除小鼠中观察到与细胞代谢、激素反应、自噬和细胞凋亡相关的基因表达发生显著变化(图4a-c)。PMSG处理Lsd1敲除小鼠24或48小时后,自噬相关蛋白的表达水平显著降低(图4d),IF和透射电子显微镜(TEM)结果表明,与对照组相比,Lsd1耗尽后大SFs的GC中的自噬水平受到显著抑制(图4e-f)。 为了进一步研究Lsd1敲除对GCs自噬的影响,作者采用RFP-EGFP-LC3小鼠模型来研究Lsd1的缺失是否会影响自噬酶体的形成。结果表明,在PMSG处理48h后,LC3- Lsd1f/f;Foxl2-CreERT2卵巢中GFP和RFP合并的荧光信号和单独的RFP荧光信号都比对照卵巢弱。因此,自噬体在LC3- Lsd1f/f;Foxl2-CreERT2卵巢中不能正常积累(图4g-i)。综上所述,这些结果再次证实了LSD1在生长卵泡GCs中的表达,通过诱导自噬来促进AFs的形成,以响应FSH。 图4 LSD1参与体内自噬相关AFs的形成 自噬对AFs的形成起重要作用 首先,作者评估了生理条件下激素诱导的窦卵泡形成的变化。当小鼠注射PMSG时,卵巢和GC中LC3的蛋白质和mRNA水平随着时间的推移而显着增加。TEM显示,与未处理的GC相比,PMSG处理的GC中存在更多的自噬体或自噬酶体。此外,FSHRs在卵巢和GC中的表达响应PMSG启动以时间依赖性方式上调,而GC中H3K4me2的丰度逐渐降低。为了阐明GC中的自噬蛋白是否参与卵泡的周期性募集,3周龄小鼠腹膜内注射PMSG和自噬抑制剂巴佛洛霉素A1(Baf-A1)。结果表明,AF的数量显著减少,这表明自噬参与了AFs的发展(图S5e-f)。值得注意的是,这些小鼠自噬抑制后AFs形成的失败与上述两种Lsd1敲除小鼠模型中观察到的相似。因此,在生理条件下,窦卵泡的发育和周期性募集需要增加GC中的自噬。 为了证实LSD1通过自噬调节AFs的形成,作者利用自噬诱导剂雷帕霉素(Rap)来证实LSD1在诱导自噬中的作用。PMSG处理48小时后,Rap处理的Lsd1基因敲除小鼠卵巢略大于Lsd1f/f;Foxl2-CreERT2小鼠卵巢,小鼠的卵巢重量与体重之比有所增加(图5a)。此外,通过免疫印迹(GCs样本)和IF(卵巢样本)证实了基因敲除效率和自噬(图5b-c)。与先前基于Baf-A1处理的结论一致,诱导自噬基因表达可有效逆转Lsd1特异性敲除引起的AFs数量的显著减少(图5d-e)。综上所述,LSD1通过诱导自噬促进AFs的形成。 图5 体内自噬的激活逆转了Lsd1缺失时AFs形成的减少 为了进一步研究LSD1如何参与AFs形成相关基因表达的调节,作者进行了CUT&Tag的测定。数据分析表明,LSD1和H3K4me2在整个GC的基因启动子区域普遍存在(图6a、b)。此外,GC显示转录起始位点(TSS)周围H3K4me2和LSD1的丰度全局增加(图6a-c)。此外,PMSG处理表达上调或下调的基因与LSD1和H3K4me2共调控的基因显著重叠(图6d)。重叠的基因包括参与新陈代谢、细胞生长发育、细胞死亡和激素合成的基因(图6d)。 图6 LSD1主要通过调节H3K4甲基化水平控制包括Wt1在内的GC分化相关基因的转录 有趣的是,一些与自噬调节相关的基因也被富集。为了验证这些基因是否与自噬相关并与LSD1相关,作者进行了ChIP-qPCR检测。结果表明,LSD1和H3K4me2都直接与Atg16l2启动子中的4761至5160 bp区域结合(图6e-h)。先前的研究表明,ATG16L2可作为竞争性ATG16L1抑制剂,从而抑制自噬。此外,在作者的Lsd1敲除模型中,ATG16L2的mRNA和蛋白质水平都有所增加(图6i和7a)。这些结果表明,LSD1通过调节自噬抑制基因Atg16l2的表达来调节GCs中的自噬。 LSD1和H3K4me2调节GC中Wt1的转录以支持FSH反应性 为了验证LSD1和H3K4me2如何调节WT1反应性,进行了ChIP-qPCR分析。结果表明,LSD1和H3K4me2都直接结合到Wt1启动子中2474 bp至2779 bp的区域(图6j-m)。基于这些结果,假设LSD1和H3K4me2调节GC中Wt1的转录。作者进一步发现,在GCs中敲除Lsd1后,WT1的蛋白和mRNA水平均升高,这证实了上述测序结果和与WT1相关的IHC结果(图7a-b)。进一步的证据表明,WT1在GC的细胞质和细胞核中表达。敲除Lsd1后,GC中WT1的蛋白水平升高(图7d)。根据ChIP-qPCR分析,WT1直接与Fshr 启动子中的971至1282 bp区域结合(图6n-o)。这表明WT1调控Fshr的转录活性。与这一假设一致,证实WT1的过表达显着降低了Fshr的转录活性,并且FSHR表达在Wt1敲低后上调(图7a)。因此,WT1有助于Fshr表达的下调,而响应LSD1敲除的H3K4me2丰度增加可能促进Wt1的转录。与之前的研究一致,作者的结果表明自噬参与了WT1降解的过程。根据本研究的免疫印迹和IHC结果,自噬的诱导导致WT1的快速降解(图 7c-d)。因此,假设自噬通过促进WT1降解来上调Fshr转录,以确保GC对FSH信号转导的最佳反应。总之,LSD1缺陷导致的自噬抑制导致WT1降解失败和AFs形成受损。 FSH影响LSD1在自噬中的调节作用 为了研究LSD1在GC中的功能及其与FSH诱导的关系,作者在KGN细胞中构建了Lsd1敲除细胞系(Lsd1-KO)。WB结果显示,LSD1在Lsd1-KO细胞中被成功敲除(图7e)。KGN细胞中LSD1的缺失导致自噬标志物LC3B II的蛋白质水平升高(图7e)。这表明GC中Lsd1的敲除会增加细胞自噬。然而,FSH处理后,Lsd1-KO细胞中自噬标志物LC3B的蛋白水平下调,自噬相关ATG16L2蛋白水平升高(图7e)。这表明FSH处理后Lsd1-KO细胞的自噬被阻断。Lsd1-KO细胞系的这些结果与小鼠GCs表型一致。这些结果进一步表明,LSD1介导的GC自噬变化可能与FSH刺激有关。因此,GC中Lsd1的敲除导致异常自噬,进而影响GCs的发育,最终导致AFs形成失败并最终导致发育异常。 图7 LSD1和自噬共同下调GCs中WT1的水平,以支持FSH作用下进行性AFs的形成 4、研究结论 本研究为探究颗粒细胞中组蛋白去甲基化酶(LSD1)在有腔卵泡形成过程中的作用,构建了该编码基因的多种颗粒细胞条件性敲除小鼠和细胞模型。证明组蛋白去甲基化酶(LSD1)是调节颗粒细胞自噬及颗粒细胞分化的重要分子开关。LSD1参与调控FSH介导的有腔卵泡发育及卵泡命运决定过程。一方面,敲除Lsd1会导致WT1的mRNA和蛋白水平积累,进而下调颗粒细胞中FSH受体(FSHR)的表达,进而抑制次级卵泡对FSH激素的响应。另一方面,敲除Lsd1会导致颗粒细胞中自噬相关蛋白Atg16l2的表达水平上调,从而抑制颗粒细胞自噬。该研究揭示了LSD1作为重要的表观遗传分子参与促性腺激素FSH调控雌性哺乳动物有腔卵泡形成的分子机制。
原文索引: Zhu Z, He M, Zhang T, Zhao T, Qin S, Gao M, Wang W, Zheng W, Chen Z, Liu L, Hao M, Zhou B, Zhang H, Wang J, Wang F, Xia G, Wang C. LSD1 promotes the FSH responsive follicle formation by regulating autophagy and repressing Wt1 in the granulosa cells. Sci Bull (Beijing). 2024 Apr 30;69(8):1122-1136. doi: 10.1016/j.scib.2024.01.015. Epub 2024 Jan 17. PMID: 38302330.