
2024-09-23

文章题目:ARID1A safeguards the canalization of the cell fate decision during osteoclastogenesis(IF=14.7) 上海交通大学医学院附属上海市第九人民医院口腔修复科在《Nature Communications》上发表了在破骨细胞发生过程中,ARID1A保护细胞命运决定的通道化的研究成果。本研究中转录组检测及部分数据分析工作由上海派森诺生物科技股份有限公司完成。
1、研究背景 染色质重塑子ARID1A通过调节核小体定位和染色质可及性来调节基因转录。而在细胞命运通路中,ARID1A介导的阶段和谱系限制基因调控仍未得到解决。
2、研究方法 研究材料 LysM-Cre小鼠、Arid1a-flox小鼠、Brd9-flox小鼠、WT C57BL/6J小鼠和tdTomato小鼠 技术手段 单细胞转录组测序(scRNA-seq)、转录组测序(RNA-seq)、共免疫沉淀(co-IP)、chip-seq、Western blot、qPCR
3、研究路线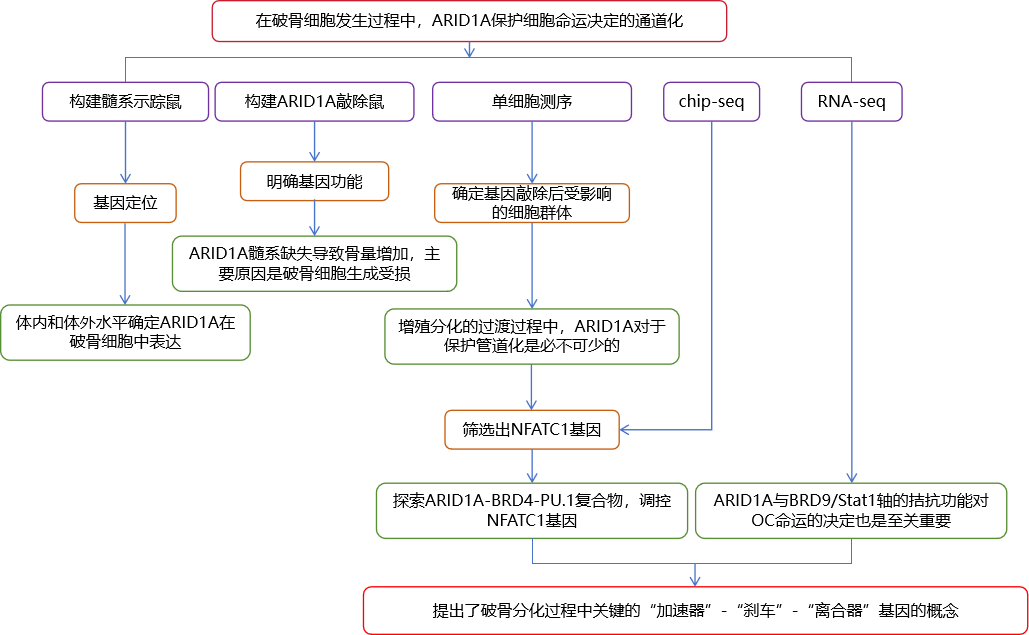
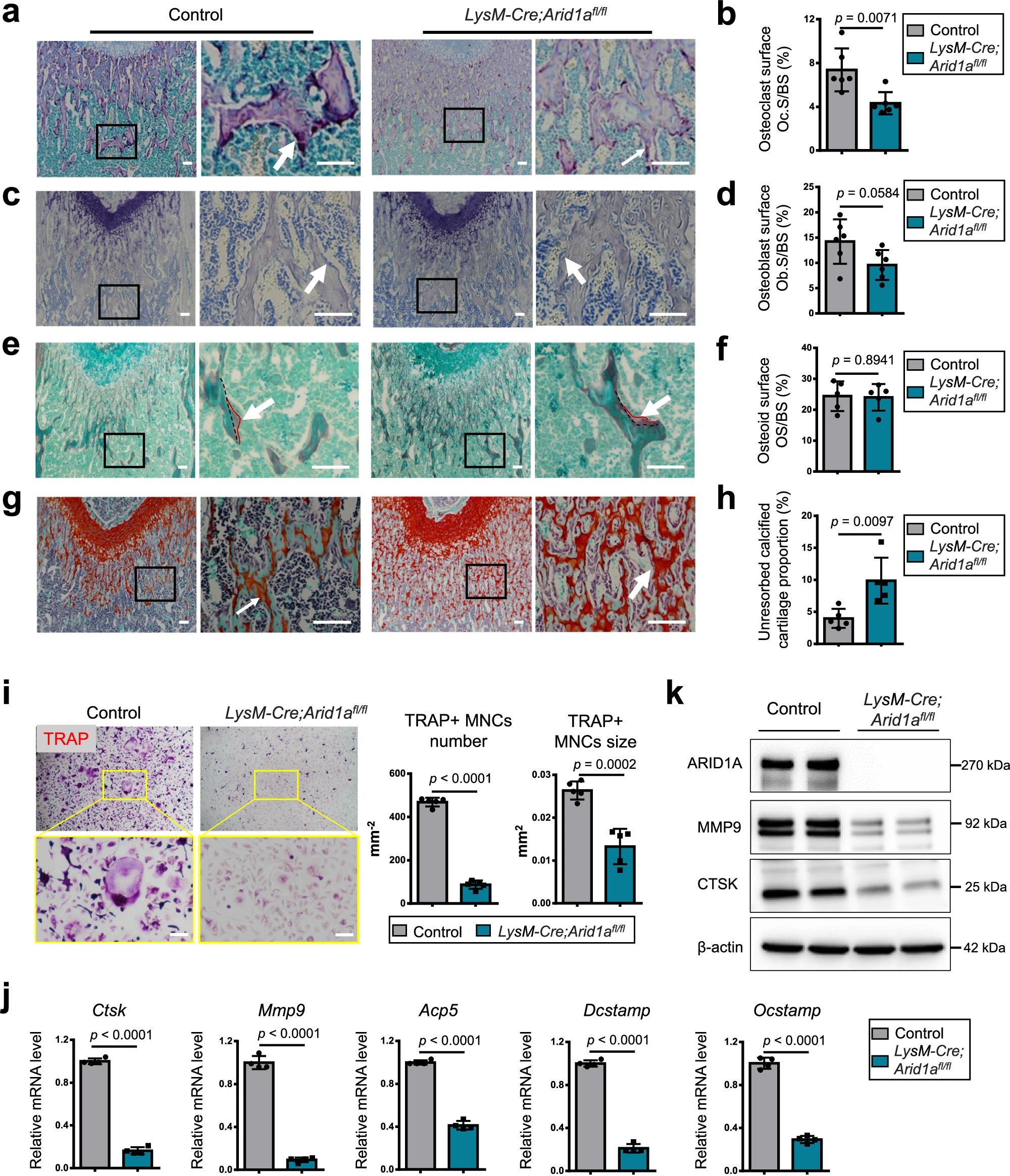
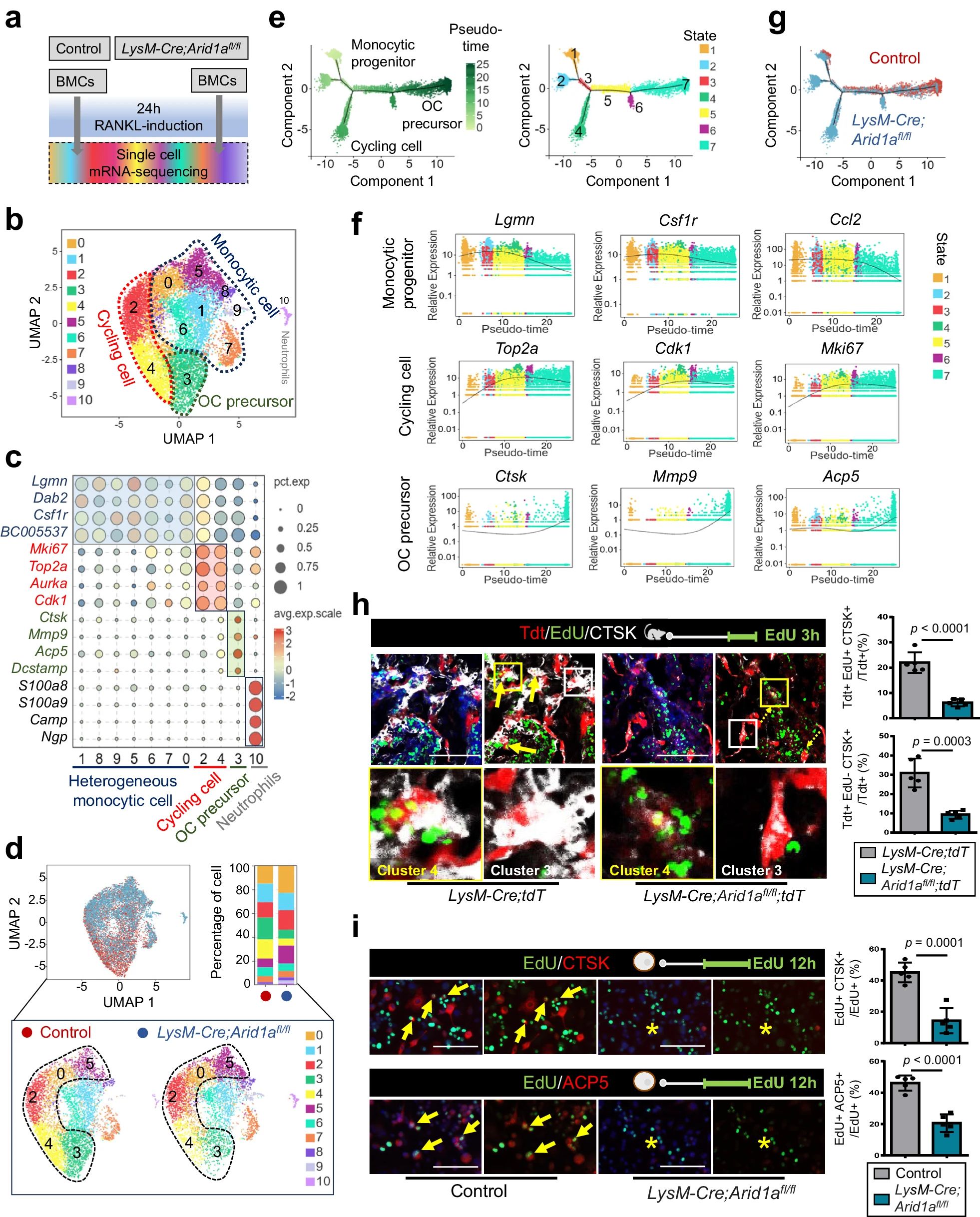
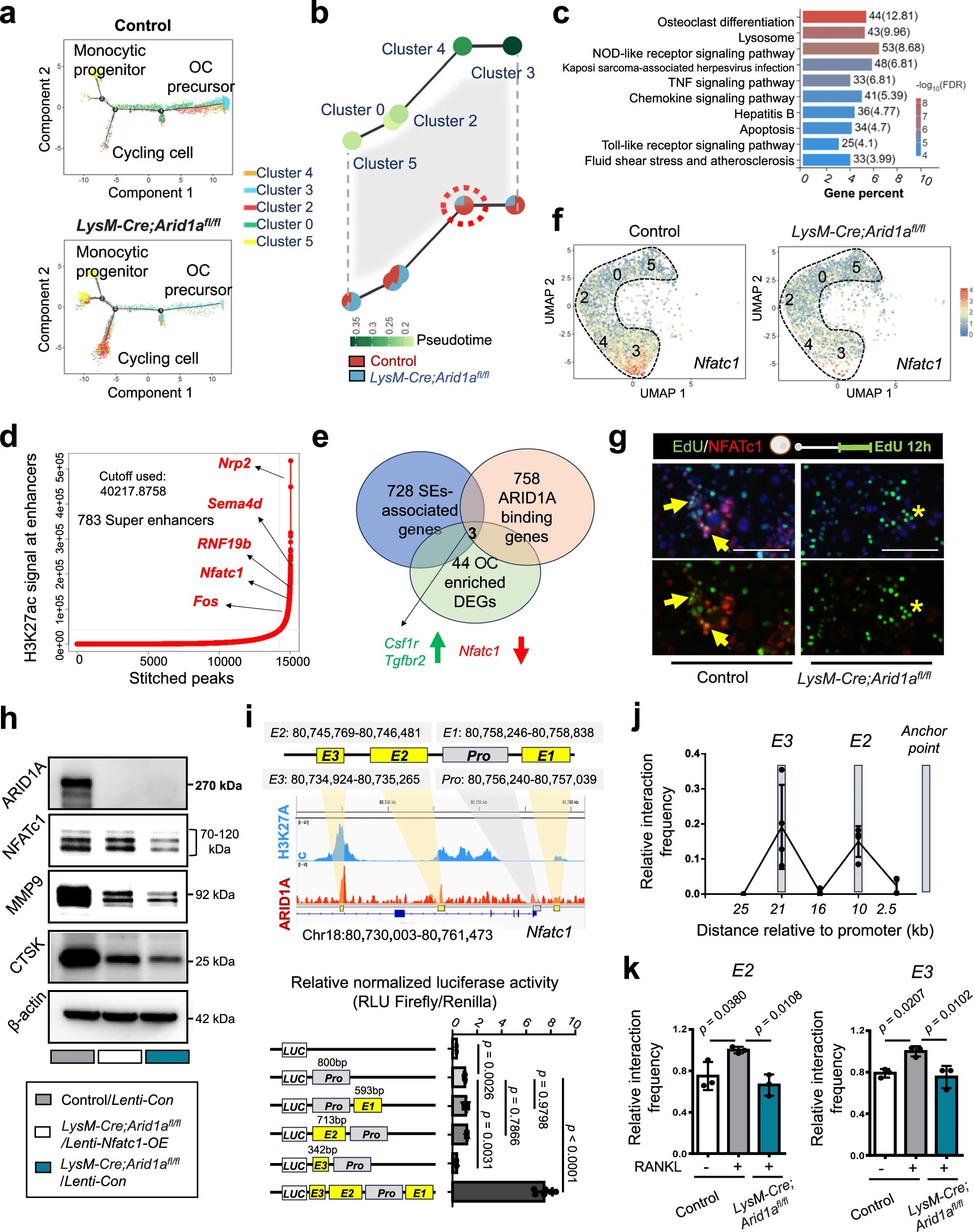
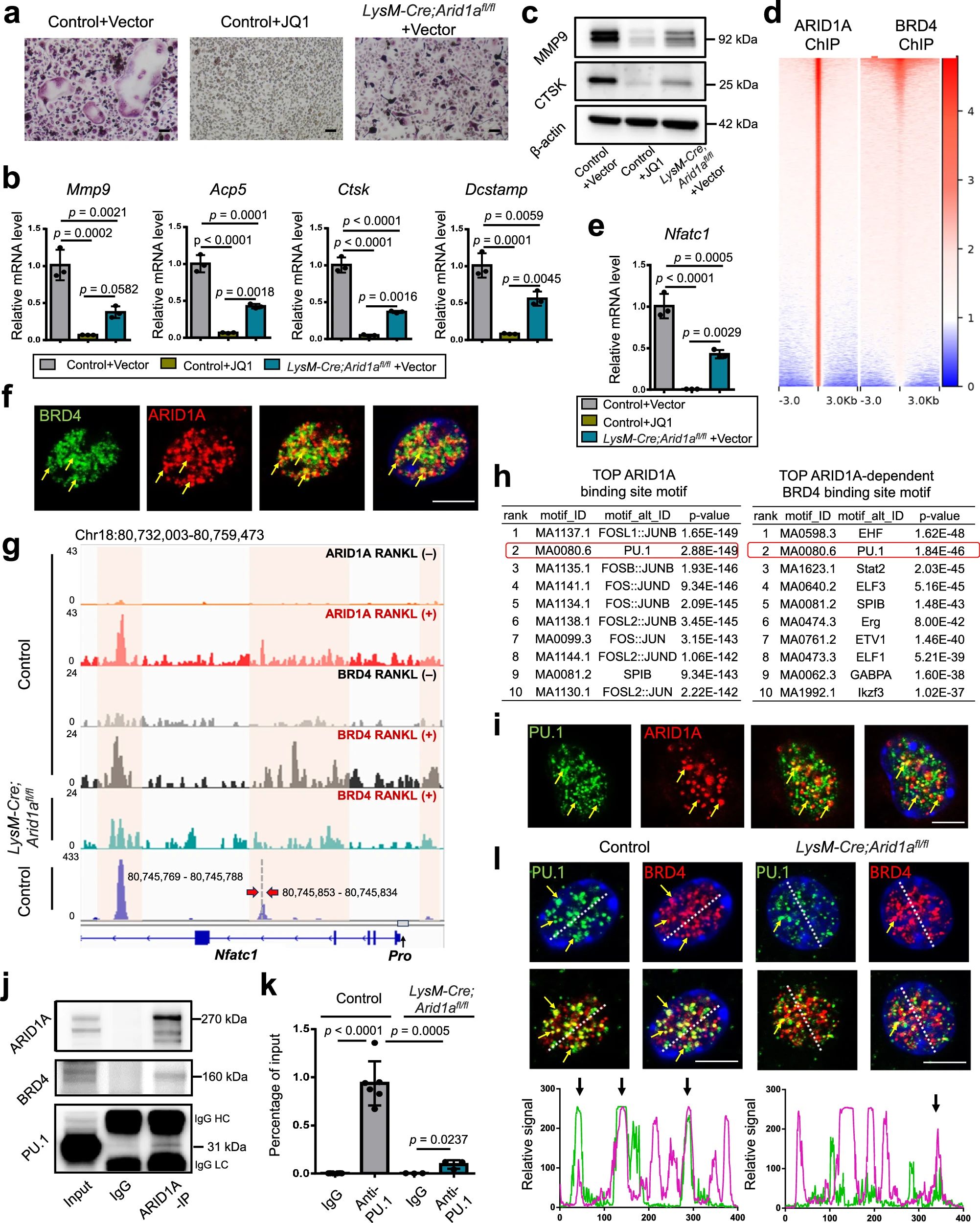
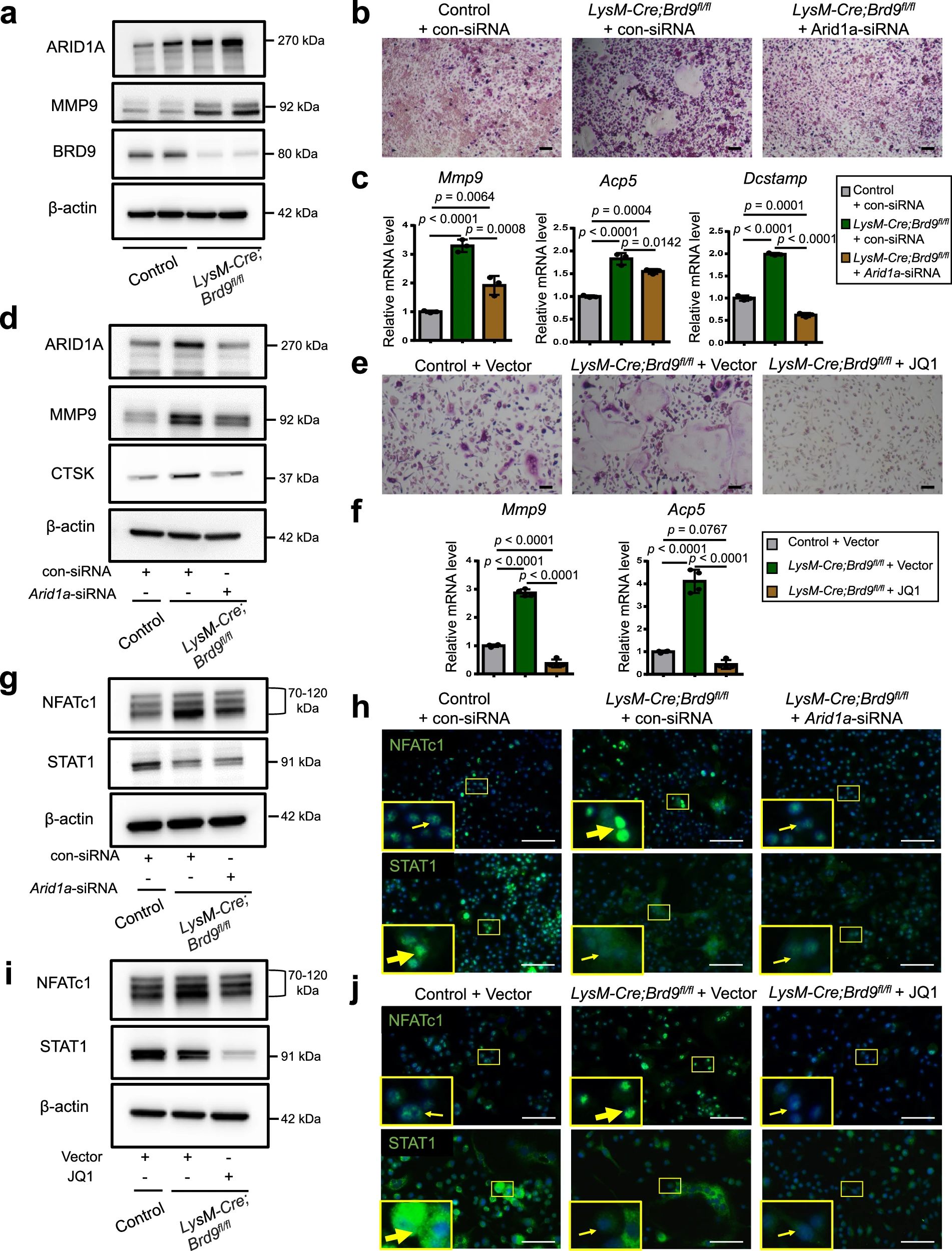
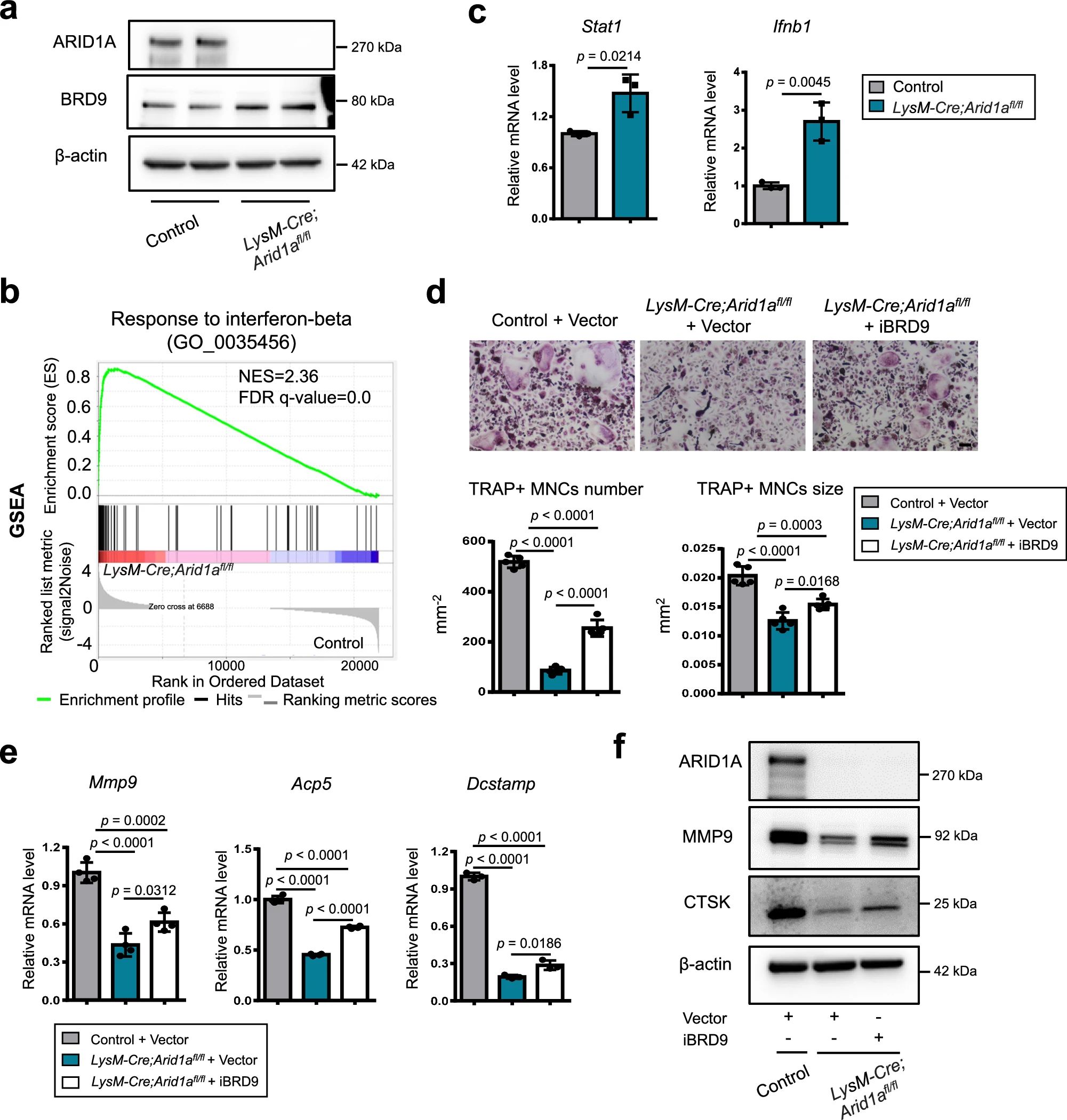
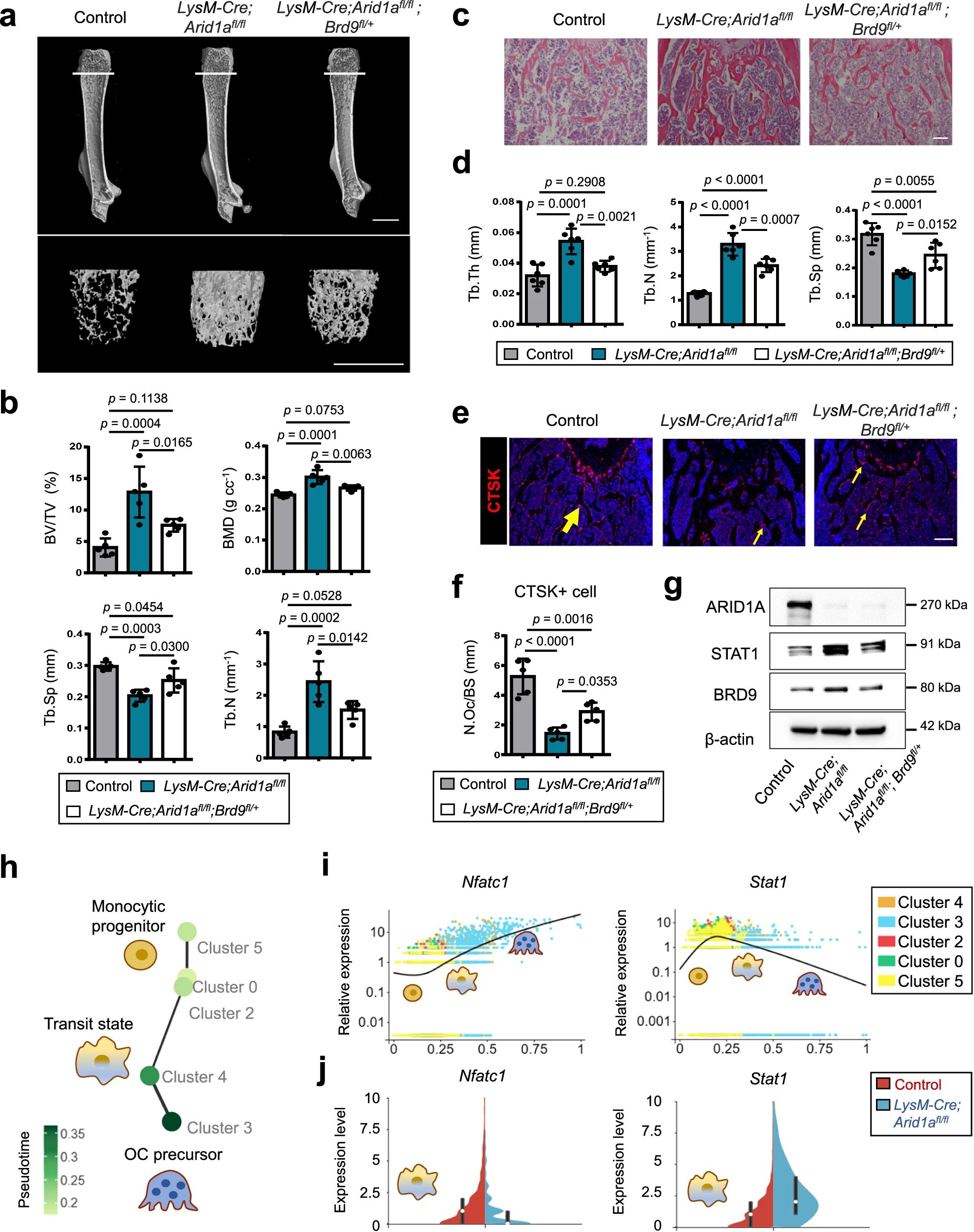
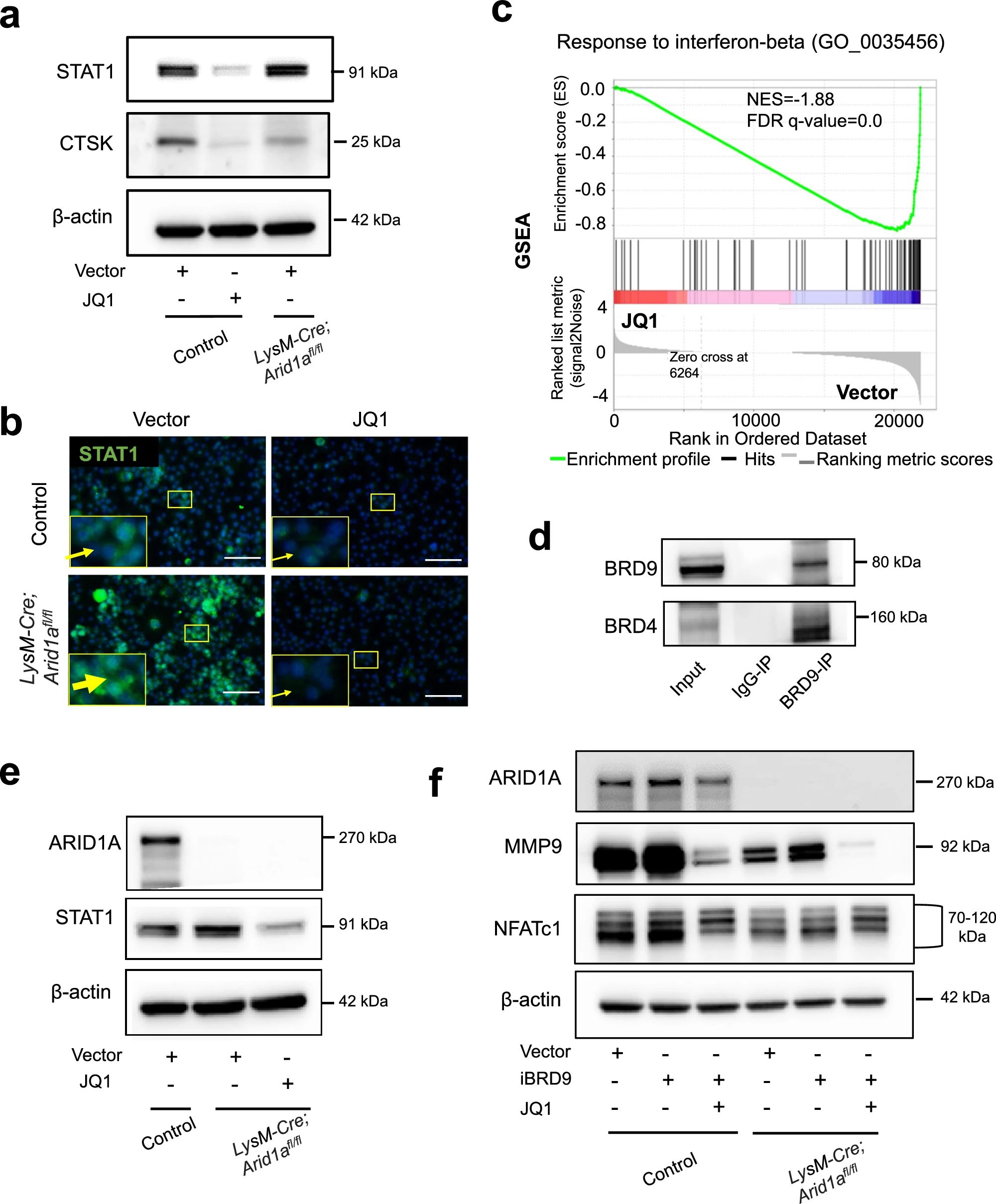
4、研究结果 1、Arid1a的缺失导致骨量过多,破骨细胞生成受损 构建示踪小鼠(LysM-Cre;tdT小鼠),结合CTSK(破骨标记物)和ARID1A荧光染色,发现ARID1A在4周龄小鼠股骨远端骨小梁表面LysM+髓系破骨细胞中表达。体外诱导破骨细胞分化,进行TRAP和ARID1A的共染,发现ARID1A在体外TRAP+多核OC中表达,且经RANKL处理后,ARID1A在mRNA和蛋白水平上的表达随破骨诱导逐渐上调。 构建ARID1A髓系敲除鼠(LysM-Cre;Arida1fl/fl)观察表型:与对照雄性小鼠相比,3月龄雄性敲除鼠表现出骨小梁增加,骨体积/组织体积比(BV/TV)增加,骨矿物质密度(BMD)增加,骨小梁数量增加,骨小梁厚度增加,骨小梁间距减少,孔隙率(Po)减少。HE染色和Von Kossa染色显示,与3周龄和6周龄的同窝对照小鼠相比,Arid1a缺失小鼠骨量增加,矿化增加。(图1) 图1 髓系中Arid1a的缺失导致骨量过多 进一步分析3周龄成骨、破骨功能改变情况。TRAP染色显示敲除鼠破骨细胞定量减少;甲苯安蓝染色显示成骨细胞定量减少;GRB染色显示类骨质定量相似;MASSON染色显示敲除鼠股骨远端生长板下存在大量未吸收的钙化软骨;骨髓单核细胞体外破骨诱导TRAP染色显示敲除鼠TRAP阳性破骨细胞数量减少,体积变小;血清骨吸收(TRAP/CTX-I)和骨形成标志物(OCN/PINP),破骨指标蛋白qPCR,WB(MMP9,CTSK)显示,敲除鼠骨吸收被抑制,骨形成能力无显著变化。结果表明ARID1A敲除鼠骨量增加,破骨抑制。ARID1A对于正常的破骨分化至关重要。(图2) 图2 骨髓谱系中Arid1a的缺失导致OC谱系承诺受损 2、在增殖-分化转换过程中,ARID1A转录保护OC命运通路 为了分析ARID1A对于破骨分化作用的内在机制,对ARID1A缺失的骨髓细胞进行24小时的破骨诱导后做单细胞转录组测序(scRNA-Seq)。对照组5813个细胞,敲除组5305个细胞,聚类分析出11个聚类。其中簇3具有高表达的破骨相关基因,说明簇3是破骨细胞前体。其余(簇1,8,9,5,6,7,0)主要是单核细胞,簇2,4主要是增殖群体,簇10为中性粒细胞标记。比较各个聚类细胞簇比例,发现簇5、0和2的比例增加,而簇4和3的比例减少,说明ARID1A的缺失缺失影响了破骨细胞的分化。随后进行伪时间分析,单核细胞祖细胞通过逐步途径分化为OC前体细胞,单核祖细胞标记物Lgmn、Csf1r和Ccl2表达水平逐渐下调,破骨基因Ctsk、Mmp9和Acp5表达逐渐增高,增殖标记基因的表达水平在中期达到峰值。对比敲除组和对照组的伪时间分析,发现ARID1A缺失后,单核细胞从增殖到分化的过程受到阻碍。体内体外EDU示踪标记细胞实验显示ARID1A缺失组,EUD阳性的CTSK+或者TRAP+细胞很少。结果表明在增殖分化的过渡过程中,ARID1A对于保护管道化是必不可少的,而在破骨细胞发生过程中,ARID1A的缺失会导致细胞命运承诺的缺陷。(图3) 图3 在增殖-分化转换过程中,ARID1A转录保护OC命运通路 3、ARID1A在增殖-分化转变过程中激活OC主TF Nfatc1的SE转录 为了进一步研究ARID1A介导的转录调控机制,重点研究了ARID1A缺失后分化轨迹中转录谱的变化。KEGG富集分析显示,溶酶体、趋化因子信号通路和代谢途径在簇5和簇0中高度富集,细胞周期和DNA复制在簇2中富集,核糖体相关途径在簇3中高度富集,DNA复制和核糖体相关途径在簇4中都富集。伪时间分析和基于分区的图抽象(PAGA)均显示,增殖-分化切换的关键细胞群簇4是Arid1a缺失后的主动缺陷细胞簇。然后分析了Arid1a缺失后簇4转录谱的变化。Arid1a缺失后,有1266个上调基因和503个下调基因,如预期的那样高度富集于OC分化。 为了了解与ARID1A相关的转录增强子,对RANKL诱导的破骨细胞进行了ChIP-seq测序,从而获得ARID1A和超级增强子SEs相关组蛋白修饰标记H3K27Ac的全基因组结合谱。确定了15039个增强子区域,其中783个SE区域在大小和H3K27Ac水平上与典型增强子不同。将所有转录活性基因(TSSs)分配到50 kb窗口内的SEs上,鉴定出728个与SEs相关的基因,并提出NFATc1可能是调节破骨细胞终端分化的主开关。 单细胞测序内结果发现Nfatc1的表达在分化过程中上调,而在Arid1a缺失后的第4簇中没有上调,这表明它可能是Arid1a在OC命运决定过程中的核心下游靶点。对EdU标记的增殖细胞进行了12小时的追踪,发现对照组中可以检测到NFATc1+细胞,而失去Arid1a后则很少。通过使用慢病毒载体在敲除小鼠的BMCs中组成表达NFATc1。组成性表达的Nfatc1部分挽救了ARID1A缺失后的缺陷OC分化,增加了MMP9、CTSK和ACP5的表达。表明ARID1A和超级增强子相互作用,调控Nfatc1基因功能,影响破骨细胞分化。(图4) 图4 ARID1A在增殖分化转换过程中激活Nfatc1的SE转录 4、ARID1A通过在SE位点与共激活剂BRD4和指定谱系的TF构建凝聚体来激活Nfatc1 BRD4作为增强子的表观基因组解读器,与介质相互作用,并通过SE(超级增强子)重编程和TF(转录因子)重连接活动参与转录延伸的控制。 引入BRD4后,首先进行BRD4抑制实验,发现BRD4受JQ1抑制与ARID1A缺失之间的OC分化缺陷表型相似,TRAP+多核OC数量和大小均减少,Mmp9、Ctsk、Acp5和Dcstamp的表达均受到抑制。为了进一步研究ARID1A和BRD4在破骨细胞形成过程中的调控机制的相似性,我们比较了ARID1A和BRD4 (RANKL诱导前后)的结合谱。结果显示OC分化过程只富集在ARID1A和BRD4的共有基因上,提示它们在破骨细胞发生过程中可能具有协同作用。考虑到ARID1A通过SE活性在OC细胞命运决定过程中不可或缺的功能,以及JQ1抑制BRD4和RANKL诱导后ARID1A缺失导致Nfatc1转录抑制,推测BRD4可能是激活Nfatc1 SE从而OC分化过程中的关键共激活因子。双免疫荧光染色也验证了BRD4在ARID1A细胞核中的共定位在破骨细胞发生中的作用。尽管BRD4的表达在mRNA和蛋白质水平上都不受影响,但在Arid1a缺失后,BRD4在Nfatc1 SE区域的结合受到损害,Arid1a与BRD4在Nfatc1 SE区域的共定位依赖于RANK信号传导。表明BRD4与Nfatc1 SE位点的ARID1A协同保护破骨细胞形成过程中的管道化,ARID1A的缺失导致BRD4在Nfatc1位点的激活功能缺陷。 为了确定在Nfatc1的SE位点与ARID1A合作以保护破骨细胞形成过程中的管道化的关键谱系指定转录因子,我们对ARID1A和BRD4结合谱进行了基序分析。ChIP-Seq数据显示ARID1A有828个峰(p < 0.001), ARID1A依赖性BRD4结合有1298个峰(p < 0.001)。Ets家族TF PU.1在ARID1A结合位点的顶部富集TF基序中,以及在ARID1A耗尽后丢失的ARID1A依赖性BRD4结合位点中。PU.1是造血过程中一种指定谱系的TF,它正向调节许多共定位的PU.1- brd4点,提示为ARID1A-BRD4-PU。除PU.1外,NFKB1、AP-1和NFATc1基序也在NFATc1 SE区富集,表明其也可能参与ARID1A/BRD4/PU。(图5) 图5 ARID1A通过在SE位点与共激活剂BRD4/指定谱系的TF PU.1构建凝聚体激活Nfatc1 5、ARID1A-cBAF和BRD9-ncBAF复合物在OC命运通路中的拮抗剂 近期研究表明,BRD9-ncBAF复合物通过STAT1/IFN-β信号激活负向调节OC分化,这与本研究中证实的ARID1A的功能相反。我们发现BRD9缺失BMC细胞中,ARID1A表达增强,破骨分化指标MMP9增强。使用siRNA敲低ARID1A或者JQ1抑制BRD4的活性,可以逆转BRD9缺失造成的破骨分化过度。表明ARID1A-BRD4复合物轴参与了BRD9缺失造成的破骨增强。虽然BRD9缺失后过度激活的NFATc1被挽救,但在LysM-Cre的BMCs中,无论是siRNA敲低ARID1A还是JQ1抑制BRD4,STAT1的表达仍然处于低水平,表明挽救机制不依赖于STAT1。此外ARID1A缺失导致BRD9蛋白水平升高。(图6) 图6 ARID1A/BRD4/PU活性增强。1/NFATc1轴有助于Brd9缺失后过度激活的OC谱系测定 GSEA分析表明,与对照组相比,在RANKL诱导后,LysM-Cre;Arid1afl/fl小鼠BMCs中IFN-β信号富集。qPCR验证表明ARID1A缺失后,破骨细胞诱导的BMCs中Stat1和Ifnb1表达增加。表明BRD9/STAT1/IFN-β信号轴参与ARID1A缺失导致的破骨细胞形成受损。在破骨细胞形成过程中使用BRD9抑制剂治疗ARID1A缺失的BMCs。发现BRD9抑制部分挽救了Arid1a缺失后OC分化缺陷,增加了TRAP+多核OC的数量和大小以及Mmp9、Acp5、Dcstamp和Ctsk的表达水平。(图7) 图7 BRD9/STAT1轴的过度活性导致Arid1a缺失后OC分化过程受损 进一步建立BRD9杂合敲除LysM-Cre;Arid1afl/fl小鼠体内模型,验证这一假设。与3月龄雌性小鼠相比,LysM-Cre;Arid1afl/fl组的骨质增生表型和OC分化缺陷在LysM-Cre;Arid1afl/fl;BRD9fl/+组得到部分恢复,ARID1A缺失后STAT1异常上调得到缓解。 ARID1A缺失导致BRD9蛋白水平升高,而mRNA水平无明显变化,提示ARID1A缺失后BRD9转录后水平调控可能发生了变化。使用UbiBrowser 2.0软件预测了BRD9潜在的E3连接酶/DUBs。整合前15个预测的泛素连接酶/DUBs,并比较对照组和LysM-Cre;Arid1afl/fl小鼠BMCs中RNA-seq数据的差异表达分析。E3泛素蛋白连接酶 MDM2在ARID1A缺失后显著下调。SP141抑制剂44降解MDM2可以增加BRD9蛋白水平,表明ARID1A缺失后MDM2的下调可能有助于BRD9蛋白水平的升高。 因此,除了通过在SE位点与共激活因子BRD4/谱系指定因子PU.1构建凝聚体激活OC主TF Nfatc1外,ARID1A与BRD9/Stat1轴的拮抗功能对OC命运的决定也是至关重要的。在增殖-分化转换过程中,ARID1A的缺失导致Nfatc1上调和Stat1下调失败。综上所述,在OC谱系的分化传导过程中,ARID1A-cBAF和BRD9-ncBAF复合物的功能相互拮抗,控制和维护命运决定过程。(图8) 图8 在体内,Brd9杂合敲除部分修复了Arid1a缺失后的OC分化缺陷 在BRD4抑制剂JQ1治疗后,在ARID1A缺失的BMCs中,STAT1的表达水平下降,这表明ARID1A缺失后BRD9- STAT1轴的增强依赖于BRD4。BRD4通过与ARID1A-cBAF复合物的相互作用激活破骨细胞的主要转录因子 Nfatc1,并通过与BRD9-ncBAF复合物的相互作用增强IFN-β信号转导/Stat1活性。我们的发现表明ARID1A-“加速器”和BRD9-“刹车”的拮抗作用都依赖于BRD4, BRD4发挥“离合器”作用。(图9) 图9 在破骨细胞发生过程中,ARID1A和BRD9的拮抗功能都依赖于BRD4
5、研究结论 1、骨髓祖细胞中Arid1a的缺乏会在增殖-分化转换过程中损害OC谱系的分化,导致骨量过多。 2、ARID1A对于在主TF Nfatc1 SE区域与共激活子BRD4/指定谱系的TF PU.1形成转录装置凝聚体是必不可少的,从而保护OC命运的渠化。 3、ARID1A-cBAF和BRD9-ncBAF复合物的功能相互拮抗,控制和维护命运决定过程。 4、ARID1A-“加速器”和BRD9-“刹车”的拮抗作用都依赖于协同激活剂BRD4-“离合器”在OC命运管化过程中。
原文索引: https://doi.org/10.1038/s41467-024-50225-z