2024-12-03

2024年11月21日,四川大学华西医院在转化医学顶级期刊Cell Metabolism(IF27.7)上发表了题为Dual impacts of serine/glycine-free diet in enhancing antitumor immunity and promoting evasion via PD-L1 lactylation的研究成果,该研究运用多组学检测技术系统性揭示了无丝氨酸/甘氨酸饮食通过代谢调控、肿瘤微环境改变和免疫逃逸机制对结直肠癌的影响,并为免疫治疗提供了新的联合治疗策略。本研究中乳酸化修饰鉴定、靶向氨基酸代谢组、靶向有机酸代谢组和单细胞TCR检测及部分分析工作由上海派森诺生物科技股份有限公司完成。
PART.1、研究背景
直肠癌(CRC)作为全球第三大常见癌症,具有较高的发病率和死亡率。尽管程序性死亡受体1(PD-1)抑制剂等免疫检查点抑制剂对部分缺失错配修复的CRC患者有效,但超过85%的具备错配修复功能的患者对免疫治疗反应不佳,主要原因在于肿瘤微环境缺乏足够的免疫细胞浸润。此外,癌细胞高度依赖外源性丝氨酸和甘氨酸等氨基酸以支持其生长和代谢,这一特性为饮食调控提供了可能的治疗策略。然而,限制氨基酸摄取对肿瘤代谢、免疫微环境以及免疫逃逸机制的影响尚不明确。本研究以无丝氨酸/甘氨酸饮食(-SG饮食)为模型,探索其在抑制肿瘤生长、调控免疫反应及其潜在临床应用中的作用和机制。
PART.2、技术路线
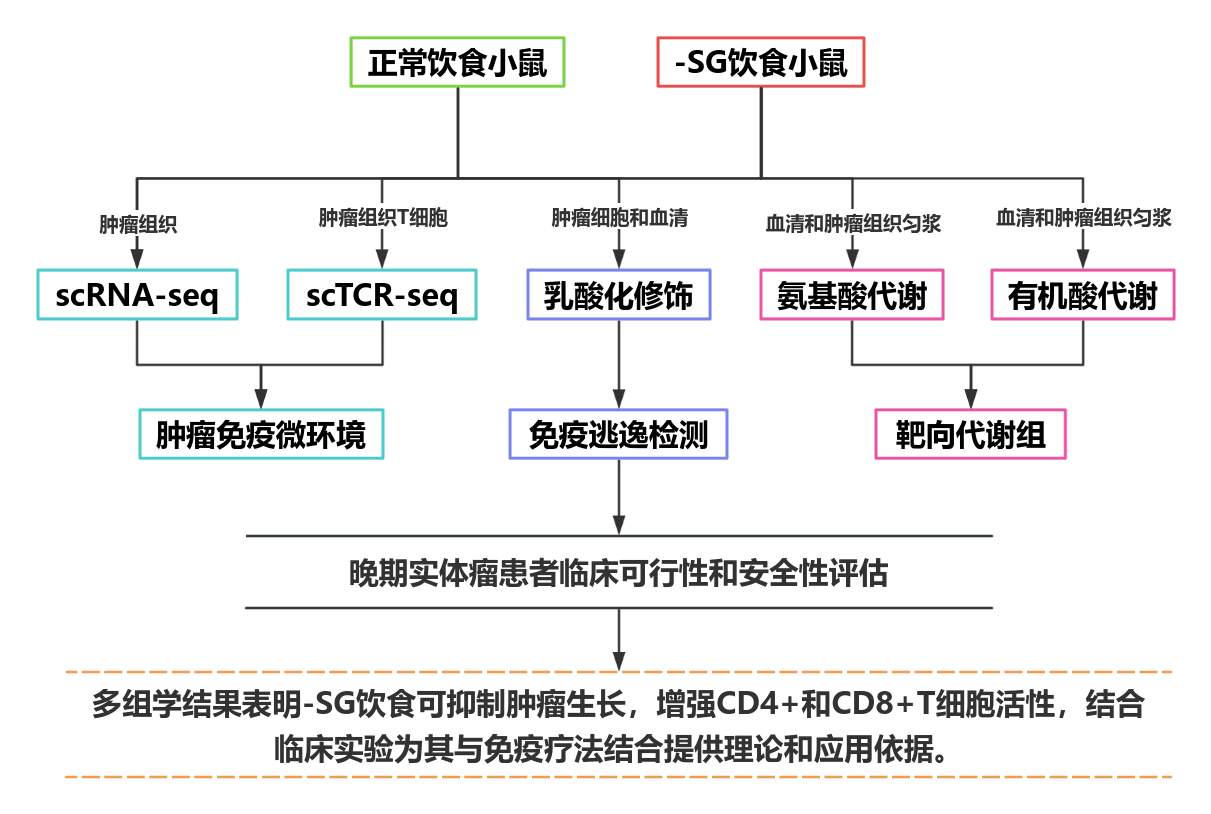
PART.3、研究结果
1.-SG饮食抑制结直肠癌生长并促进肿瘤细胞死亡
通过在小鼠模型中限制饮食中的丝氨酸和甘氨酸,研究发现-SG 饮食显著阻碍了CT26细胞在BALB/c小鼠体内的肿瘤生长。此外,通过HE染色和末端脱氧核糖核酸转移酶介导的dUTP缺口末端标记染色,观察到-SG 饮食组的肿瘤显示出更大的坏死区域和更高水平的凋亡。免疫组化检测显示,与对照组相比,-SG组的肿瘤组织中钙网蛋白和高迁移率族蛋白盒1的表达显著增加,这表明-SG可能通过诱导免疫原性细胞死亡来抑制肿瘤的发生和进展。这些发现为-SG饮食在调节系统免疫和治疗实体瘤中的潜在治疗价值提供了有力证据。
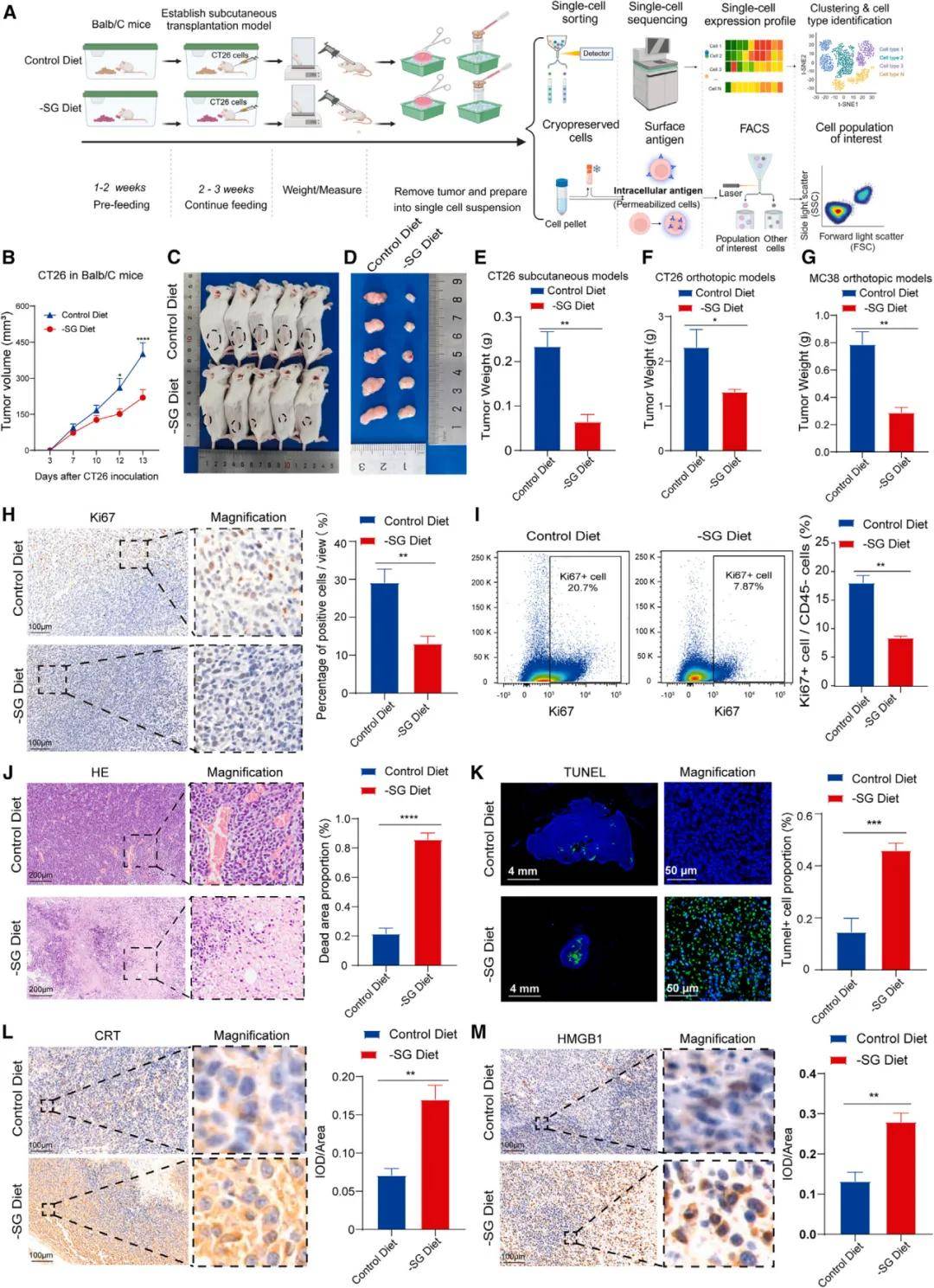
无丝氨酸/甘氨酸饮食抑制结直肠癌生长并诱导免疫原性细胞死亡
2.单细胞TCR测序(scTCR-seq)
通过单细胞T细胞受体测序(scTCR-seq)分析揭示了无丝氨酸/甘氨酸饮食对肿瘤微环境中T细胞受体(TCR)多样性和特异性的影响。-SG组的T细胞显示出更长的CDR3序列长度,以及对特定V和J基因片段的使用偏好,这表明了T细胞对肿瘤抗原具有更高的识别和反应能力。此外,-SG 饮食还导致了T细胞克隆型扩展的增加,表明T细胞对肿瘤的反应更加活跃和多样化。这些结果表明,-SG饮食通过增强T细胞的抗原特异性和多样性,促进了对肿瘤细胞的免疫反应。

无丝氨酸/甘氨酸饮食后T细胞TCR多样性的改变
3.PD-L1的乳酸化有助于延缓肿瘤PD-L1的降解
为了进一步研究PD-L1乳酸化的机制及其对肿瘤细胞的影响,我们通过WB检测了一些关键酶。此外,我们使用靶向有机酸代谢组学分析了CT26肿瘤细胞小鼠的肿瘤匀浆和血清。通过免疫沉淀选择性富集PD-L1,并通过质谱(MS)鉴定特异性乳酸化位点。结果表明-SG饮食激活HIF-1a,从而增强肿瘤中的糖酵解,进而提高乳酸水平,促进酰基转移酶GCN5的高表达。为了确认这些细胞成分在PD-L1降解中的作用,并研究乳酸化对PD-L1运输的影响,我们抑制了PD-L1的乳酸化,并检查了其在不同亚细胞器中的分布。这些一致的结果表明,PD-L1的乳酸化通过溶酶体途径阻止其降解。
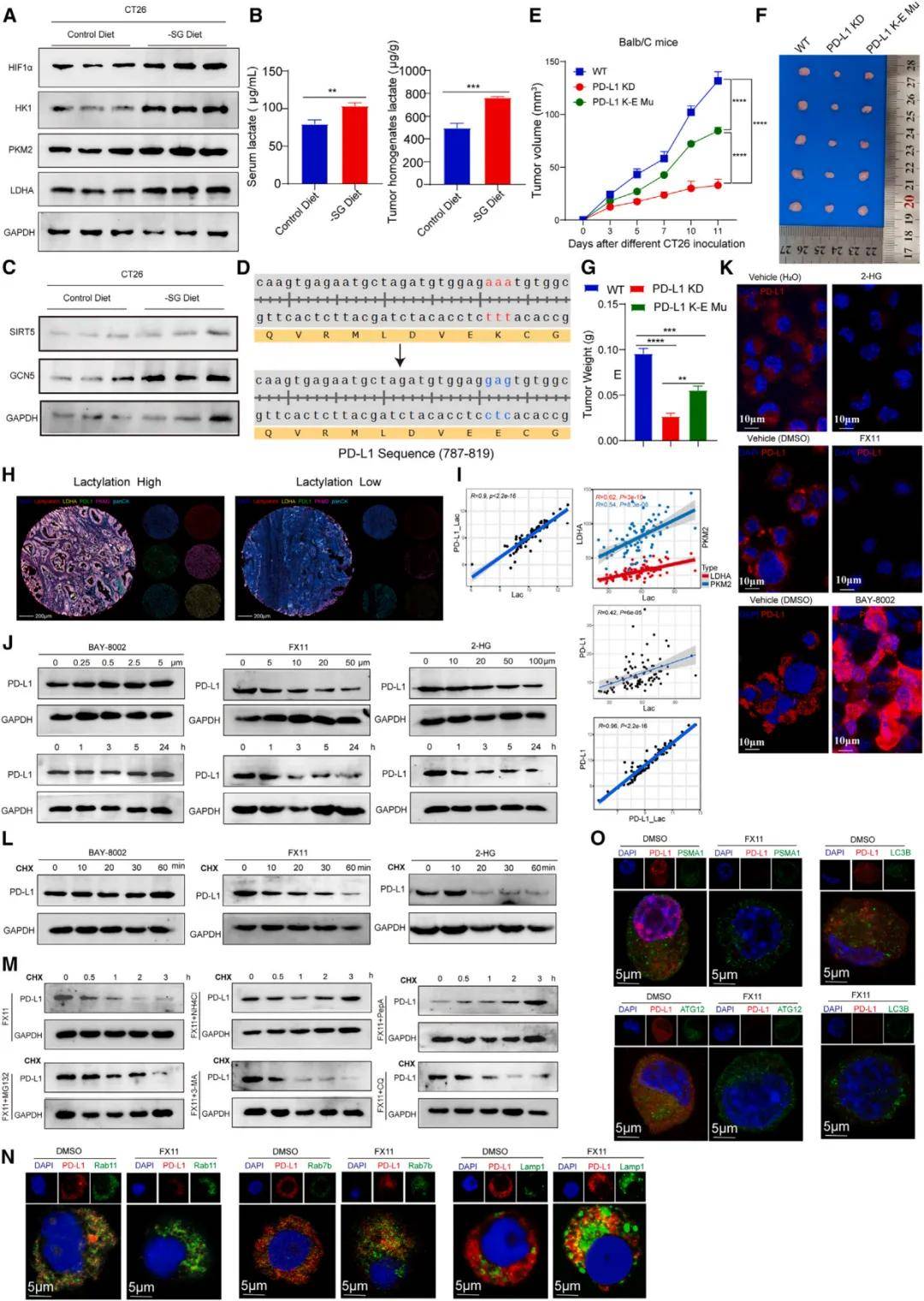
PD-L1的乳酸化有助于延缓肿瘤PD-L1的降解
4.无丝氨酸/甘氨酸饮食(-SG)在晚期实体瘤患者中的可行性、安全性评估
研究者首先通过记录和统计患者在接受-SG期间的不良事件(AEs),发现主要的不良事件为胃肠道毒性,包括腹泻、恶心和胀气,这些症状大多数为1或2级,并且可以通过常规对症治疗有效管理。此外,研究者还监测了患者的生理参数,如血液常规、肝肾功能,以及体质指数(BMI),发现这些指标在饮食周期结束后没有明显变化。通过对比治疗前后的血清氨基酸浓度,发现-SG饮食能显著降低血清中丝氨酸和甘氨酸的水平。研究者评估了SG diet对肿瘤大小的影响,发现有25%的患者达到了部分缓解(PR),65%的患者疾病稳定(SD),10%的患者疾病进展(PD),整体响应率为25%,临床受益率为90%。这些结果表明-SG饮食在晚期实体瘤患者中是一种安全且可能有效的治疗策略。
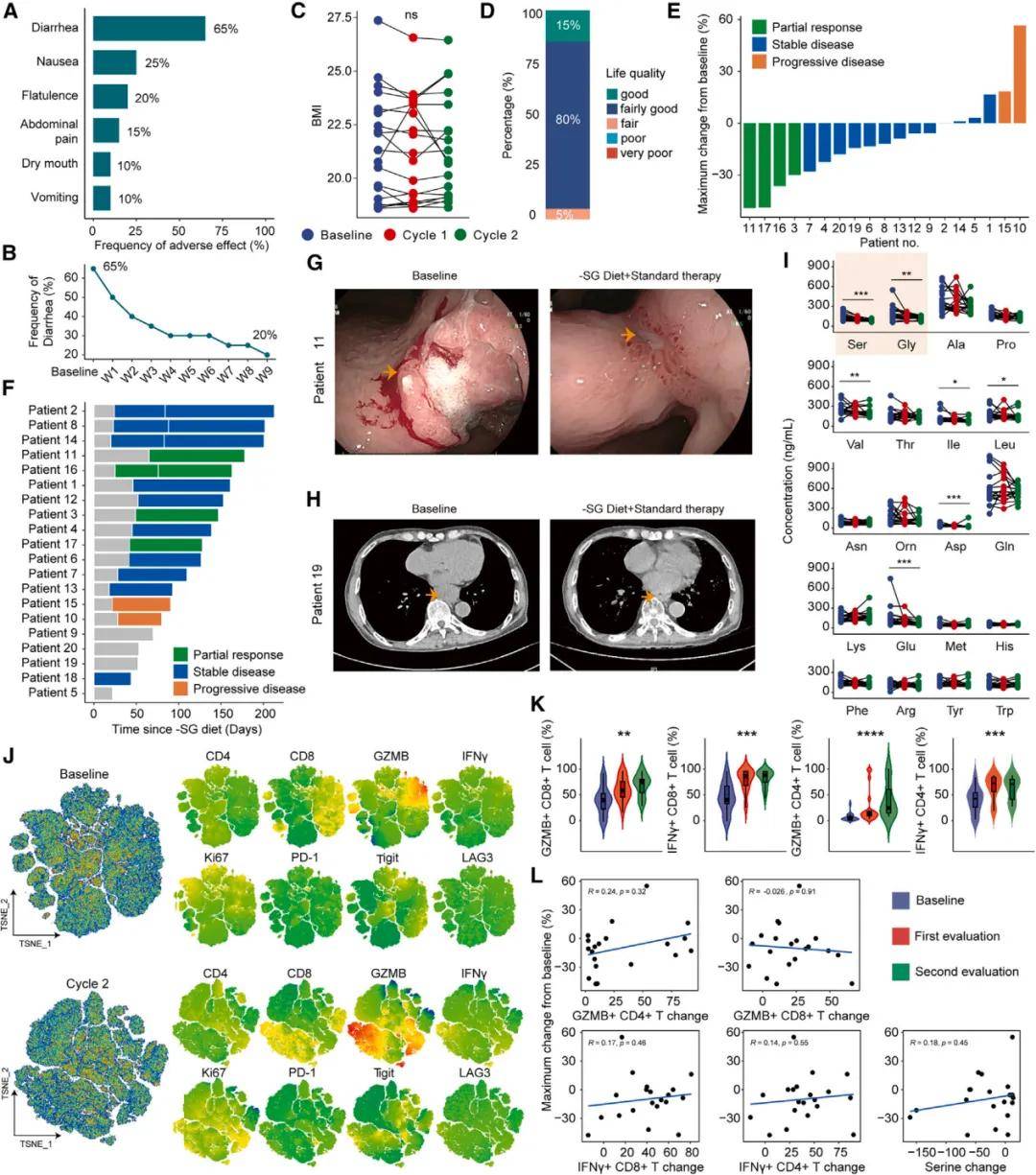
无丝氨酸/甘氨酸饮食的临床研究
PART.4、文章总结
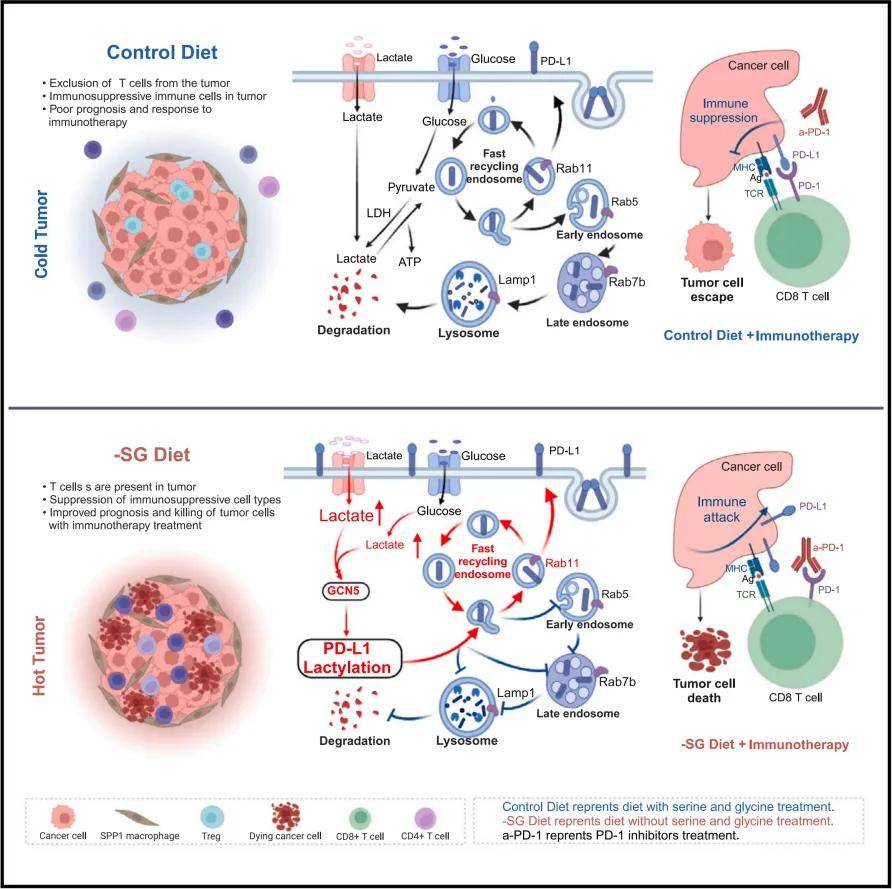
本文研究了无丝氨酸/甘氨酸饮食对结直肠癌(CRC)的双重作用,发现-SG饮食不仅能通过限制肿瘤细胞对丝氨酸和甘氨酸的吸收来抑制肿瘤生长,增强抗肿瘤免疫反应,尤其是通过促进细胞毒性T细胞的积累,还能通过诱导肿瘤细胞表面的程序性死亡配体1(PD-L1)乳酸化,增强肿瘤的免疫逃逸能力。此外,研究发现-SG饮食能够增强CD8+ T细胞的活性和抗原特异性,但其促进PD-L1乳酸化可能导致免疫疗法效果降低。临床试验结果表明,-SG饮食在晚期实体瘤患者中是可行且安全的,能够调节系统免疫,减少血清中丝氨酸和甘氨酸的水平,并提高CD4+和CD8+ T细胞的功能,为将-SG饮食与免疫疗法结合使用提供了理论基础和临床证据,展现了其在癌症治疗中的潜在应用前景。
文章索引:Tong H, Jiang Z, Song L, et,al. Dual impacts of serine/glycine-free diet in enhancing antitumor immunity and promoting evasion via PD-L1 lactylation. Cell Metab. 2024 Nov 16:S1550-4131(24)00415-7.
doi: 10.1016/j.cmet.2024.10.019. Epub ahead of print. PMID: 39577415.


