2025-03-10

文章题目:A stepwise mode of TGFβ-SMAD signaling and DNA methylation regulates naïve-to- primed pluripotency and differentiation
上海交通大学在《Nature Communications》上发表了TGFβ- SMAD信号和DNA甲基化的逐步模式调节原始到启动的多能性和分化的研究成果,影响因子14.7。本研究中ATAC-seq检测及部分数据分析工作均由上海派森诺生物科技股份有限公司完成。
01、研究背景
TGF-β信号通路在小鼠胚胎发育中扮演着重要的角色,包括胚胎模式建立,细胞命运确定和动态运动等,并且还影响胚胎干细胞的多能性和分化功能。经典的TGFβ信号传导主要通过Smad2/3与Smad4形成的复合物激活下游的靶基因。然而,越来越多的研究表明,在某些情况下,Smad2/3可独立于Smad4入核,并发挥调控作用。在小鼠胚胎发育早期,从上胚层中特异性敲除Smad4却对于TGF-β掌控的上胚层的形成影响甚微。因此探究Smad2/3独立于Smad4的调控机制尤为重要。
02、技术路线
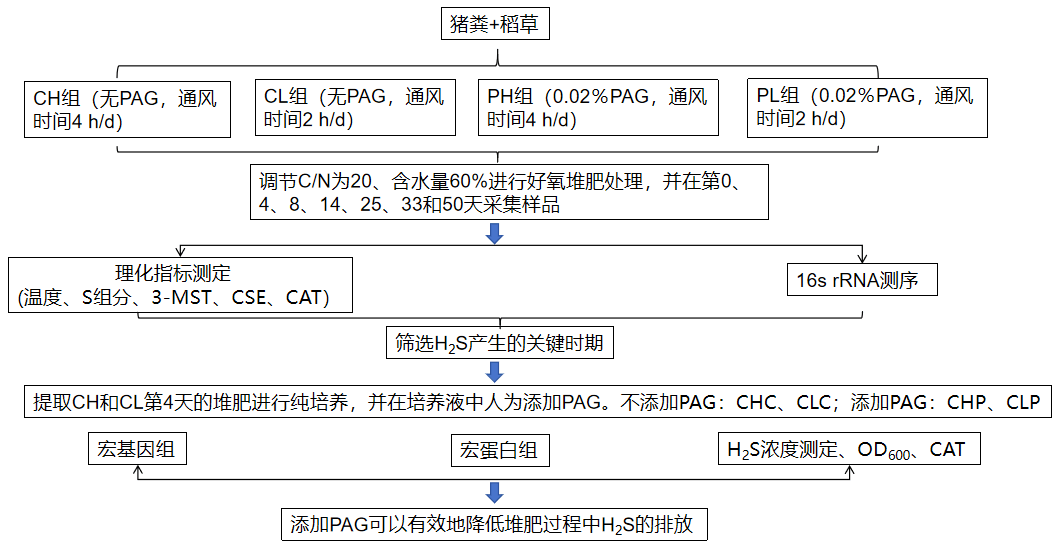
03、研究内容
S2/3DKO和S4KO的的差异转录组分析
研究首先利用CRISPR/Cas9技术生成了Smad2/3双敲除(S2/3DKO)和Smad4敲除(S4KO)的mESCs。转录组分析显示S2/3DKO和S4KO之间存在明显差异,S2/3DKO在基因表达上表现出更显著的变化(图1A-F)。基因集变异分析(GSVA)表明,S2/3DKO和S4KO对原始内胚层和植入后上胚层的决定具有不同影响。S2/3DKO促进原始内胚层的形成并抑制植入后上胚层基因的表达,而S4KO对这些过程的影响较温和(图1G-J)。
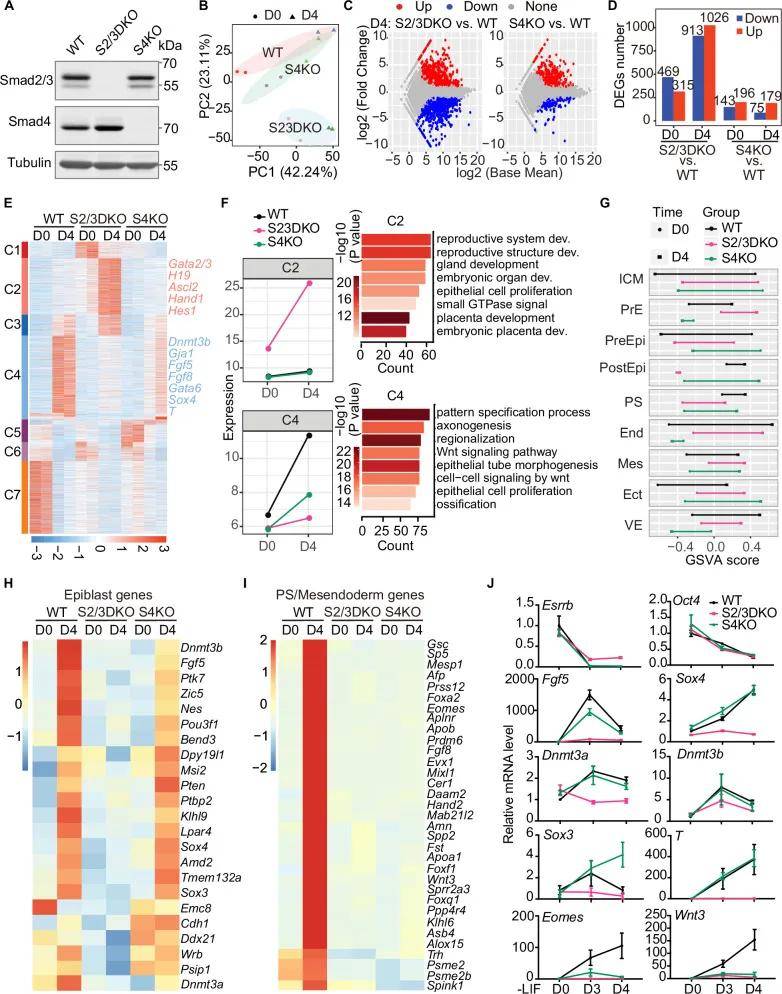 图1 mESC分化过程中Smad2/3和Smad4的差异要求
图1 mESC分化过程中Smad2/3和Smad4的差异要求
在Smad4缺失情况下,外胚层(Epiblast)可以形成
作者将已建立的系统WT、S2/3DKO和S4KO的mESCs转化为外胚层样细胞(EpiLCs),结果发现WT和S4KO mESCs逐渐发生了典型的EpiLCs形态转变,而S2/3DKO mESC保留mESC克隆形式(图2A-B)。之后通过 ChIP-seq 和 CUT&Tag 技术,检测 Smad2/3 和 Smad4 在基因启动子和增强子上的结合情况。结果表明Smad2/3在促进从原始mESCs到启动EpiLCs的转变中的关键作用。Smad4作为TGF-β信号传导的经典Smad2/3-Smad4复合物的一部分,在诱导中胚层调节因子中发挥次要作用(图2C-E)。
 图2 Smad4缺失情况下的外胚层形成
图2 Smad4缺失情况下的外胚层形成
Dnmt3b与Smad2/3互作
作者为了探索Smad2/3独立调控外胚层基因的潜在机制,对来自WT和S4KO的D3 EBs进行了Smad2/3质谱共免疫沉淀(IP-MS)分析,结果发现Smad2/3 可以和 Dnmt3b 相互作用(图3A-E)。在从初始多能性向诱导多能性转变过程中,Smad2/3上调Dnmt3b,且这种上调对形成上胚层很重要。在野生型(WT)和S4KO细胞中敲低Dnmt3b会影响上胚层基因的表达,突显了Dnmt3b在该过程中的重要性(图3F-H)。
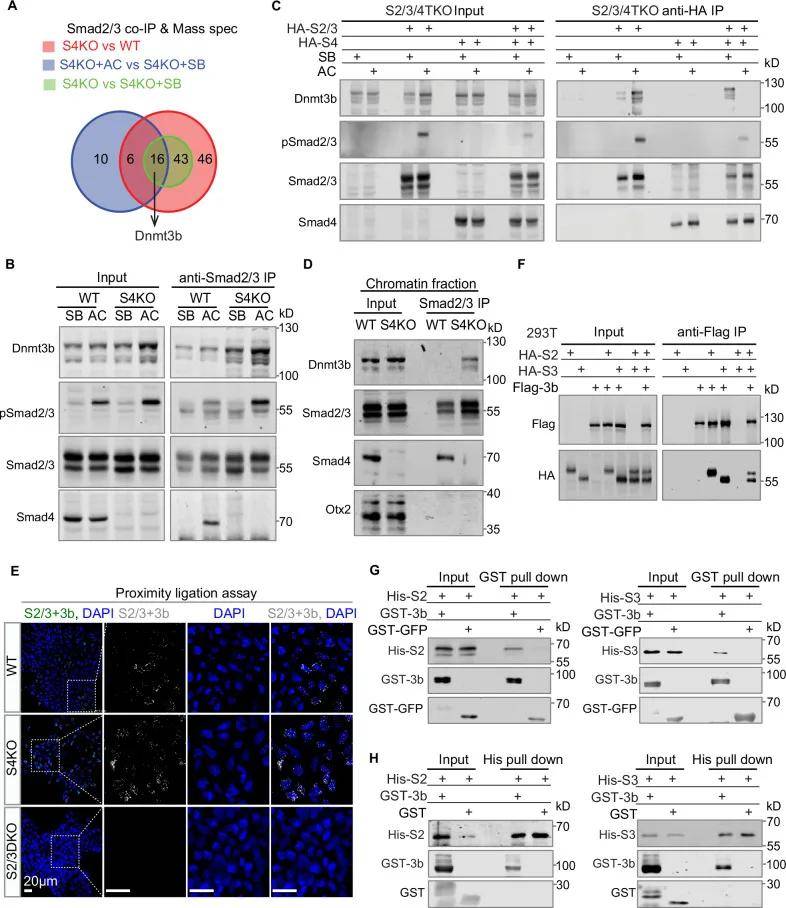 图3 Dnmt3b与Smad2/3互作
图3 Dnmt3b与Smad2/3互作
Smad2/3上调Dnmt3b对外胚层形成至关重要
在mESC启动过程中,Dnmt3b在S2/3DKO EBs中部分下调,但在S2/ 3/4TKO中大部分被阻断。表明Smad2/3和Smad4都可以调节Dnmt3b的表达,但Smad2/3更占优势,Smad2/3在mESC启动过程中刺激Dnmt3b的表达,从而促进上皮细胞的形成。
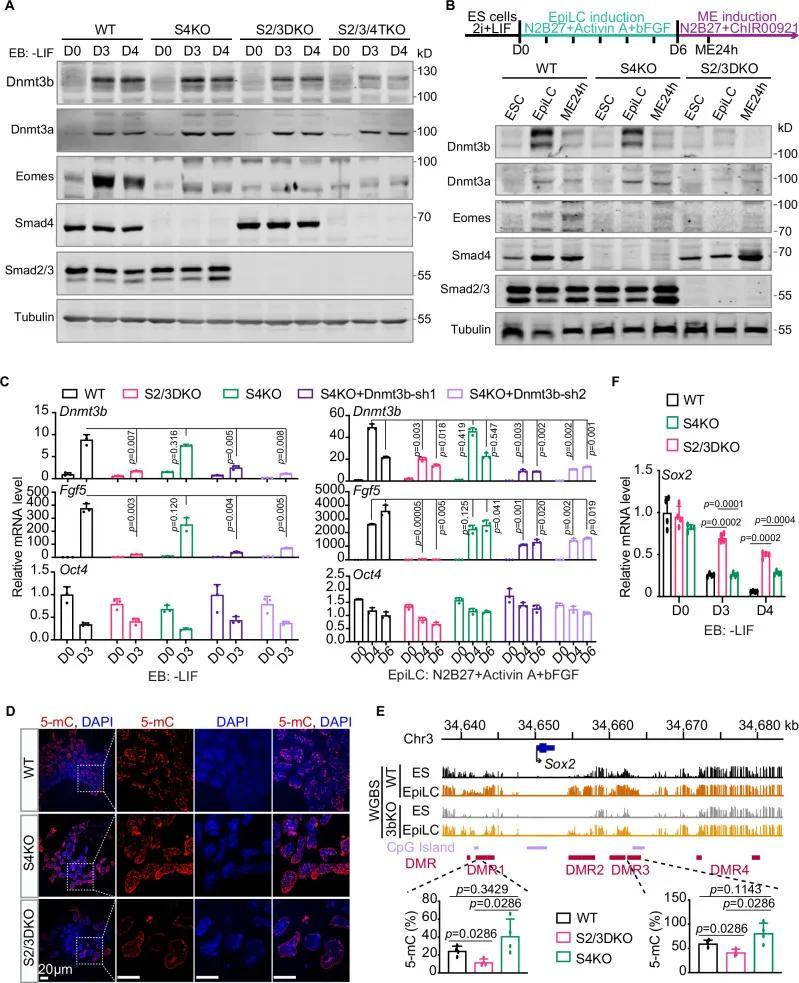 图4 Smad2/3上调Dnmt3b对外胚层形成非常重要
图4 Smad2/3上调Dnmt3b对外胚层形成非常重要
Dnmt3b独立于Smad4介导Smad2/3与外胚层基因结合
作者用表达野生型Dnmt3b的慢病毒载体感染S4KO +Dnmt3b-sh2细胞(催化失活的Dnmt3b失去DNA甲基化能力)有效地挽救了Fgf5和T在S4KO+Dnmt3b-sh2 EBs中的表达,结果表明表明DNA甲基化和Dnmt3b的h3k36me2 /3关联能力是激活S4KO引物外胚层基因所必需的。Dnmt3b能直接与Smad2/3互作并促进Smad2/3结合到上胚层顺式作用元件中心的低甲基化区域。始发态细胞开始分化时,Dnmt3b 对全局基因组甲基化的参与减少,Smad4 接过接力棒,与 Smad2/3 形成复合物,支持中内胚层的诱导。
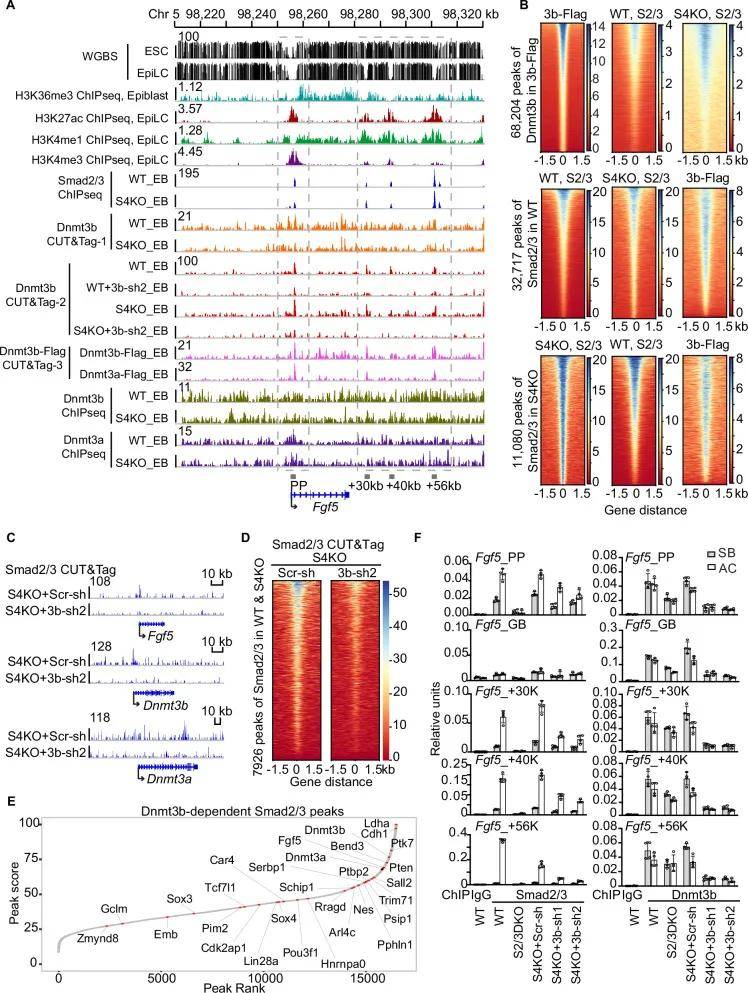 图5 Dnmt3b独立于Smad4介导Smad2/3与外胚层基因结合
图5 Dnmt3b独立于Smad4介导Smad2/3与外胚层基因结合
04、研究结论
本研究通过RNA-seq、ChIP-seq、CUT&Tag、ATAC-seq、WGBS等分析揭示了Smad2/3在mESCs向EpiLCs转变过程中通过诱导Dnmt3b表达来调控DNA甲基化模式,从而促进原始态多能性向始发态多能性的转变。同时还揭示了在Smad2/3缺失情况下,Smad4单独不能启动Epiblast特异性基因转录。在分化过程中,Dnmt3b活性降低,Smad4与Smad2/3形成复合物,支持中胚层和内胚层的诱导。总之这项工作阐明了信号传导和表观遗传的协同作用机制,进而为理解TGFβ信号在生理学和病理学中的作用提供了新的思路。
原文索引:Zhao B, Yu X, Shi J, Ma S, Li S, Shi H, Xia S, Ye Y, Zhang Y, Du Y, Wang Q. A stepwise mode of TGFβ-SMAD signaling and DNA methylation regulates naïve-to-primed pluripotency and differentiation. Nat Commun. 2024 Nov 22;15(1):10123. doi: 10.1038/s41467-024-54433-5


