
2025-04-11

文章题目: miR-29b-triggered epigenetic regulation of cardiotoxicity following exposure to deltamethrin in zebrafish
技术手段:miRNA测序、mRNA测序、显微注射、免疫荧光染色、组织学染色、qPCR等
浙江大学李舒盈在《Journal of Hazardous Materials》上发表了通过mRNA测序和miRNA测序等技术揭示了溴氰菊酯诱导的斑马鱼心脏毒性及其表观遗传调控机制,特别是miR-29b的上调和dnmts的抑制在心脏发育异常中的关键作用。
本研究的mRNA测序和miRNA测序以及部分数据分析工作由上海派森诺生物科技股份有限公司完成。
文章亮点
1.综合技术手段:结合miRNA测序、mRNA测序、显微注射、免疫荧光染色等多种技术,全面解析了溴氰菊酯的心脏毒性及其分子机制。
2.功能验证实验:通过miR-29b模拟物和抑制剂的注射实验,验证了miR-29b在心脏毒性中的关键作用,并进一步探讨了其与DNA甲基转移酶(dnmts)的关系。
3.跨代毒性:发现溴氰菊酯的表观遗传效应可以传递给后代,导致F1代胚胎中miR-29b表达上调和dnmt1表达下调,进一步证实了其跨代毒性。
4.dnmts的调控机制解析:揭示了miR-29b通过抑制dnmts(DNA甲基转移酶)导致低甲基化,从而影响心脏发育相关基因的表达。
研究背景
溴氰菊酯(deltamethrin)是一种广泛使用的拟除虫菊酯类杀虫剂,常用于农业、水产养殖和医药领域。研究表明,溴氰菊酯对水生生物具有毒性,尤其是在发育中的鱼类中,可诱导心脏畸形等发育异常。此外,溴氰菊酯还可能通过表观遗传机制(如miRNA和DNA甲基化)对生物体产生跨代毒性效应。然而,关于溴氰菊酯对斑马鱼发育的表观遗传影响的研究相对较少。因此,本研究旨在探讨溴氰菊酯诱导的心脏毒性和其潜在的表观遗传调控机制。
技术路线
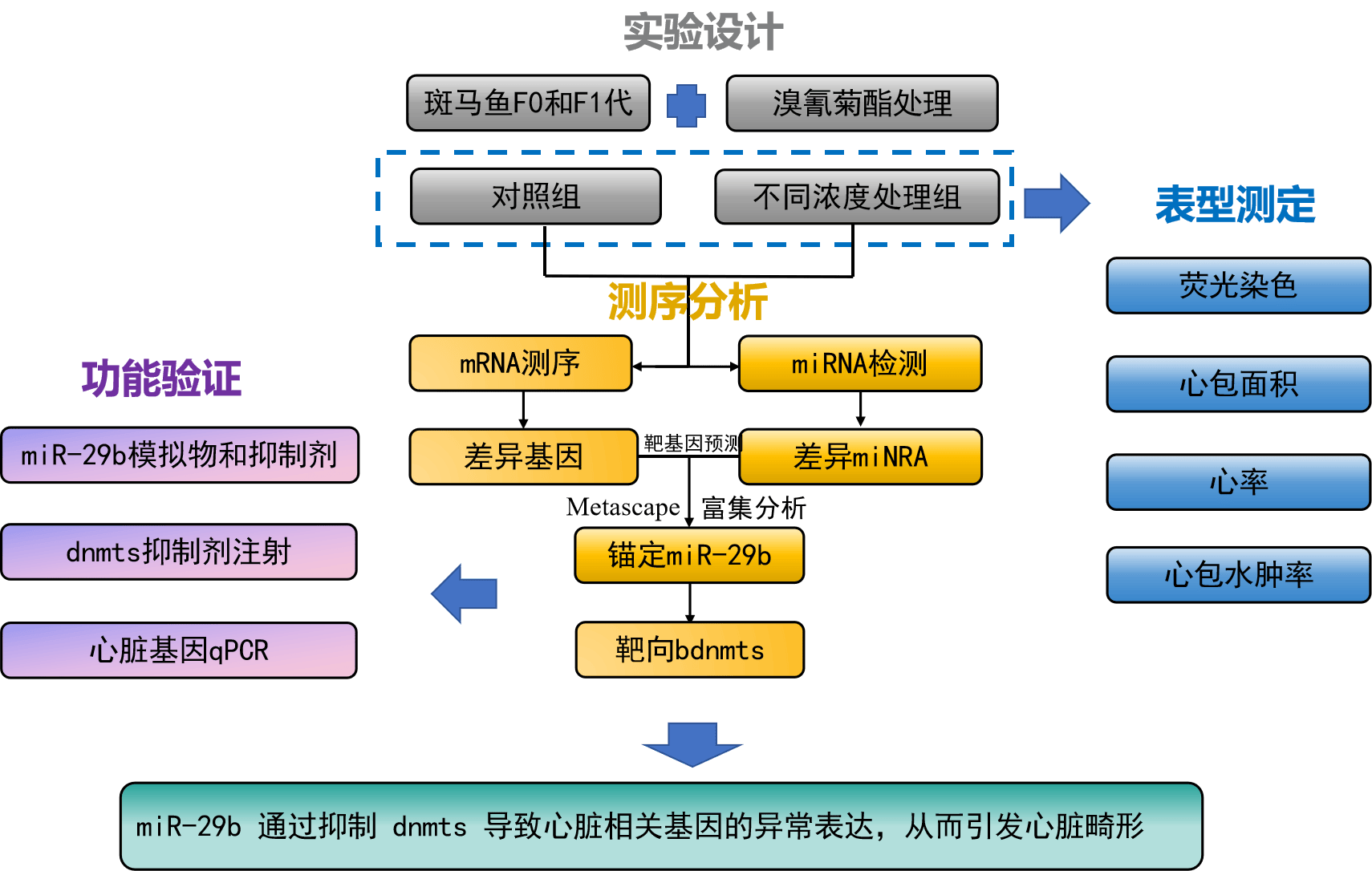
主要研究结果
1.溴氰菊酯暴露影响斑马鱼繁殖并导致后代心脏异常
本研究设置了不同浓度的处理组,以观察斑马鱼在溴氰菊酯环境下所受影响。结果表明,亲代斑马鱼暴露于溴氰菊酯会导致后代在受精率、心包水肿率、心率和死亡率方面的显著变化,尤其是雄性斑马鱼的繁殖能力受到更大影响。这表明溴氰菊酯对斑马鱼的繁殖和后代发育具有显著的毒性效应)(图1A-F)。
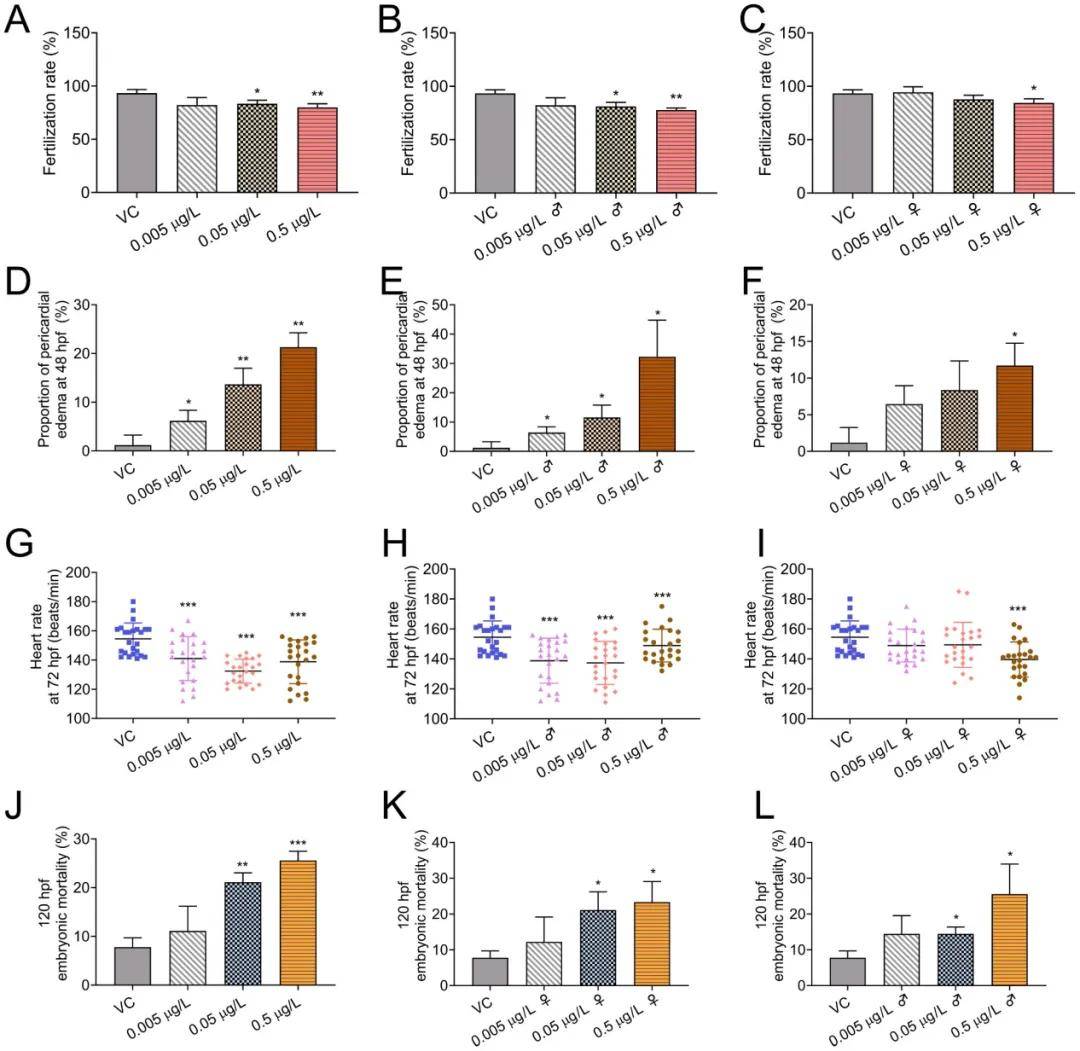
图1:成年斑马鱼暴露于溴氰菊酯后,其繁殖性能和后代发育的影响
2.溴氰菊酯暴露诱导斑马鱼心包水肿
斑马鱼幼体心包荧光染色、心率以及心包面积测定结果显示,溴氰菊酯暴露对斑马鱼幼虫的心脏发育和功能具有显著的毒性效应,表现为心包水肿和心率下降(图2B、C),且这种效应呈剂量依赖性。这提示溴氰菊酯可能通过干扰心脏发育相关机制来诱导心脏毒性。
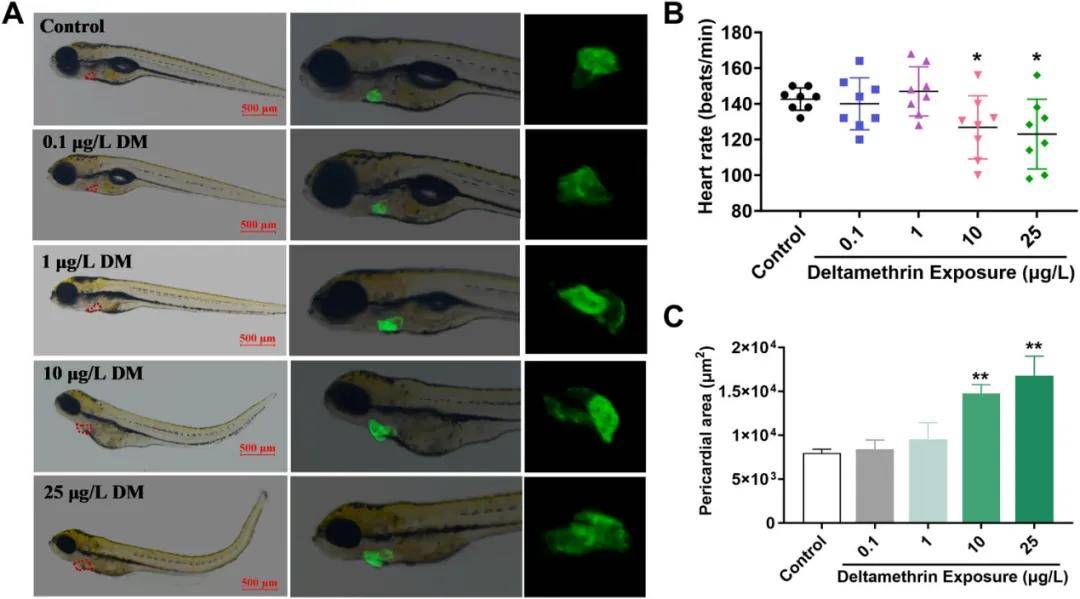
图2:斑马鱼幼体心包荧光染色、心率以及心包面积
3.miRNA和mRNA测序和生物信息学分析
本研究对CK组和25µg/L溴氰菊酯暴露处理组的miRNA和mRNA测序,进一步探知溴氰菊酯对斑马鱼发育的表观遗传影响。
差异分析得到9个差异miRNA(图A),先前的研究表明,miR-29b除了在心肌纤维形成中的作用外,还可以调节心脏发育,因此选择miR-29b进一步分析。并且通过不同物种miR-29b序列保守性的比较(图B)和分析斑马鱼、人类和小鼠中的表达分布(图C)获知dre-miR-29b和hsa-miR-29b可能与下游基因具有相似的靶向关系。
通过TargetScanFish进行靶基因预测,并与差异mRNA取交集,获得98个上调基因和26个下调基因。使用Metascape中的人类数据库对dre-miR-29b调节的DEGs进行KEGG富集分析,结果表明与miR-29b相关的调节性DEGs主要富集在神经元发育、心肌肥大和疾病信号传导中(图4D)。
用KoBas预测了dre-miR-29b的作用机制,这证实了miR-29b靶向的DEGs可以与心脏发育和DNA甲基化相关的标记基因相互作用(图4E)。
综上,作者推测溴氰菊酯暴露引起的心脏毒性很可能与miR-29b的上调有关。
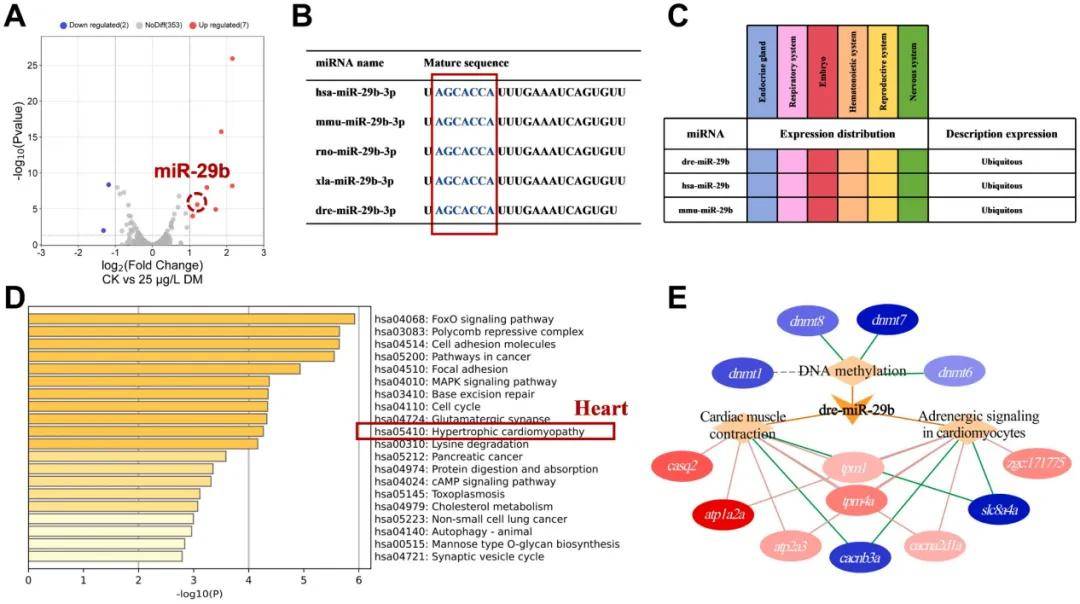
图3:miRNA、mRNA测序分析以及miR-29b调控网络
4.miR-29b异常表达干扰心脏发育和功能
miR-29b模拟物和抑制剂注射后的斑马鱼心包面积、心率和心包水肿率(图4C-F),以及心脏相关基因(nppa、nppb、foxo3a)表达的影响表达变化(图4G-I)。这些结果表明,miR-29b的过表达对斑马鱼心脏发育和功能具有显著的负面影响,表现为心包水肿、心率下降和心脏相关基因表达的异常。而抑制miR-29b则能够减轻这些异常。
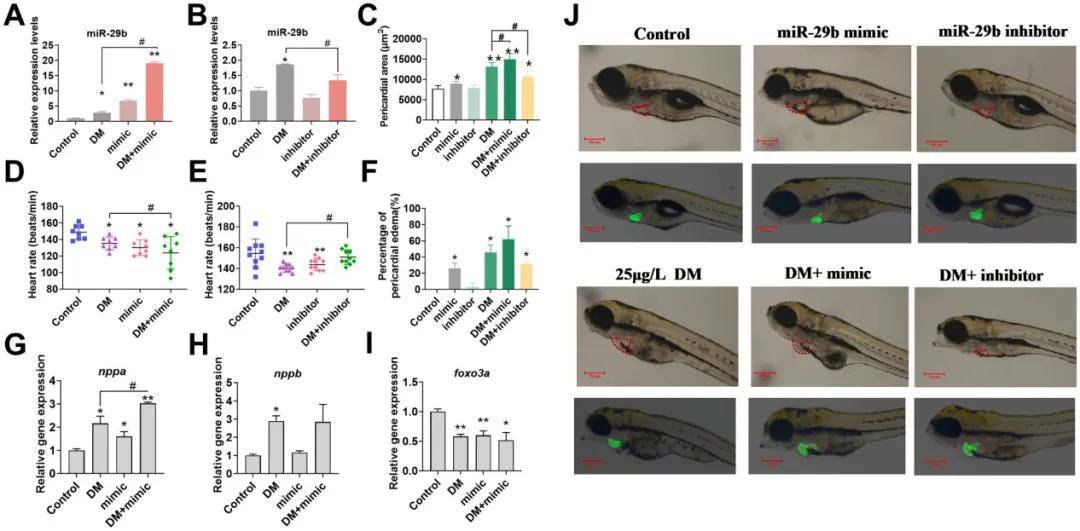
图4:注射miR-29b模拟物和抑制剂后幼鱼表型变化
5.通过抑制dnmts过表达miR-29b诱导畸形
鉴于miR-29b和心脏基因之间没有直接结合位点,先前的一项研究证实,miR29b反向调节dnmts,并且由于抑制dnmts导致的低甲基化会导致斑马鱼发育畸形。miR-29b可能靶向dnmt6和dnmt8,同时影响dnmt1。
为了实现对dnmts的抑制,将DNA甲基转移酶(dnmt)抑制剂5-氮杂胞苷(5-aza)注射到1-4细胞胚胎中。发现注射5-氮杂胞苷导致心包面积显著增加,心率降低等,5-氮杂胞苷和溴氰菊酯的组合会导致更严重心脏畸形变化(图5I-L)。

图5:抑制斑马鱼胚胎中dnmts诱导的心脏疾病
6.成年和幼鱼的miR-29b 和dmnt1在不同处理下的变化
结果表明,溴氰菊酯的表观遗传效应可以传递给后代,导致F1代胚胎中miR-29b表达上调和dnmt1表达下调。这表明溴氰菊酯通过影响亲代的表观遗传机制,对后代的心脏发育和功能产生负面影响。这些发现进一步支持了溴氰菊酯诱导的心脏毒性和其跨代效应的表观遗传机制。
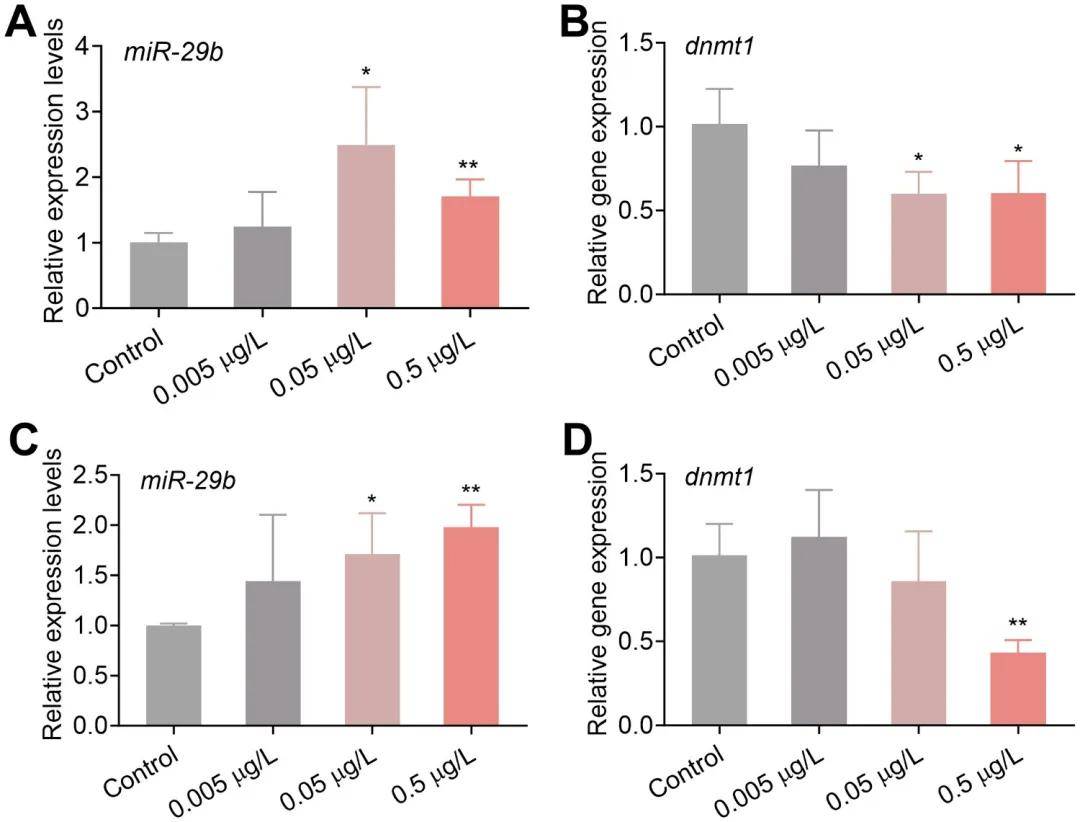
图6:F0和F1代斑马鱼中的表观遗传效应
研究结论
实验发现,溴氰菊酯暴露会影响斑马鱼心包面积、心率和心包水肿率等表型变化。miRNA和mRNA测序分析发现,miR-29b靶向DEGs富集在心脏毒性相关通路,推测miR-29b可能影响心脏毒性。miR-29b的过表达和抑制实验表现出其对斑马鱼心脏发育和功能具有显著的负面影响,证实miR-29b在溴氰菊酯诱导的心脏毒性中起关键作用。
鉴于miR-29b和心脏基因之间没有直接结合位点,但miR29b反向调节dnmts(DNA甲基转移酶),推测dnmts可能是miR-29b干扰心脏发育的关键因素。并且通过注射DNA甲基转移酶(DNMT)抑制剂5-氮杂胞苷(5-aza),斑马鱼心包面积表型发生变化,心脏相关因子相关的基因的mRNA表达也显示出异常。
综上结果表明,miR-29b 通过抑制 dnmts 导致心脏相关基因的异常表达,从而引发心脏畸形。本研究有助于了解糖尿病引起的心脏毒性及其潜在的表观遗传毒性机制,为评估其风险提供参考。
原文链接:https://www.sciencedirect.com/science/article/abs/pii/S0304389424017928