
2025-07-15
文章题目:FRRS1L variants and ferriheme overload drive hyperpigmentation and systemic iron overload in lapping black bone sheep
本研究由中国农业大学动物科技学院邓学梅团队,于2025年6月25日在Cell & Bioscience期刊在线发表,本研究的转录组测序以及部分数据分析工作由上海派森诺生物科技股份有限公司完成。
文章亮点
深山奇羊,待解之谜
乌骨羊,这一珍稀的绵羊种群,仅发现于我国云南兰坪、剑川、香格里拉等横断山脉高海拔地区。其外表与普通绵羊无异,但剖开躯体,可见骨骼乌黑、内脏深褐、肌肉暗红,血液更是呈现罕见的暗黑色。自2001年被科学记载以来,其黑色本质一直成谜,早期推测与乌骨鸡类似,源于黑色素细胞在胚胎期的异常迁移,引发黑色素沉积。然而,一直缺乏确凿的遗传证据。作为自然赐予的独特模型,解析乌骨羊黑色之谜不仅具有重要的基础科学意义(探索色素沉积的新机制),更蕴含着巨大的潜在经济价值(特色健康食品与生物医药资源)。中国农业大学邓学梅教授团队联合国内外科研机构,历经数年攻关,终于揭开了这一自然奇迹的面纱。
摘 要
乌骨羊(Lanping Black Bone Sheep, LP-BBS)是发现于中国云南横断山脉高海拔地区(2000-4000米),世界独一无二的珍稀绵羊遗传资源,其骨骼、内脏、肌肉乃至血液均呈现独特的暗黑色,在民间被视为滋补佳品。但长久以来,其乌质特性的本质始终没有得到科学解释。曾被误认为是类似乌骨鸡的黑色素沉积所致。该项研究综合利用基因组学、转录组学、组织病理学、细胞生物学及生物化学等多学科技术,系统解析了乌骨羊的“乌骨”之谜。研究发现,乌骨羊的全身性色素沉着实为高铁血红素(Ferriheme)过载所致,这是一种由血红蛋白代谢异常引发的遗传性全身性铁过载综合征。全基因组关联分析(GWAS)和选择信号扫描,锁定关键调控基因FRRS1L,其3’非翻译区(3’-UTR)的特异性突变(g.4852G>T 和 g.1016C>A)显著降低了该基因在巨噬细胞和网状内皮细胞中的表达。功能研究表明,FRRS1L蛋白通过其DOMON结构域参与血红素/铁识别,其表达不足导致巨噬细胞内三价铁还原能力下降,从而引发高铁血红素在全身多脏器(肾、肝、脾、肺、淋巴结、生殖系统等)累积,表型呈现“乌质”特征。高铁血红素沉积伴有局部氧化应激、系统性炎症及器官损伤(如肾小管损伤、卵泡闭锁),高海拔低氧环境被发现是乌质表型发生的重要协同因素。该研究首次揭示了FRRS1L基因在铁代谢中的全新功能,首次提出了哺乳动物全身性高铁血红素过载的自然模型,为人类铁过载相关表型(如血色素沉着症)的研究提供了新视角和新靶点。同时,也为乌骨羊作为特色高铁血红素富集家畜产品和潜在药用价值的遗传资源的科学保护、分子育种及高附加值产品(高铁功能性肉制品、铁补充剂)的开发奠定了科学基础。未来研究将聚焦于FRRS1L调控铁代谢的精细机制、环境-基因互作模型优化及乌骨羊加工产品的深度开发。
结果与分析
1. 黑色本质揭秘:非黑色素,乃高铁血红素过载
研究团队首先排除了黑色素沉积的可能性:
组织学与免疫组化:乌骨羊色素沉着组织中缺乏黑色素细胞标志物(酪氨酸酶、S-100、MITF)。
关键基因表达:调控黑色素合成的核心基因(TYR, MC1R, Agouti)在乌骨羊(LP-BBS)与同地域普通羊(LP-NBS)间的表达无显著差异。
色素化学分析:高效液相色谱(HPLC)与质谱(HPLC-MS)鉴定明确显示,提取的黑色物质其吸收峰与标准品高铁血红素(Ferriheme,峰值为氯化高铁血红素)高度匹配,显著区别于乌骨鸡黑色素或墨鱼汁黑色素 (图1G, H)。深入分析揭示了铁代谢相关指标的表现:
血液生理指标变化:乌骨羊红细胞计数、血红蛋白浓度、血清和肾脏中铁含量均极显著高于普通羊,而负责铁转运的转铁蛋白(Transferrin)水平显著降低 (图1D, E, F)。
组织学变化:高铁血红素广泛沉积于全身各系统的巨噬细胞和网状内皮细胞内 (图1B, C),伴有显著氧化应激(谷胱甘肽过氧化物酶GPX1/GSH-PX、丙二醛MDA升高,图2A, B) 和系统性轻度炎症(多器官炎性细胞浸润,图2D),导致少量肾小管上皮细胞损伤坏死 (图2C) 及轻度生殖系统病变(卵泡闭锁、子宫细胞部分坏死,图2E)。
结论1:乌骨羊的“乌骨”现象本质是血红蛋白代谢障碍导致的全身性高铁血红素过载,伴随系统性铁代谢紊乱和多器官病理损伤。
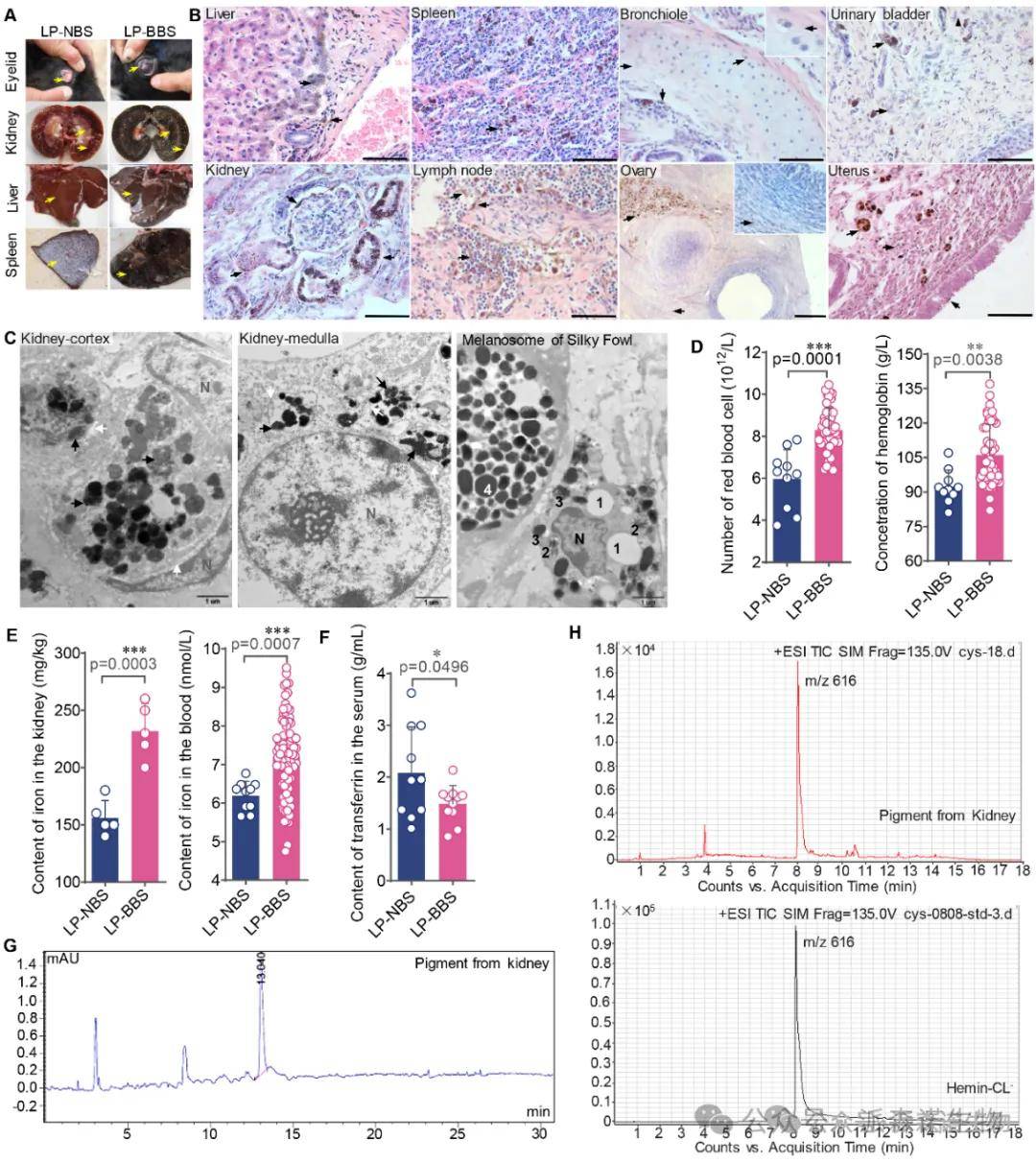
图1. 乌骨羊的乌质表型与黑色物质特征鉴定
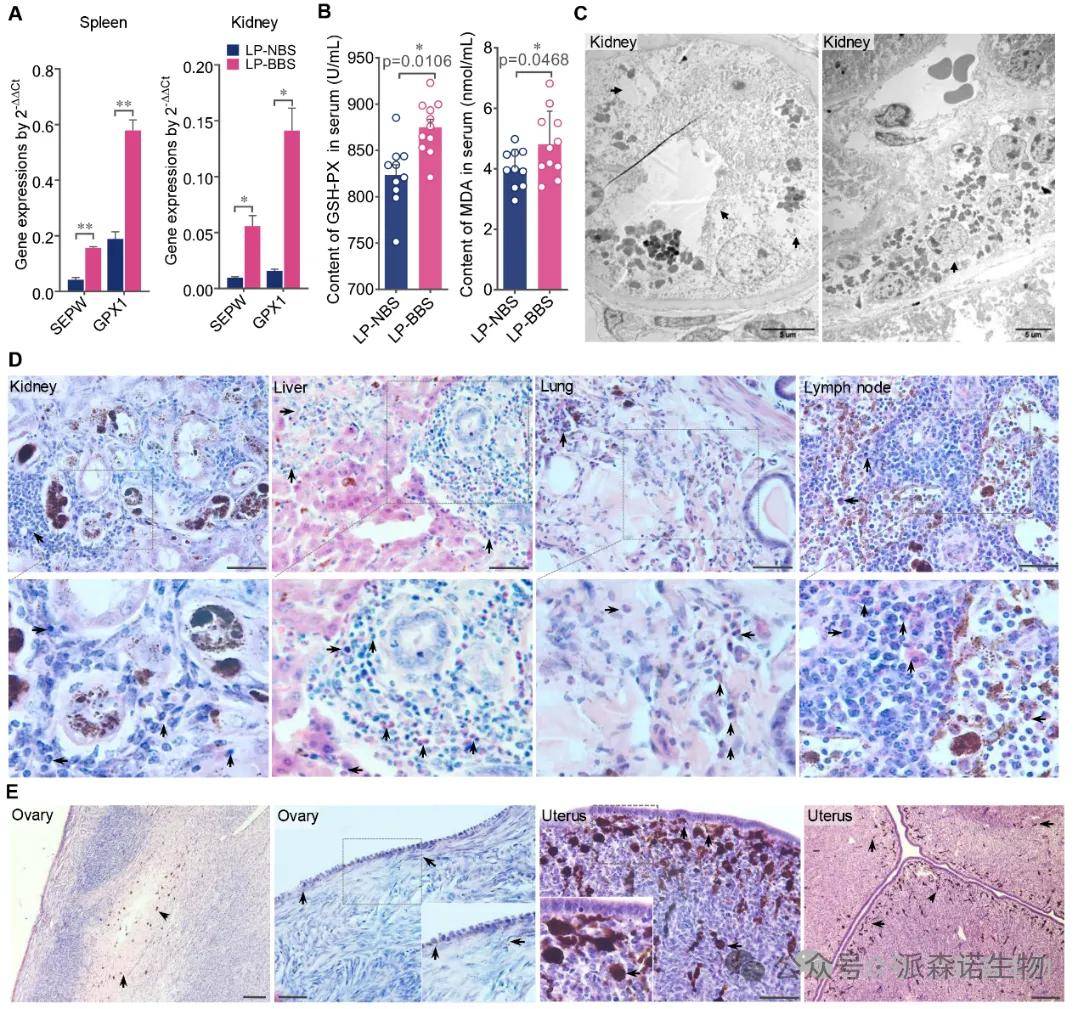
图2. 乌骨羊体内色素沉积对组织器官的潜在影响
2. 基因寻踪:锁定FRRS1L及其关键突变
为追溯铁代谢异常的遗传根源,团队展开了系统基因组学研究:
群体遗传与选择信号分析:对来自横断山脉不同海拔地方的乌骨羊(LP-BBS, n=16)、同地域非乌骨羊(LP-NBS, n=5)及周边其他普通羊种群(n=26)进行基因组测序(NGS)。基于群体分化指数(Fst)和核苷酸多样性比值(θπ)分析,筛选出677个受选择基因。功能富集显示这些基因与离子通道、金属结合(尤其是镁、锌)及转移酶活性相关,暗示其可能与血红素代谢和铁转运存在关联。
全基因组关联分析(GWAS):利用乌骨羊公羊(n=3)与萨福克母羊(n=42)杂交建立的具有清晰铁过载表型分离的群体(n=42)进行GWAS分析,鉴定出与表型显著关联的SNP位点。
关键基因定位:将NGS选择信号与GWAS结果联合分析,成功锁定位于绵羊2号染色体上的FRRS1L (Ferric Chelate Reductase 1 Like) 基因 (图3E)。该基因编码的蛋白含有DOMON结构域,已知参与血红素和铁的识别。
关键突变验证:在FRRS1L基因的3’-UTR区域发现两个特异性高频突变位点:g.4852G>T (T等位基因频率在LP-BBS中达0.92) 和 g.1016C>A (A等位基因频率在LP-BBS中达0.79)。这两个突变在非乌骨羊群体中频率均为0 (图4F)。群体遗传分析表明该表型可能受主效基因控制并受多基因修饰,呈显性遗传模式。
结论2:FRRS1L是导致乌骨羊高铁血红素过载的关键候选基因,其3’-UTR区域的特异性突变(g.4852G>T 和 g.1016C>A)与表型高度关联。
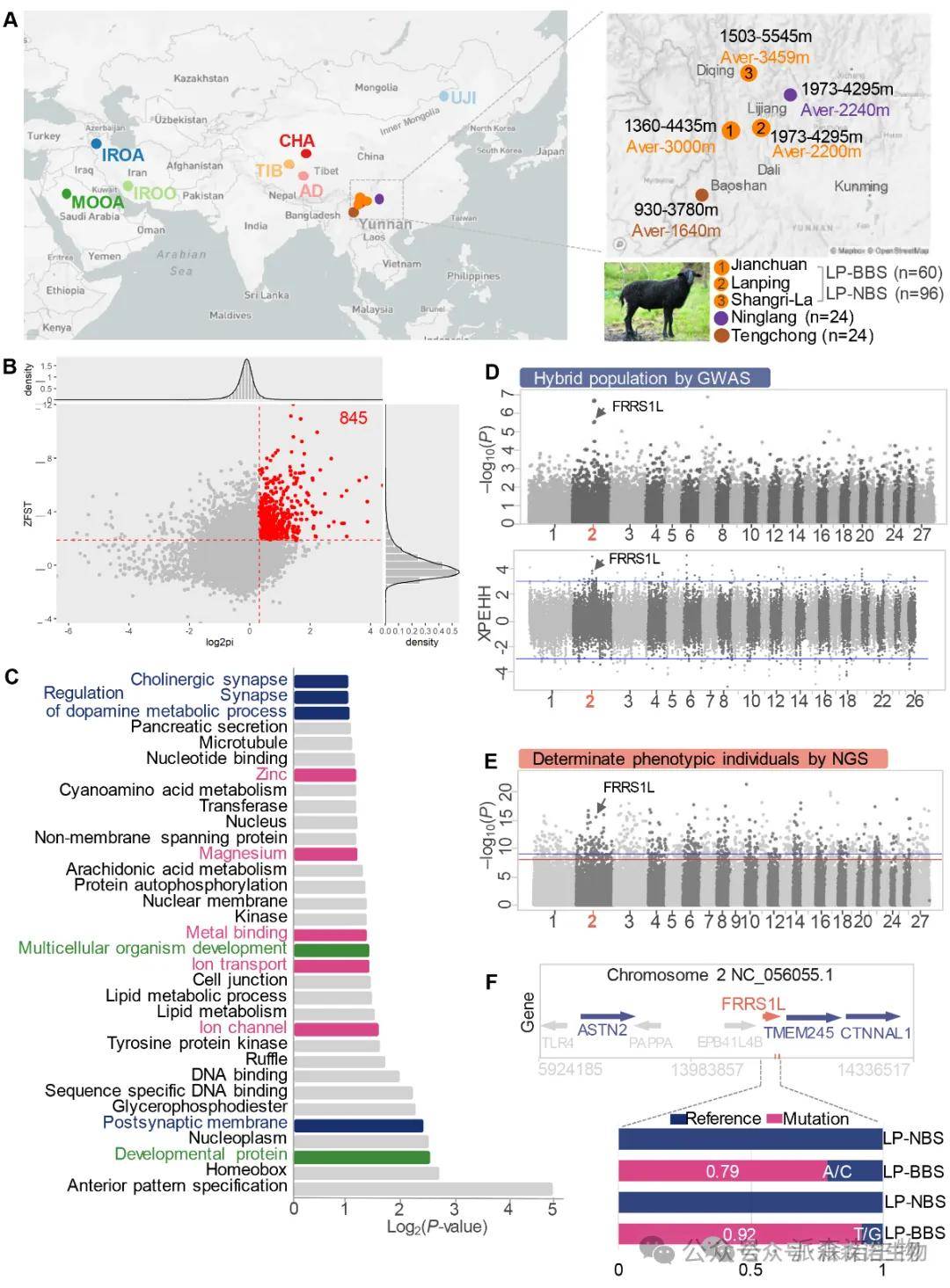
图3. 乌骨羊基因组选择信号定位和关键调控基因挖掘
3. 机制解析:FRRS1L突变导致其蛋白表达下调,引发细胞内铁氧化还原失衡
为阐明FRRS1L突变如何导致“乌质”表型,团队进行了深入的功能验证:
突变影响基因表达:对FRRS1L 基因3’-UTR区域(含6个SNP)进行双荧光素酶报告基因检测,证实g.4852G>T (SNP6) 和 g.1016C>A (SNP2) 能显著降低报告基因表达,尤其是g.4852G>T (图4B)。这与乌骨羊组织中FRRS1LmRNA和蛋白表达水平均显著低于普通羊的结果一致 (图4C-E)。
细胞模型验证:体外培养普通羊(无色素沉着)的肺泡巨噬细胞。当暴露于乌骨羊来源的高铁血红素时,巨噬细胞能吞噬高铁血红素 (图5B)。更重要的是,利用RNA干扰技术特异性敲低巨噬细胞内源性的FRRS1L或其同源物FRRS1的表达后,细胞质内出现大量高铁血红素颗粒沉积 (图5D),成功复现了乌骨羊体内的表型。HPLC分析确认细胞累积的色素即为高铁血红素 (图5E, F)。同时,高铁血红素的积累或FRRS1L敲低会上调血红素合成关键基因(ALAS1, FECH)的表达 (图5C),形成反馈循环。
结论3:FRRS1L 基因3’-UTR突变(尤其g.4852G>T)通过降低其mRNA稳定性或翻译效率,导致巨噬细胞中FRRS1L蛋白表达不足。FRRS1L功能缺陷阻碍了巨噬细胞对血红蛋白降解产物(铁血红素)的有效处理和还原,导致高铁血红素累积,引发全身性铁过载,并伴有轻度氧化应激和炎症损伤。高海拔低氧环境可能通过增加血红蛋白合成和血管通透性等因素,协同促进该色素发生和在全身多组织器官中的沉积。
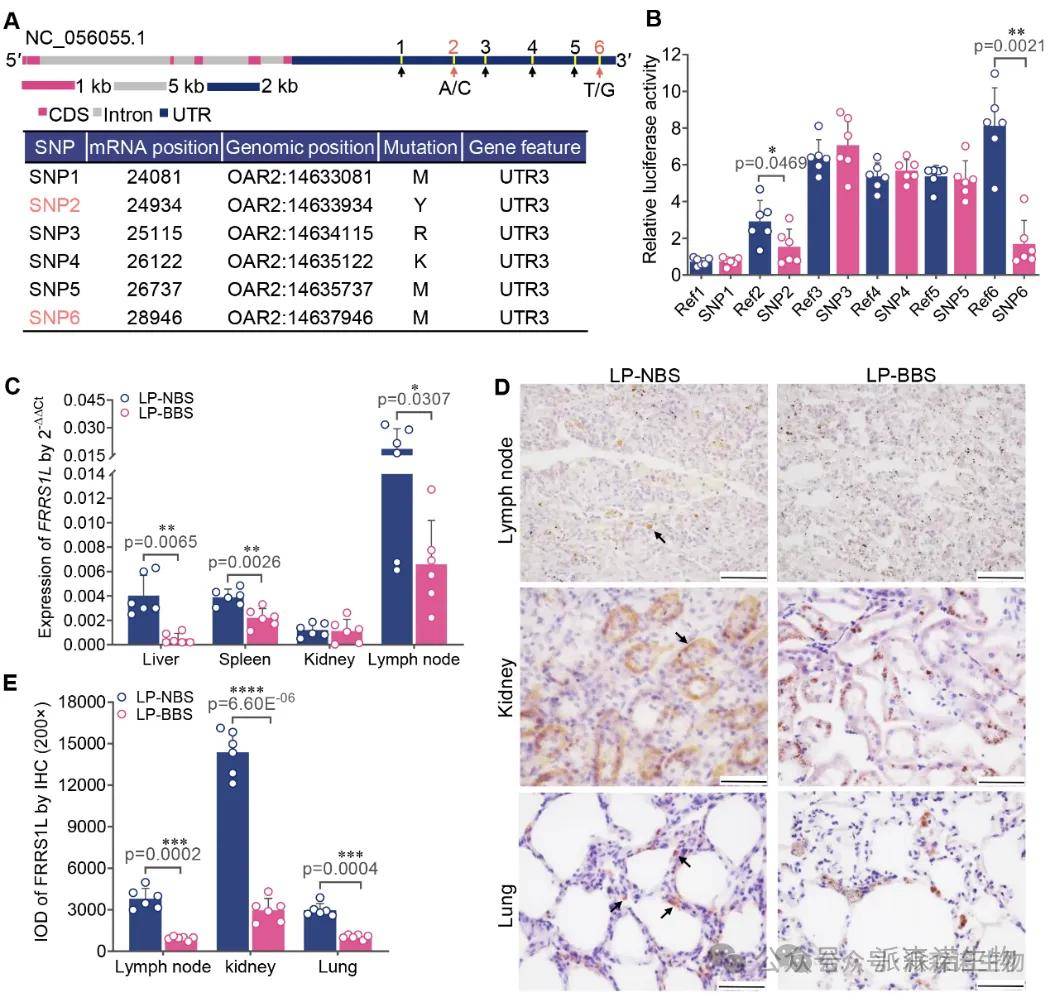
图4. FRRS1L在乌骨羊体内的表达
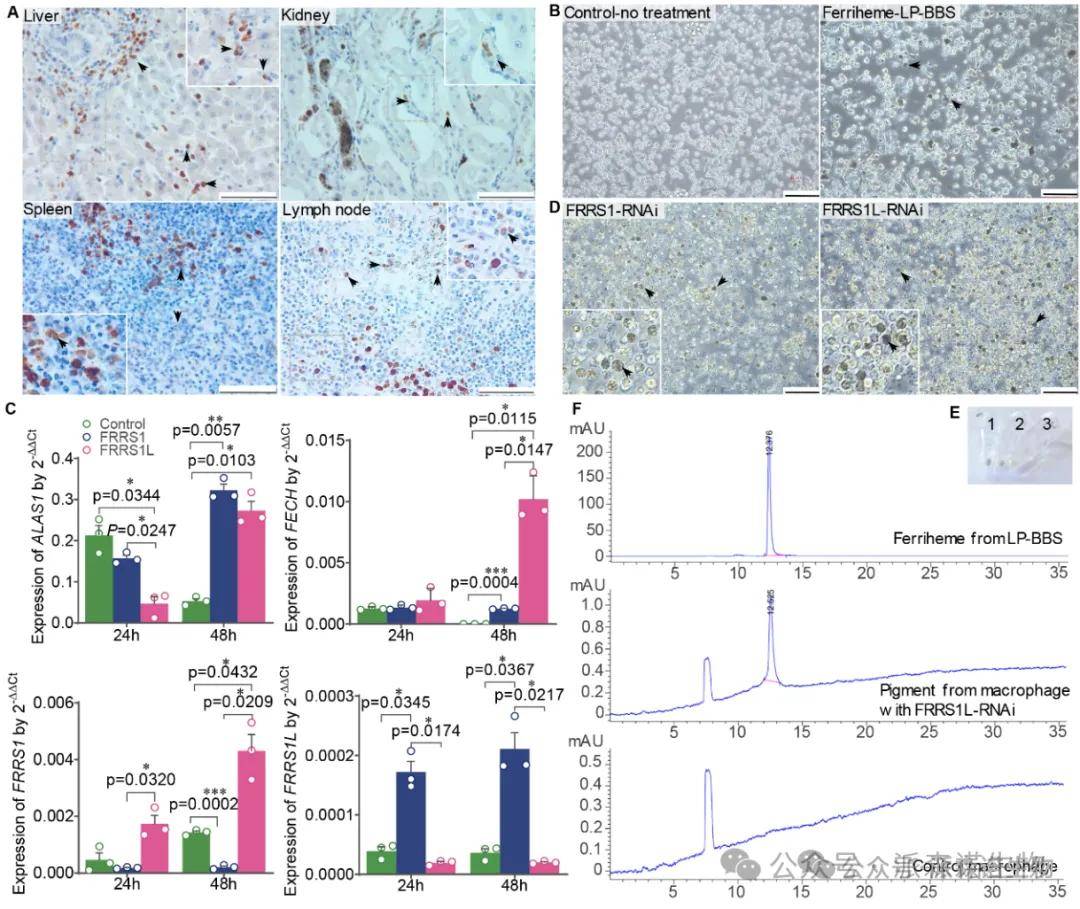
图5. FRRS1L表达与高铁血红素沉积的体外细胞验证
结论与展望
本研究首次系统揭示了乌骨羊全身性色素沉着的分子本质:FRRS1L基因3’-UTR关键突变导致其蛋白表达下调,引发血红蛋白中铁离子氧化还原异常和高铁血红素全身性过载,而非传统认为的黑色素沉积。这不仅解开了困扰多年的“乌骨”之谜,更取得了多项突破性科学发现:
1.鉴定基因新功能:首次将FRRS1L基因与系统性铁代谢调控联系起来,拓展了对铁稳态分子网络的认识,为研究人类铁过载相关表型(如非HFE型血色素沉着症)提供了全新视角和潜在治疗靶点。
2.建立宝贵动物模型:乌骨羊是世界上首个被鉴定的哺乳动物全身性高铁血红素过载自然模型,为研究铁代谢异常的病理生理机制、基因-环境(尤其是低氧)互作以及潜在干预策略提供了不可多得的活体研究平台。
3.阐明独特环境适应性:研究揭示了高海拔低氧环境在乌骨羊表型形成中的重要作用,为理解动物在极端环境下的适应性进化提供了范例。
展望未来,乌骨羊的研究与产业开发潜力巨大:
基础研究深化:
深入解析FRRS1L蛋白在巨噬细胞铁还原中的具体分子机制及信号通路。精确量化高海拔低氧环境参数(氧分压、时长)对FRRS1L表达及高铁血红素沉积的影响,建立基因-环境互作模型。利用该模型可筛选和验证缓解铁过载损伤的药物或功能性分子。
分子育种与资源保护:
基于鉴定的关键突变位点(g.4852G>T, g.1016C>A),开发高效准确的分子标记辅助选择(MAS)技术,用于乌骨羊的种质鉴定、品种选育和群体复壮,保障种群遗传纯度和特色性状稳定遗传。利用该技术建立科学的乌骨羊保种方法和核心育种群体,制定保种育种规划。
高附加值产业开发:
特色健康肉制品:乌骨羊肉天然富含生物可利用性高的天然铁成分(高铁血红素形式),是缺铁性贫血人群的理想食补来源。可开发“乌骨羊”地理标志认证的高端肉品品牌。功能性生物制品:探索从乌骨羊血液或组织中安全、高效提取纯化高铁血红素或相关活性物质(如具有特殊结合特性的铁载体),用于开发新型铁补充剂或生物材料。药食同源产品:结合传统认知与现代科学验证,研究乌骨羊产品(肉、骨汤等)在改善贫血、抗氧化等方面的功效,开发具有明确健康宣称的功能性食品。
助力乡村振兴:
乌骨羊作为云南横断山区的特色稀缺资源,其科学的保护和产业化开发,将成为当地畜牧业转型升级、农民增收致富的重要抓手,推动边疆民族地区经济发展。
团队与项目
主要作者:该研究由中国农业大学动物科学技术学院邓学梅教授领衔,联合云南农业大学邓卫东/毛华明/苟潇团队和美国宾夕法尼亚州立大学柳万生教授等共同完成。韩德平副教授(现就职于北京大学现代农业研究院)和张媛媛博士为共同第一作者,美国Pennsylvania State University的Wansheng Liu教授和中国农业大学的邓学梅教授为共同通讯作者。
资金支持:该研究得到了STI 2030-重大项目(20232D040750X)、国家自然科学基金联合基金(U1136605)、中国农业大学2115人才发展计划等项目的支持。
通讯作者简介:
邓学梅:中国农业大学动物科学技术学院教授,博士生导师。长期从事动物遗传资源与分子育种研究。主持国家自然科学基金、国家“863”项目,以及国家重大专项、国家重点研发课题等。在PLOS Genetics、Cell & Bioscience、BMC Evolutionary Biology等国际期刊发表论文60余篇。在畜禽遗传资源评价、保护与创新利用,特色地方品种(如绿壳蛋鸡、乌骨鸡、乌骨羊等)种质特性挖掘、重要性状的遗传机制解析及分子育种技术开发等方面做出了系统性和开创性的工作。
柳万生:美国宾夕法尼亚州立大学动物科学系终身教授,博士生导师。长期从事动物遗传,动物基因组,和雄性生殖方面的研究。他的研究课题主要由美国农业部(USDA),国家卫生研究院(NIH),以及宾州州政府和动物育种公司资助。在Nature, Nature Genetics, PNAS, Development, Cell & Bioscience和Reproduction等期刊发表论文90篇。在猪、牛和羊的基因组解析,X和Y性染色体遗传,精子发生和雄性生殖等方面做出了开创性工作。
结语
乌骨羊,这一隐匿于横断山脉深处的自然瑰宝,其“乌骨”之谜的破解,是基础科学研究与地方特色资源挖掘完美结合的典范。中国农业大学邓学梅团队及其合作者的工作,不仅揭示了FRRS1L基因在铁代谢中的全新角色,为人类疾病研究提供了珍贵模型,更照亮了乌骨羊这一珍稀遗传资源迈向科学保护、高效育种和高端大健康产业开发的广阔道路。从深山走向世界,从谜题变为宝藏,乌骨羊的故事,是科学赋予自然馈赠新生命的生动写照。未来,随着研究的深入和产业链的完善,这只承载着自然密码与科技力量的“铁血黑羊”,必将为人类健康与区域发展贡献独特价值。
原文链接:https://rdcu.be/ethQk