
2025-07-24
2024年9月,中南大学湘雅医院的研究团队在Theranostics(最新 IF: 13.3/Q1)上发表“MCT1-mediated endothelial cell lactate shuttle as a target for promoting axon regeneration after spinal cord injury”的研究论文。该研究通过整合能量代谢组学分析和实时乳酸动态监测技术,首次揭示内皮细胞特异性MCT1表达缺失引发的乳酸代谢轴功能紊乱是脊髓损伤后轴突再生障碍的关键病理机制。此外,通过AAV介导的MCT1基因治疗,证实其过表达可以显著促进轴突再生并改善运动功能恢复。这一效应可能与乳酸代谢轴的重建及神经元能量供应的改善有关。派森诺生物提供靶向能量代谢组学分析服务。

实验材料
原代皮层神经元,bEnd.3细胞,AAV-293细胞,CATH.a细胞,C57BL/6小鼠,胚胎小鼠
实验方法
靶向能量代谢组学分析;单细胞RNA生物信息学分析;乳酸传感器与共培养;基因治疗(AAV-MCT1)等
研究背景
脊髓损伤(SCI)是导致早逝和长期残疾的主要原因,其发病率和患病率在1990-2019年间显著上升。SCI的病理过程复杂,初始机械损伤会引发一系列继发性损伤,包括血管完整性破坏、血-脊髓屏障(BSCB)功能障碍、缺血/缺氧微环境形成等。这些变化导致损伤中心区持续代谢紊乱,但代谢异常如何影响神经组织重塑和功能恢复尚不明确。SCI后,损伤中心的血管痉挛和血栓形成导致长期缺氧缺血,引发细胞能量代谢危机。研究表明乳酸既是糖酵解终产物,也可作为神经元能量底物(通过"乳酸穿梭"机制)和信号分子。虽然星形胶质细胞-神经元乳酸穿梭已被广泛研究,但脊髓血管内皮细胞是否通过单羧酸转运蛋白1(MCT1)介导乳酸转运支持神经元代谢仍属未知。本研究的主要目的是探究MCT1在SCI后EC与神经元间乳酸转运中的作用,并验证通过靶向恢复MCT1表达能否改善代谢紊乱、促进轴突再生和功能恢复。
研究重点
本研究揭示了SCI后EC中MCT1表达下调导致乳酸代谢轴断裂的机制。研究发现,尽管损伤区乳酸水平升高,但EC中MCT1表达降低阻碍了乳酸向神经元的转运,导致神经元能量供应不足,进而抑制轴突再生。通过基于FRET的乳酸传感器证实,EC与神经元间存在直接接触依赖的乳酸转运,而MCT1抑制剂α-CHCA处理可显著抑制EC的血管生成能力和神经元轴突延伸。研究进一步通过AAV-MCT1靶向修复EC的MCT1表达,成功促进轴突再生并改善运动功能,为SCI治疗提供了代谢干预新策略。该发现突破了传统神经营养因子疗法的局限,突出了内皮-神经元代谢偶联在神经再生中的关键作用。
技术路线
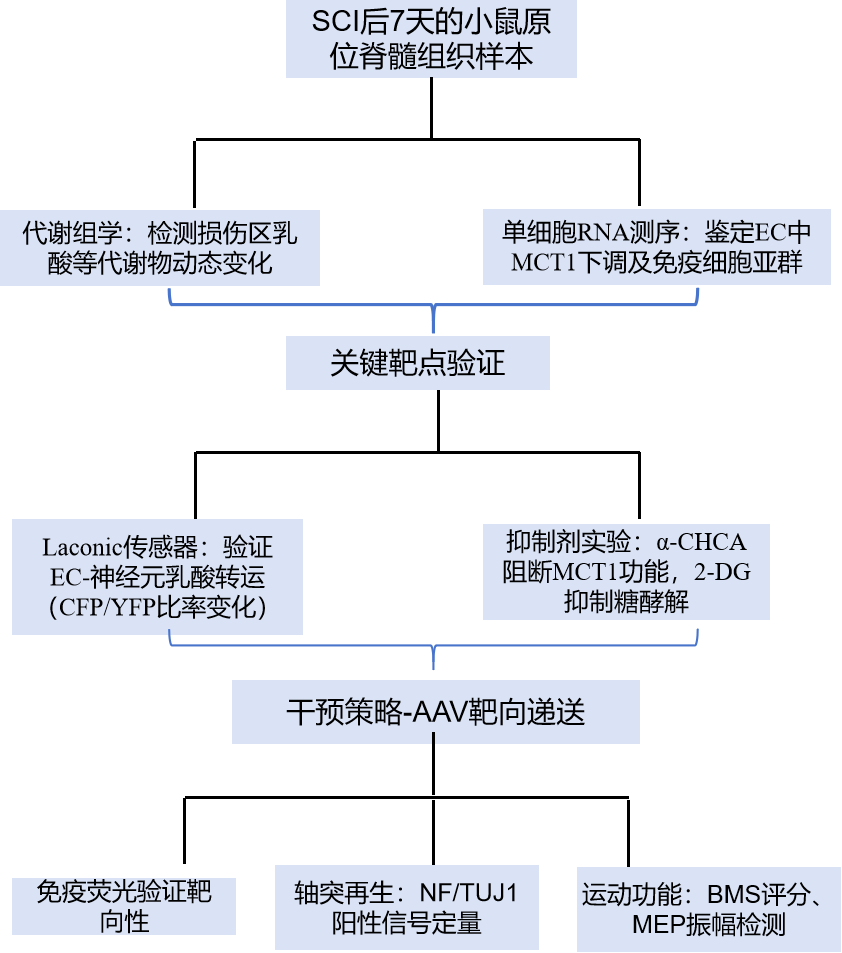
研究结果
1、脊髓损伤后增强的糖酵解代谢
锁定关键代谢分子:研究人员通过靶向能量代谢组学分析发现,SCI后7天的小鼠模型中,糖酵解代谢显著增强,表现为乳酸、D-葡萄糖-6-磷酸、β-D-果糖-6-磷酸等关键代谢物水平显著升高(图1A-B),且KEGG通路分析证实糖酵解途径的代谢物整体上调(图1C)。乳酸作为糖酵解核心产物被确定为SCI后的关键代谢分子,为后续研究提供了重要方向。
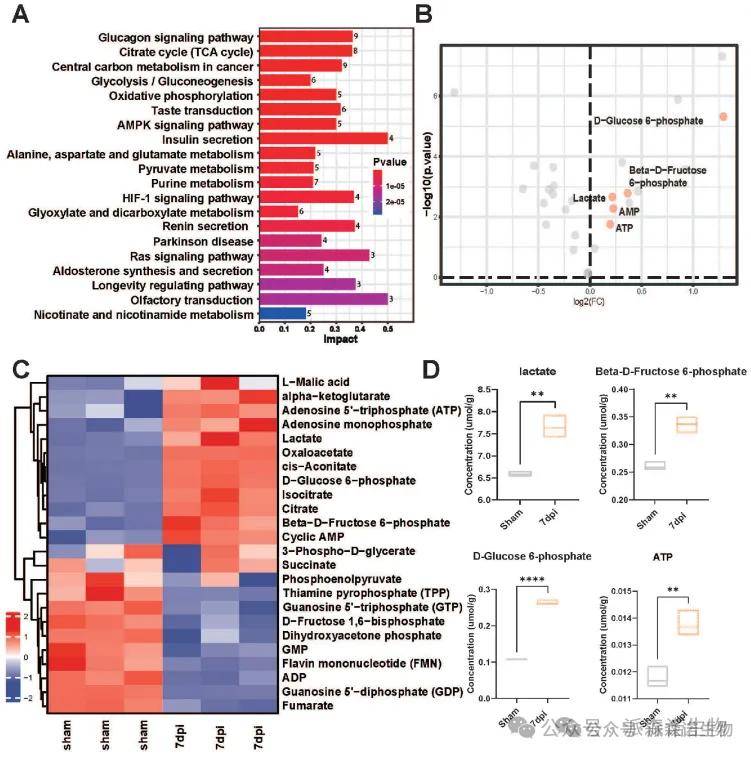
图1. 精准靶向代谢组学分析锁定脊髓损伤后受影响最大的功能性代谢物
2、内皮细胞来源的乳酸滋养神经细胞
作用机制探索:通过基于FRET的乳酸传感器(Laconic)证实,ECs与神经元间的直接接触依赖的乳酸转运机制。实验显示,乳酸浓度升高(10-100 mM)可剂量依赖性增加CFP/YFP荧光比值,而共培养体系中,仅与ECs直接接触的神经元或CATH.a细胞表现出荧光比值升高,延时成像进一步验证了乳酸通过细胞接触从ECs向神经元的动态转移。这一发现揭示了ECs来源的乳酸通过物理接触直接支持神经元能量代谢的生物学作用。
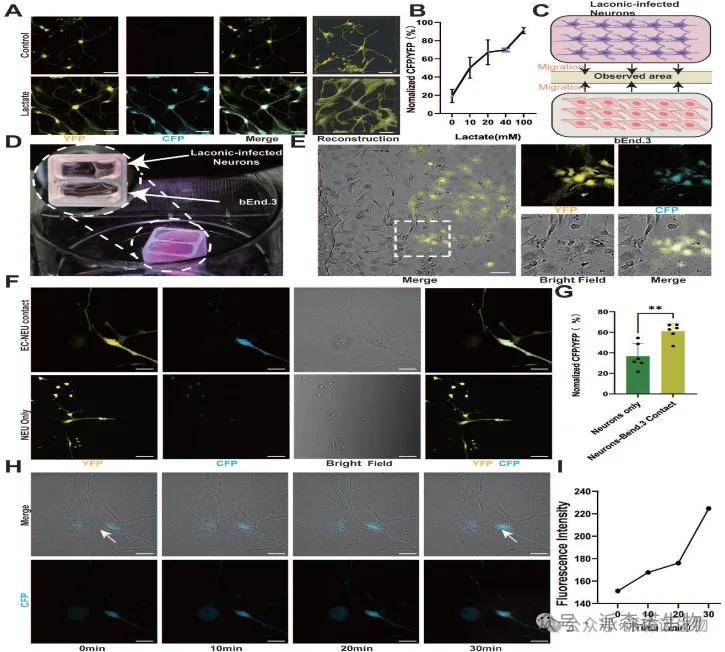
图2. 内皮细胞来源的乳酸滋养神经细胞
3、脊髓损伤后EC中MCT1的缺乏
作用机制探索:进一步研究发现,SCI后,尽管损伤中心区域乳酸水平升高,但新形成的血管内皮细胞中单羧酸转运蛋白1(MCT1/SLC16a1)表达显著降低,导致乳酸转运机制缺陷。单细胞数据分析及免疫荧光显示,MCT1在正常脊髓内皮细胞中高表达且与CD31共定位,但损伤后7-28天的新生血管中MCT1缺失,仅周围区域表达升高(部分与GFAP共染)。这表明SCI后内皮细胞功能受损,MCT1介导的乳酸-神经元穿梭中断,可能加剧代谢失衡。
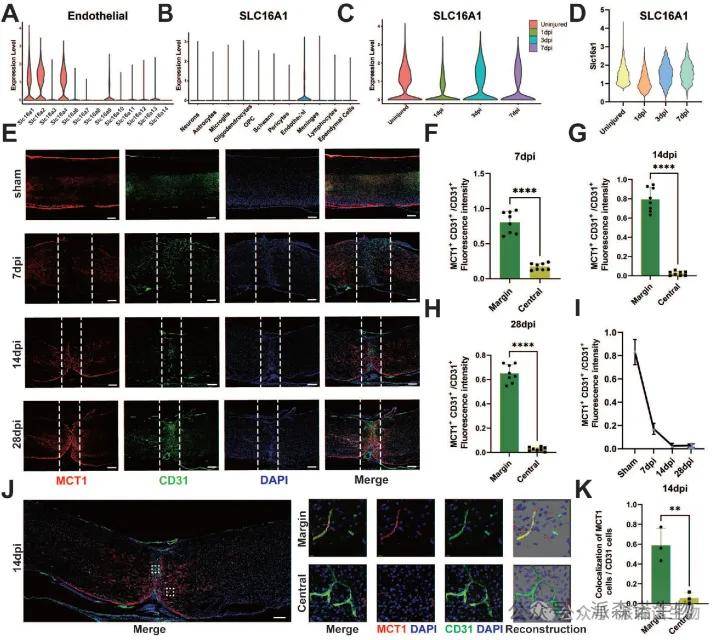
图3. SCI后MCT1的时空表达
4、内皮细胞中MCT1的缺乏会抑制血管生成和糖酵解
MCT1是调控ECs功能与代谢的关键蛋白:在体外实验中,MCT1抑制剂α-CHCA处理导致ECs的管状结构形成和迁移能力显著下降,且乳酸补充无法逆转这一现象,表明MCT1介导的乳酸转运对ECs的血管生成和糖酵解(HK1、PFKM、PKM1表达)至关重要。通过乳酸传感器(Laconic)证实,乳酸通过MCT1浓度依赖性进入ECs(20-40 mM乳酸促进功能,过高浓度则抑制),而α-CHCA阻断MCT1后,即使补充乳酸仍无法恢复CFP/YFP荧光比值及糖酵解活性,提示MCT1是ECs摄取乳酸的核心通道。这些结果揭示了MCT1通过调节乳酸转运平衡ECs能量代谢,进而影响其血管生成和修复能力。
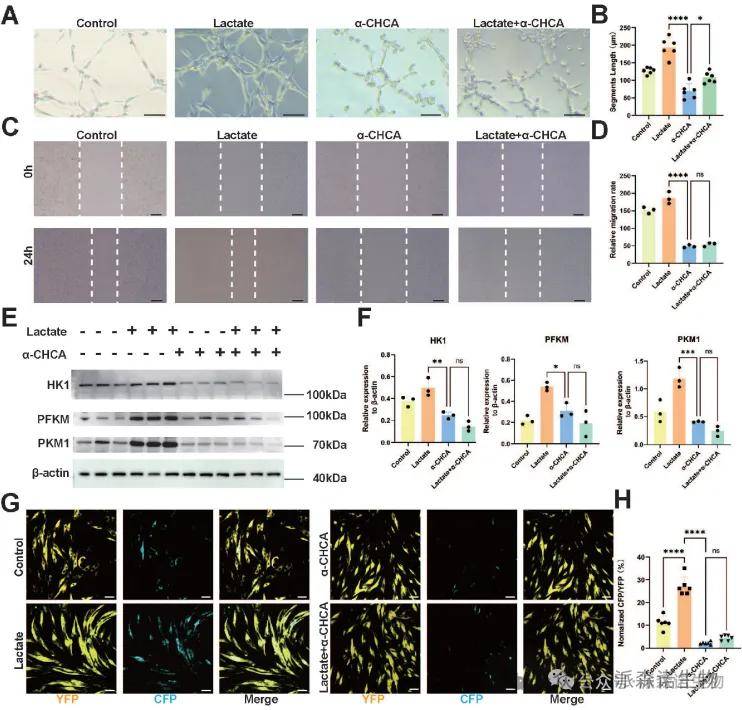
图4. 抑制ECs MCT1表达导致生物学和代谢功能下降
5、神经元利用乳酸来增加糖酵解并促进轴突再生
作用机制揭示:内皮细胞(bEnd.3)通过MCT1介导的乳酸穿梭直接增强神经元的糖酵解能力并促进轴突再生。共培养实验显示,乳酸处理使与bEnd.3接触的神经元CFP/YFP荧光比值升高(表明乳酸摄取增加),而MCT1抑制剂α-CHCA则抑制该效应。体外实验进一步证实,乳酸处理可促进神经突生长并逆转糖酵解抑制剂2-DG的抑制作用;在模拟脊髓损伤的轴突断裂模型中,乳酸处理的bEnd.3细胞通过直接接触显著增强神经元轴突再生能力,且该过程依赖MCT1功能。蛋白质印迹分析表明,乳酸通过提升糖酵解酶活性支持神经元能量代谢,从而驱动再生。
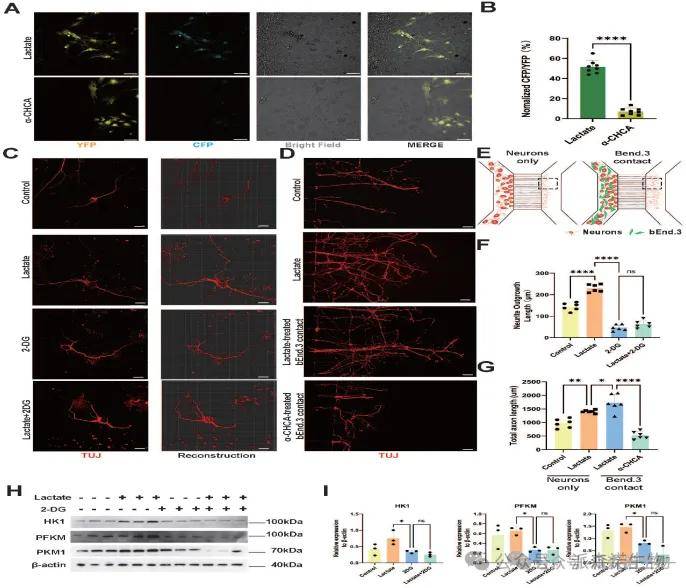
图5. 神经元利用乳酸增强糖酵解并促进轴突再生
6、在脊髓内皮细胞中过度表达MCT1可以挽救脊髓损伤小鼠受损的神经发生
功能验证:通过腺相关病毒(AAV-MCT1)靶向恢复脊髓ECs中MCT1的表达,可显著促进SCI小鼠的轴突再生和功能恢复。实验显示,AAV-MCT1在血管ECs中特异性表达(与巨噬细胞、胶质细胞无共定位),并增强损伤核心边缘的神经丝蛋白(NF)和β-Tubulin III(TUJ1)阳性轴突再生,证实MCT1介导的乳酸穿梭对修复SCI后神经功能具有关键作用。
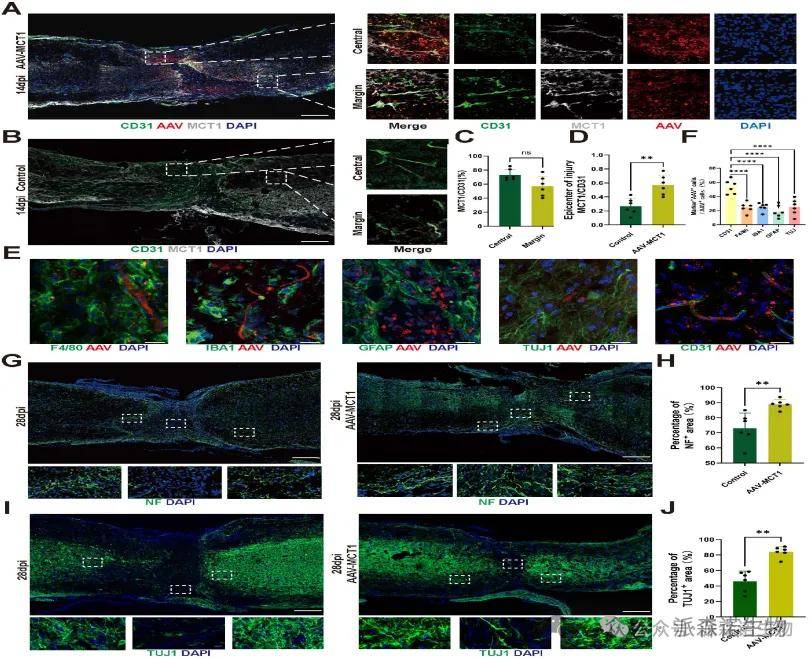
图6. 脊髓内皮细胞MCT1的过表达挽救了SCI小鼠受损的神经发生
研究结论
本研究本通过整合靶向代谢组学、单细胞RNA测序、基于FRET的乳酸传感器(Laconic)技术及AAV靶向递送系统,揭示了SCI后EC中MCT1介导的乳酸代谢轴断裂机制:SCI导致损伤区乳酸积累,但EC中MCT1表达下调阻碍了乳酸向神经元的转运,引发神经元能量危机并抑制轴突再生。通过AAV靶向恢复EC的MCT1表达,可促进乳酸穿梭、增强神经元糖酵解活性(HK1/PFKM/PKM1上调),进而驱动轴突再生(NF/TUJ1阳性信号增加)和运动功能恢复(BMS评分提升),为SCI治疗提供了代谢干预新策略。
原文链接:
https://www.thno.org/v14p5662.htm