2025-08-01
研究背景
微波消融(MWA)是一种微创的肿瘤治疗技术,它利用微波产生的热能来直接摧毁肿瘤组织。研究表明,微波消融可以激发全身免疫反应以控制转移或残留肿瘤,即远隔效应。然而,消融介导的远隔效应较弱,难以持续杀伤肿瘤。
既往研究发现,微波消融联合嵌合抗原受体(CAR)T细胞可以有效抑制远隔肿瘤,但是该联合疗法仅对靶抗原均质肿瘤有较好疗效,难以杀伤抗原异质性肿瘤。针对这一难题,广州医科大学附属第二医院广州朱康顺教授团队构建可分泌SIRPα(CV1)的sCAR-T细胞,验证了其在联合微波消融时可增强对远隔抗原异质性肿瘤的远隔效应,并揭秘其增强机制。派森诺生物为该研究提供了单细胞 RNA 测序(scRNA-seq)分析服务。
论文题目:CV1-secreting sCAR-T cells potentiate the abscopal effect of microwave ablation in heterogeneous tumors
影响因子:10.6
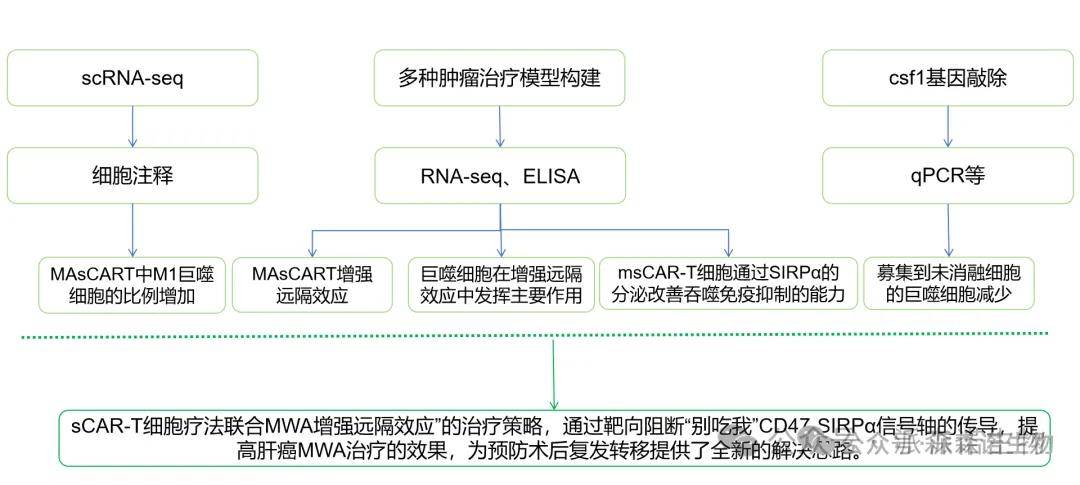
研究思路
研究结果
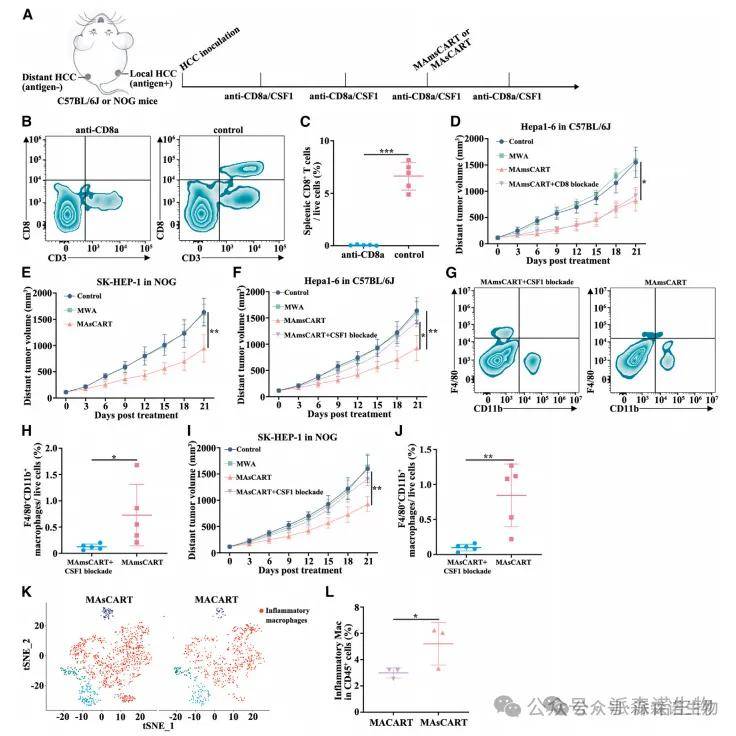
1、sCAR-T细胞能增强MWA的远隔效应,使控制远处抗原异质性肿瘤成为可能
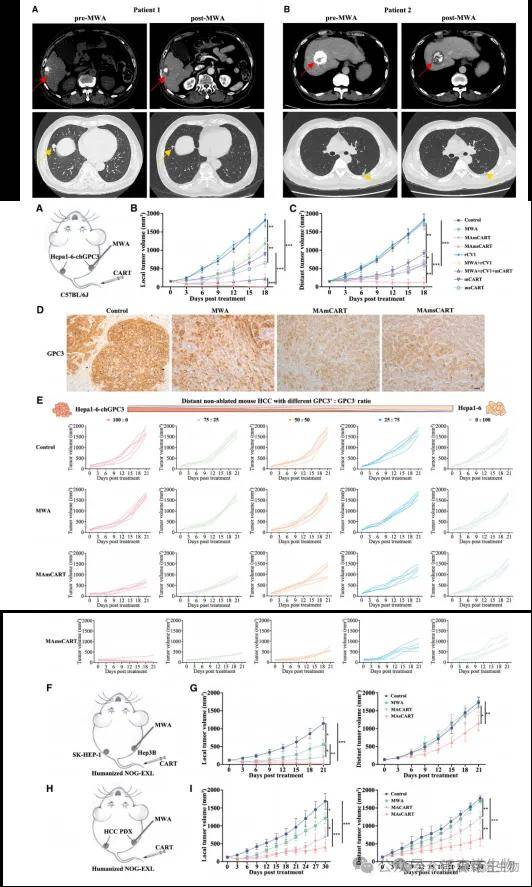
作者构建了多种肿瘤治疗方案小鼠模型,包括GPC3-msCART(可靶向chGPC3并分泌CV1)、GPC3-mCART靶向chGPC3等。与其它治疗方案相比,MAmsCART在消融肿瘤方面表现更优。MAmsCART治疗显著抑制了未消融肿瘤,而MACART治疗组仅获得中度的非消融性肿瘤抑制效果。这提示在采用MACART治疗时,除了sCAR-T细胞外,其他内源性免疫细胞在控制肿瘤方面也发挥着重要作用。
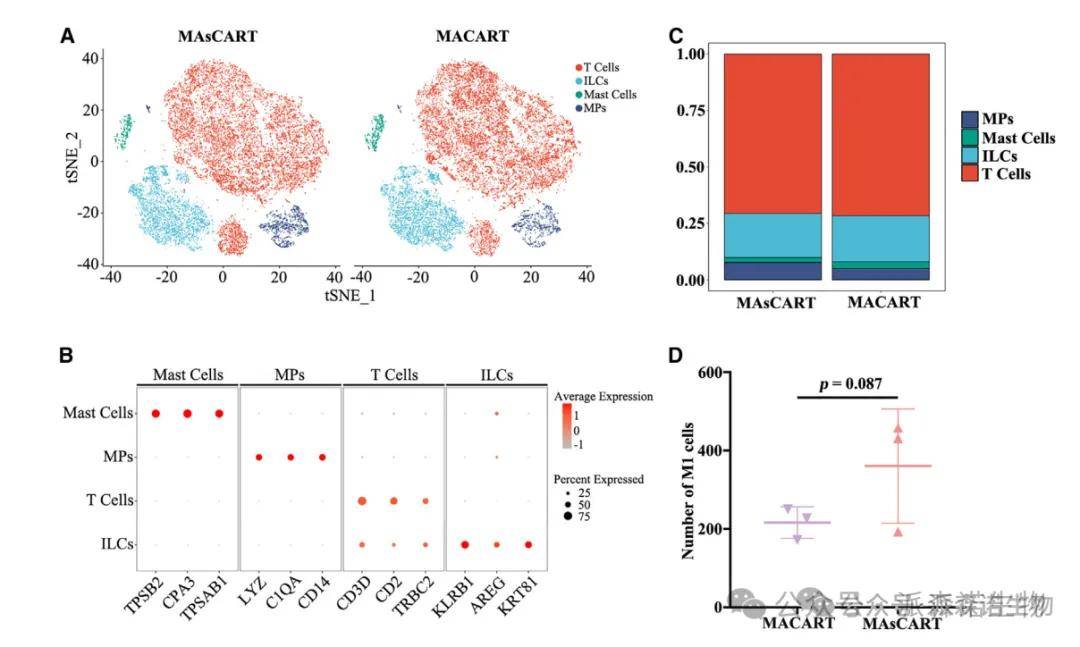
2、利用scRNA-seq技术在异质性肿瘤联合治疗中鉴定肿瘤浸润免疫细胞
对非消融PDX肿瘤中MACART和MAsCART肿瘤团块中的CD45免疫细胞进行了分选,使用单细胞RNA测序(scRNA-seq)分析。 scRNA-seq分析显示,两治疗组之间上述细胞的总数没有显著差异。然而,与MACART相比,MAsCART中M1巨噬细胞的比例有增加的趋势。这些观察结果提供了一个可能,即MWA和CAR-T细胞的抗肿瘤作用可能与巨噬细胞有关。
3、在MAsCART治疗后,巨噬细胞而非内源性T细胞在异质肿瘤中的远隔效应中起关键作用
接着作者发现CD8T细胞淋巴细胞耗竭并不能阻止MAmsCART治疗在具有异质性肿瘤的小鼠中刺激远处效应。并通过实验进一步验证了MAmsCART组中观察到的远处效应至少不是主要依赖于宿主T细胞对远处肿瘤的细胞毒性。与MACART组相比,MAmsCART组具有炎症特征的巨噬细胞(CD68、C1QA、CCL3、CCL4和CXCL2)数量增加。表达这些炎症标志物的巨噬细胞与更好的抗肿瘤特性有关,从而确保了与MAmsCART治疗相关的更好的远处效应。这些观察结果表明,MAmsCART治疗的远处效应是由巨噬细胞对具有抗原异质性的癌细胞的吞噬能力介导的。
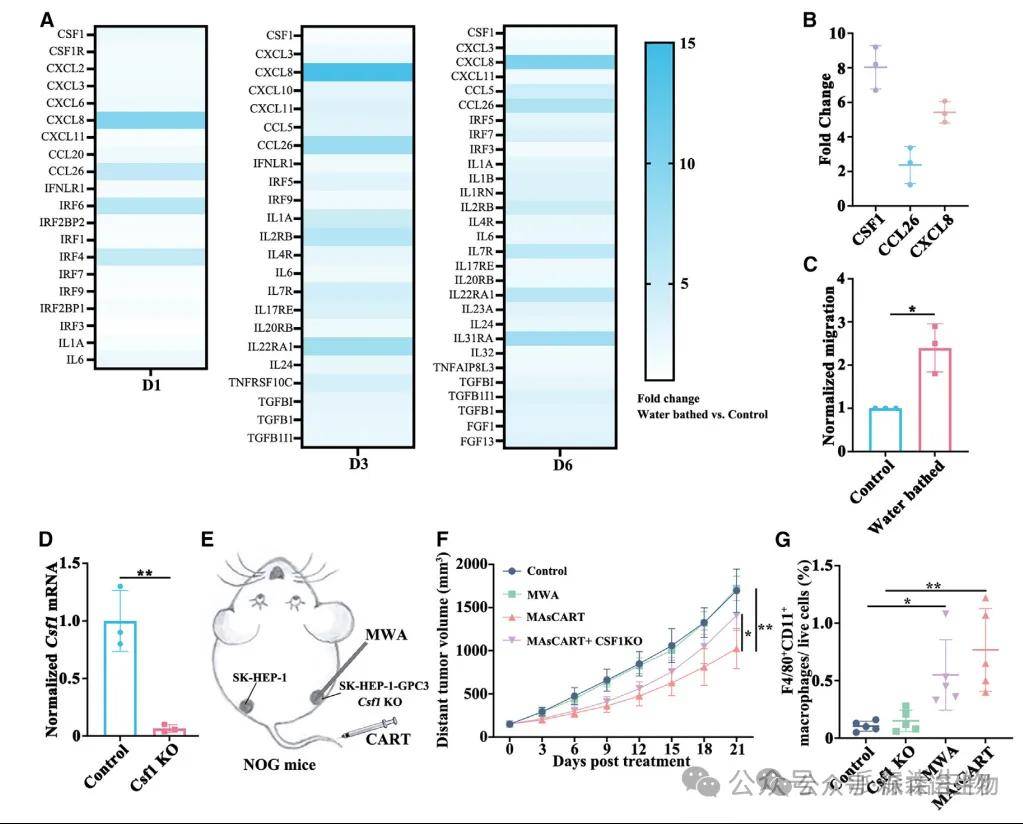
4、消融的肿瘤增强趋化因子的产生对于招募引发远端效应的巨噬细胞至关重要
相对于对照组,在单独MWA治疗或MWA联合治疗中均观察到未消融肿瘤中巨噬细胞的浸润增加。对水浴SK-HEP-1-GPC3细胞的bulk RNA-seq、ELISA数据进行分析后发现,可招募巨噬细胞的几种趋化因子升高,包括CSF1、CCL26、CXCL8等。鉴于已有研究表明癌细胞分泌的CSF1能招募巨噬细胞到肿瘤中,作者进一步调查了CSF1是否与远隔效应有关。研究发现,当消融细胞进行Csf1基因敲除时,募集到未消融位点的巨噬细胞数量减少。这些数据表明,HCC细胞在消融肿瘤部位分泌CSF1有助于巨噬细胞迁移至未消融肿瘤部位,从而诱导远隔效应。
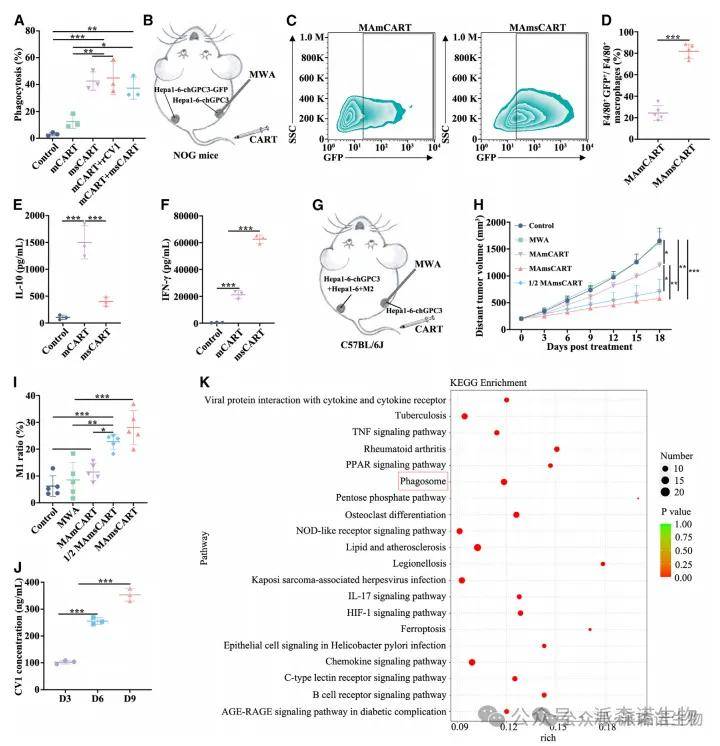
5、sCAR-T细胞分泌CV1克服M2巨噬细胞免疫抑制,在异质肿瘤的消融效应中发挥关键作用
MAsCART在未消融肿瘤中诱导的远隔效应优于MACART,这引发了这样一个问题:CD47-SIRPa轴的阻断剂CV1是否通过增强巨噬细胞的吞噬作用以驱动远隔效应?相比之下,含有GPC3-msCART上清液的共培养物中干扰素(IFN)-g的分泌量明显更高。这表明,GPC3-msCART细胞可以逆转M2巨噬细胞的功能性免疫抑制,促进免疫激活和肿瘤裂解。这些数据支持这样的假设,即肿瘤中局部msCAR-T细胞增殖和激活后,肿瘤内可能会出现更高的CV1浓度。KEGG分析显示,MAsCART组中吞噬体基因相对于MACART组富集。更重要的是,这种体外效应并没有伴随着外周血红细胞和免疫细胞或血清生化物质的明显变化。这些数据证明了msCAR-T细胞改善吞噬免疫抑制的能力,很可能是通过CV1的分泌来实现的。
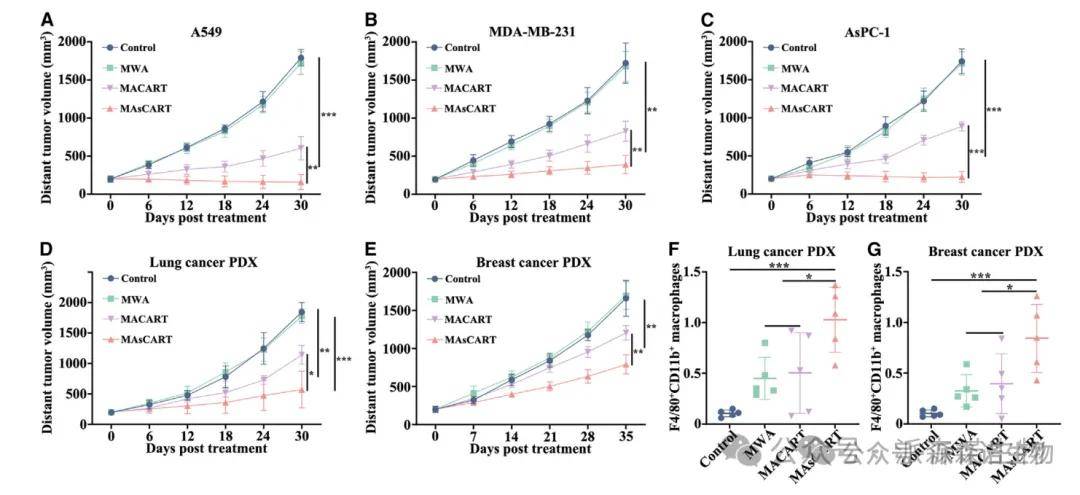
6、MAsCART诱导的体外效应也适用于其他异质实体瘤
MWA不仅常用于HCC患者,还用于肺癌、胰腺癌和乳腺癌患者以及其他10种实体肿瘤患者。作者在NOG小鼠的几种异种移植模型中观察到了巨噬细胞依赖的远隔效应。此外,为了密切模拟临床患者中实体肿瘤的异质性,作者建立了肺癌和乳腺癌的患者源性异种移植PDX模型。在这些PDX模型中观察到了远隔效应,以及巨噬细胞向未消融肿瘤部位的募集,这表明消融诱导的远位反应可能不仅限于HCC,也可能存在于需要MWA治疗的其他原发性或转移性肿瘤中。这些结果突出了MWA联合CAR-T治疗方案的临床转化价值。
小 结
该研究创新性聚焦于未接受消融治疗的远端肿瘤免疫微环境,首次提出 “sCAR-T 细胞疗法与 MWA 联合应用以强化远隔效应” 的治疗方案。该策略通过特异性阻断 “别吃我” 信号通路中 CD47 与 SIRPα 的相互作用,形成对肝癌 “精准靶向攻击 + 全域协同清除” 的多层次治疗体系,为提升肝癌 MWA 治疗效果、降低术后复发转移风险开辟了新的解决路径。


