
2025-09-12

四溴双酚 A(Tetrabromobisphenol A,TBBPA)是一种应用广泛的溴化阻燃剂,已有研究表明其具有神经毒性,且存在诱发肥胖的风险。然而,其潜在作用机制尚未完全明确,尤其是在饮食诱导的易感性方面。近期,中国科学院水生生物研究所博士研究生任欣欣在环境领域顶级期刊Environmental Science & Technology上发表题为“Tetrabromobisphenol A Induces Neurotoxicity in Adult Zebrafish: Insights from the Gut Microbiota-Bile Acid-Brain Axis”的研究论文,首次阐明了饮食依赖性的 “肠道菌群-胆汁酸-脑轴” 是 TBBPA 诱导神经毒性的关键介导通路,同时强调了胆汁酸代谢及饮食因素在维持神经生理稳态中的重要性。揭示了溴系阻燃剂神经毒性的一种新机制,为其他环境污染物的环境健康风险评估提供了新的思路。
本研究中的微生物组学、转录组学及代谢组学和部分分析工作由上海派森诺生物科技股份有限公司完成。
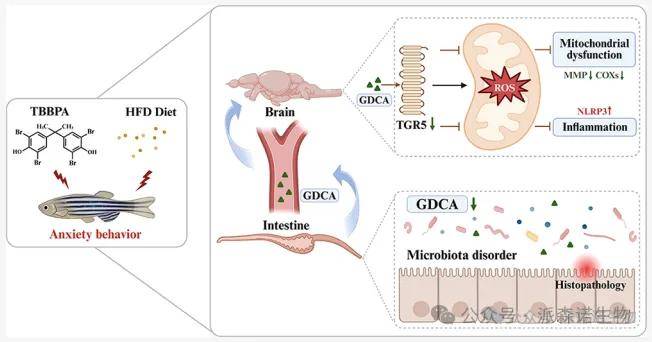
图1 整体流程图
实验设计
1.动物实验:
以成年雄性斑马鱼为研究对象,设置正常饮食(ND)和高脂饮食(HFD)两种饮食条件。将斑马鱼分为多组,分别进行不同浓度(0 nM、10 nM、100 nM)四溴双酚 A(TBBPA)暴露处理,同时设置含 0.01% DMSO 的溶剂对照组,每日更新暴露液,持续暴露 4 周。
2.多组学分析:
1)对斑马鱼肠道组织进行16S rRNA测序分析肠道菌群组成、多样性等;
2)转录组:对斑马鱼脑部进行转录组测序,分析差异表达基因及富集通路;
3)胆汁酸代谢组:对斑马鱼肠道和血浆样本进行靶向胆汁酸代谢组分析,检测甘氨脱氧胆酸(GDCA)等胆汁酸水平。
3.功能验证:
1)抗生素处理实验:设置斑马鱼组,喂食含万古霉素,甲硝唑,新霉素硫酸盐的混合抗生素饲料,验证肠道菌群对GDCA的调控作用。
2)GDCA补充实验:设置多组斑马鱼,在饲料中添加GDCA,观察其对TBBPA诱导的行为异常,线粒体功能障碍,神经炎症等的逆转效果。
4.生理指标检测:
1)采集肠道、脑、血浆等样本,进行脑 Nissl 染色(统计神经元尼氏小体数量)、肠道 HE 染色(统计绒毛长度等)。
2)检测血浆 GDCA 水平、肠道二胺氧化酶活性、脑线粒体呼吸链复合物活性、炎症因子含量等。
3)通过旷场试验检测斑马鱼接触性时长,中央区域停留时间,通过群游试验检测最近邻距离(NND),个体间距离(IID),评估焦虑样行为
研究成果
旷场试验和群游试验表明,100 nM TBBPA 暴露会显著增加斑马鱼趋触性、减少中央区域停留时间并降低最近邻距离(NND)与个体间距离(IID);高脂饮食(HFD)会加重 TBBPA 诱导,HFD 条件下 10 nM 和 100 nM TBBPA 暴露均会使斑马鱼趋触性进一步增强,中央区域停留时间、NND 及 IID 降低幅度更大,这种 “饮食-毒物” 相互作用提示代谢应激状态下生物对 TBBPA 神经毒性的敏感性升高;同时,组织病理学分析显示,TBBPA 暴露会显著减少神经元尼氏体数量、缩短肠道绒毛长度(VL)、减薄肌层厚度(TMT)并降低隐窝深度(CD),表明其既破坏神经元完整性,也损伤肠道物理屏障(图2)。
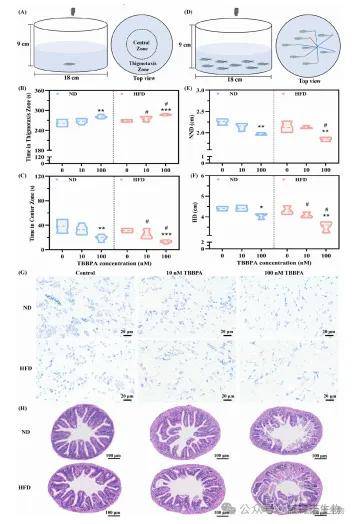
图2 四溴双酚 A(TBBPA)诱导成年雄性斑马鱼产生神经毒性和肠道损伤
KEGG 分析显示,TBBPA会改变氧化磷酸化、糖酵解 / 糖异生、NOD 样受体及 Toll 样受体信号通路,具体而言,线粒体氧化磷酸化、线粒体膜电位、线粒体分裂相关基因转录水平降低,而 Toll 样受体、NOD 样受体信号通路相关基因转录水平升高(图3)。
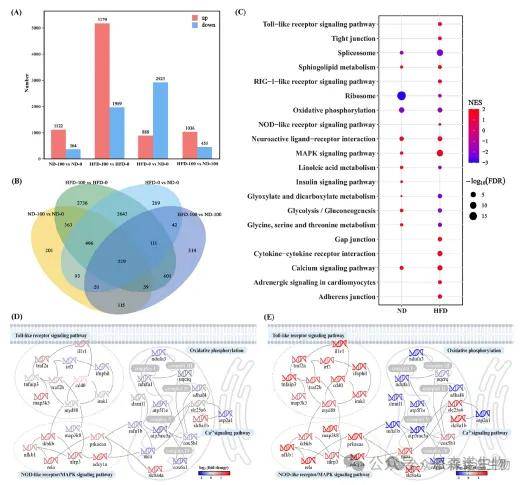
图3 脑部转录组分析
结果表明,TBBPA 显著改变了肠道菌群的α多样性指数和β多样性,这表明肠道菌群的丰富度与多样性受损,TBBPA 会显著重塑肠道菌群结构,促使促炎菌与胆汁酸转化相关菌的增加。这种肠道菌群失调可能会引发肠道炎症与胆汁酸代谢紊乱,从而为 TBBPA 暴露、肠道屏障功能障碍及通过肠-脑轴介导的下游神经毒性效应之间,提供了潜在的机制关联(图4)。
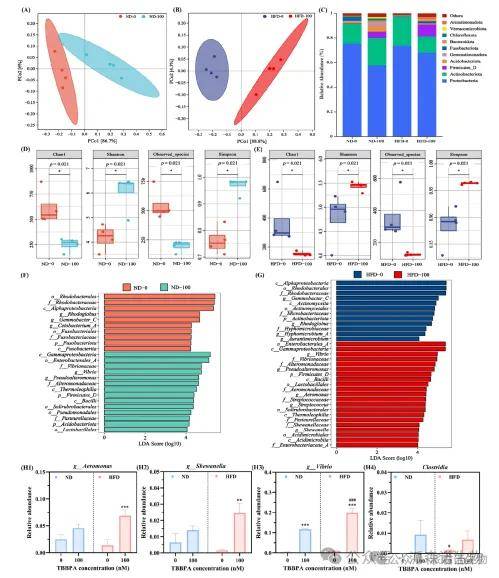
图4 16S rRNA分析
胆汁酸定量分析显示,在ND和HFD条件下,100 nM TBBPA会改变胆汁酸。肠道菌群与胆汁酸之间存在双向相互作用,肠道微生物催化初级胆汁酸向次级胆汁酸的生物转化,而胆汁酸反过来又会调节微生物的组成和功能,以维持肠道稳态。相关性网络分析进一步表明,GDCA是两种饮食条件下均受 TBBPA 影响的关键胆汁酸。在高脂饮食喂养条件下,TBBPA 导致 GDCA 的降低更为显著(图5)。
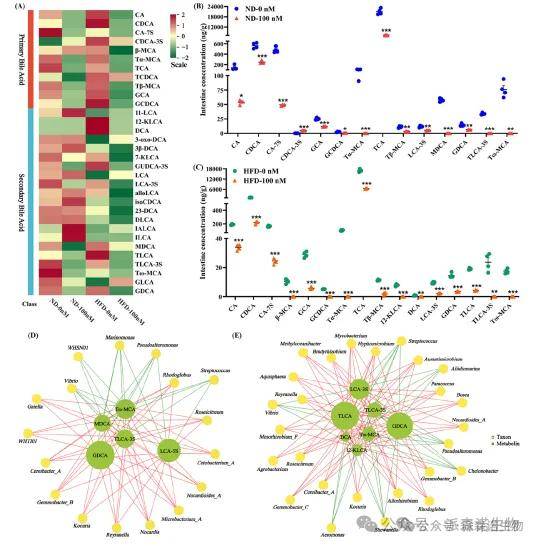
图5 肠道胆汁酸靶向代谢组学分析
通过研究在ND和HFD下均补充GDCA的效果,结果显示,补充 GDCA 逆转了 TBBPA 诱导的焦虑样行为,还挽救了TBBPA 导致的尼氏体减少及肠道 VL、TMT、CD、DAO 活性降低,证实胆汁酸代谢介导肠-脑轴功能。与以往研究一致:补充胆汁酸对多种毒物诱导模型有神经保护作用,且与肠道健康相关。进一步证实了TBBPA 暴露后 GDCA 是关键胆汁酸介导因子(图6)。
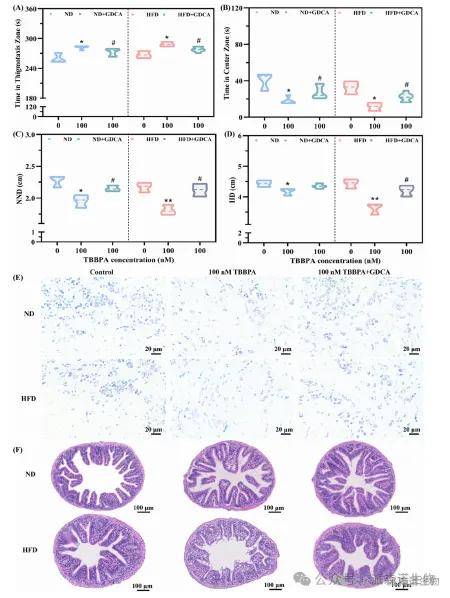
图6 补充GDCA可逆转TBBPA诱导的行为异常和肠道病理改变
结果表明,补充 GDCA可挽救上述异常、逆转 tgr5 抑制,同时激活大脑膜结合受体 TGR5,缓解TBBPA诱导的线粒体酶活性异常、氧化应激及炎症因子变化,改善线粒体功能、抑制神经炎症。GDCA 对线粒体的保护可解释其对斑马鱼焦虑行为的改善(图7)。
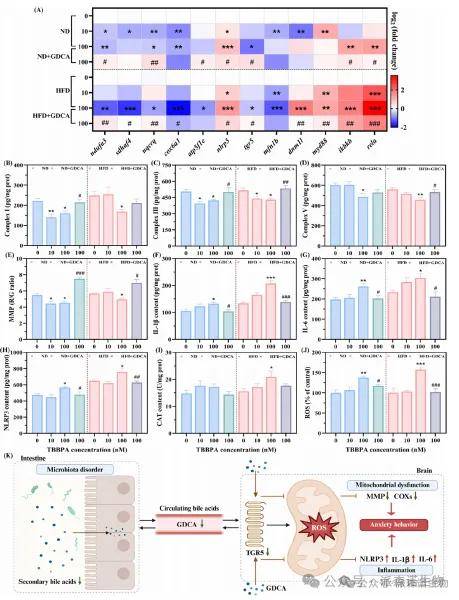
图7 GDCA补充能够挽救由TBPA诱导的神经毒性
研究结论
本文通过研究四溴双酚A(TBBPA)对成年斑马鱼的神经毒性效应及甘氨脱氧胆酸(GDCA)的干预机制,开展了行为学分析、组织病理学观察、转录组测序、16S rRNA 测序及靶向代谢组学检测等一系列实验,发现 TBBPA 会诱导斑马鱼焦虑样行为、神经元损伤及肠道屏障破坏,且 HFD 会加剧这些效应,其核心机制是 TBBPA 扰乱肠道菌群-胆汁酸轴,导致关键次级胆汁酸 GDCA 减少,进而介导线粒体功能障碍与神经炎症,而补充 GDCA 可逆转上述神经毒性。该研究首次揭示饮食依赖性肠道菌群-胆汁酸-脑轴在 TBBPA 神经毒性中的作用,为溴系阻燃剂环境健康风险评估与干预提供依据。
原文引用
Ren X, Xu Z, Guo Y, Zhang T, Li B, Men J, Han J, Yang L, Zhou Y, Zhou B. Tetrabromobisphenol A Induces Neurotoxicity in Adult Zebrafish: Insights from the Gut Microbiota-Bile Acid-Brain Axis. Environ Sci Technol. 2025 Aug 26;59(33):17443-17456. doi: 10.1021/acs.est.5c06926. Epub 2025 Aug 12. PMID: 40795259.
原文链接
DOI: https://doi.org/10.1021/acs.est.5c06926