
2025-11-28
多组学联合,就是将不同层面的生物学研究方法结合起来,如基因组学、转录组学、蛋白质组学、代谢组学等。每一种组学就像是一块拼图碎片,单独存在时只能展现生命画卷的局部,而当它们联合起来,便能够拼凑出一幅完整且详尽的生命全景图。下面,通过分享两篇派森诺项目研究文献,来具体分析一下多组学联用如何为研究增加亮点~
项目文章一


中文题目:颌骨来源的细胞外囊泡通过靶向KDM2B来调控牙胚间充质细胞的增殖与分化
发表期刊:International Journal of Oral Science
影响因子:12.2
作者单位:西安交通大学口腔医院
分析内容:smallRNA、蛋白质组、qRT-PCR等;
本研究中SmallRNA检测及部分数据分析工作均由上海派森诺生物科技股份有限公司完成。
研究背景
牙齿缺失日益成为一个全球性问题,不仅给个体带来显著的心理和生理困扰,更造成巨大的社会经济负担。相较于缺乏生物学功能的传统修复治疗,牙齿再生通过实现缺失牙齿的生物生理性再生展现出独特优势,正成为新兴趋势。通过模拟体内天然牙齿形成过程,细胞-组织重组技术为构建功能性牙齿替代物提供了前景广阔的新途径。然而,尽管进行了多种再生尝试,但牙齿从头再生仍与天然牙齿发育过程存在显著差异。
主要结果
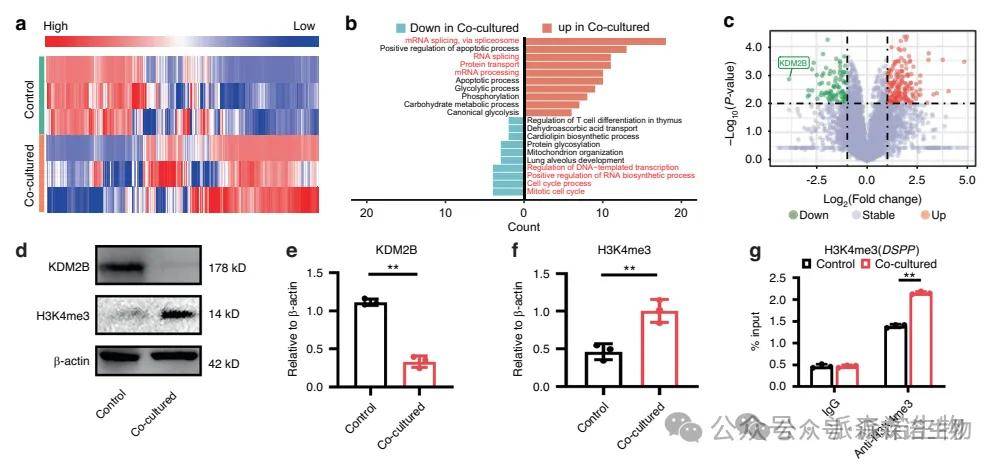
下颌骨EVs处理后牙胚的蛋白组学分析
蛋白质组学结果显示,Mandible-EVs共培养显著上调分化相关蛋白、下调增殖相关蛋白。其中KDM2B(组蛋白去甲基化酶)的表达下调最为显著,提示其可能是Mandible-EVs调控牙齿发育的重要靶点。
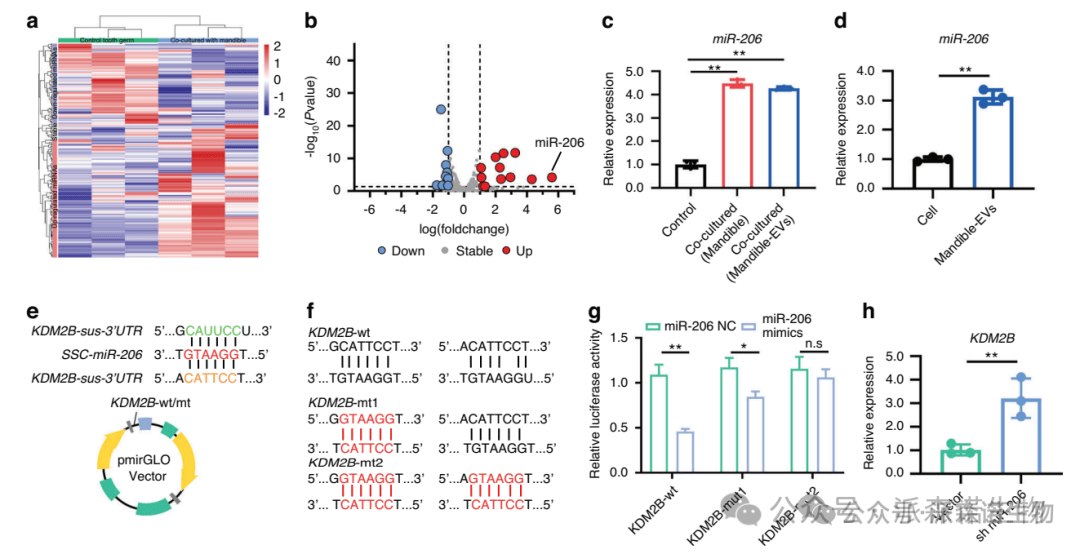
下颌骨EVs处理后牙胚的smallRNA分析
进一步RNA测序分析显示Mandible-EVs中的miR-206能够靶向抑制KDM2B,进而调控牙胚间充质细胞的增殖与分化。在机制明确的基础上,研究团队进一步通过慢病毒转染技术在体内操控miR-206/KDM2B的表达,以验证该调控轴在牙齿早期发育过程中的功能作用。发现KDM2B过表达影响了牙齿的形态发生和矿化,尤其是牙尖的形成,而miR-206/KDM2B处理组的前磨牙发育良好。
研究结论
该研究利用小型猪模型通过体内外实验首次揭示了Mandible-EVs通过miR-206/KDM2B通路调控牙齿早期发育的表观遗传机制。这些发现不仅阐明了颌骨在牙齿形成中的调控作用,为预防和治疗牙齿发育异常提供新思路,更为牙齿再生技术创新策略的开发奠定理论基础。
项目文章二


中文题目:后肠微生物组稳态破坏通过抑制乙酸介导的肝脏AMPK-PPARA轴促进反刍动物产后能量代谢紊乱
发表期刊:Microbiome
影响因子:12.7
作者单位:中国农业大学动物科技学院
分析内容:转录组、宏基因组、非靶代谢组、短链脂肪酸靶向代谢组、qRT-PCR等;
本研究中代谢组检测及部分数据分析工作均由上海派森诺生物科技股份有限公司完成。
研究背景
产后能量代谢障碍对乳用反刍动物的健康与生产性能构成重大挑战,但其发病机制尚未明确。肠道菌群通过"肠-肝轴"调控宿主代谢过程的关键作用日益受到重视,然而其在乳用反刍动物能量代谢障碍中的具体机制仍不清楚。本研究以奶牛为模型,采用大规模病例-对照分析方法,基于"肠-肝轴"视角系统探究产后能量代谢障碍的病理生理学基础。
主要结果
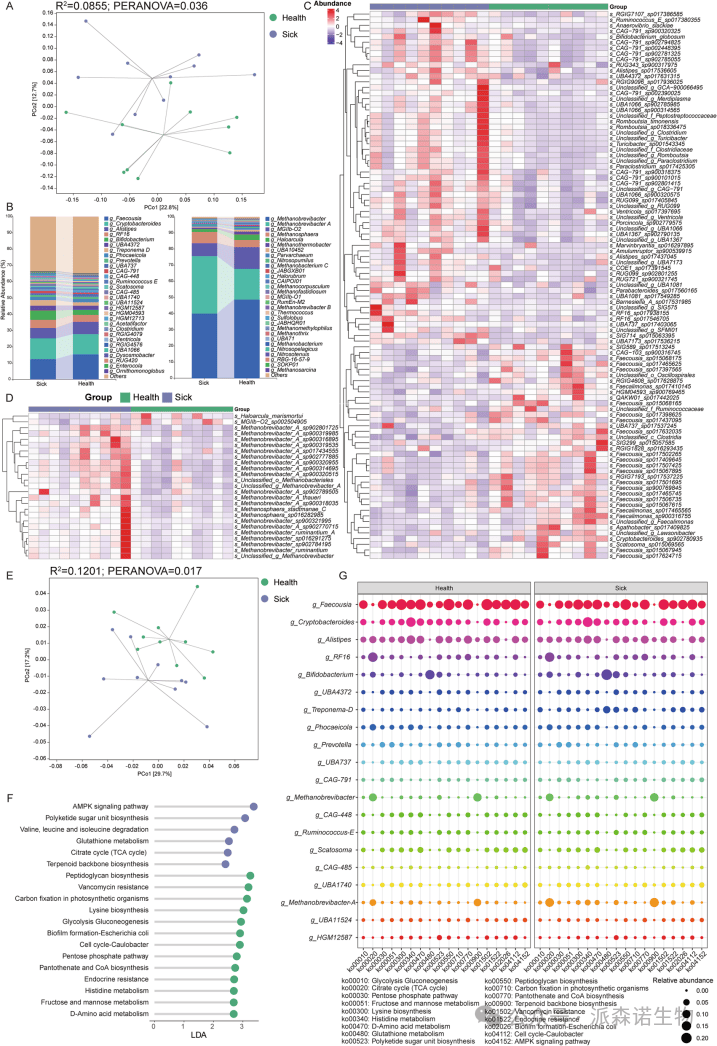
健康奶牛和酮病奶牛后肠微生物群的宏基因组学分析
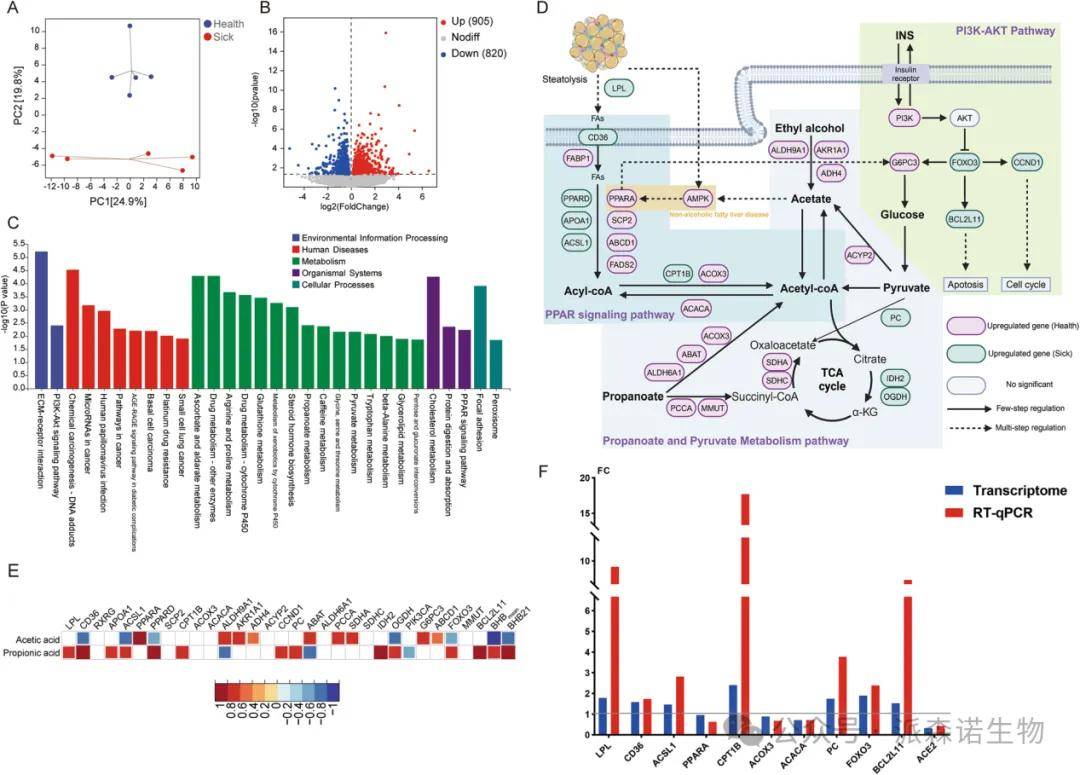
对产后21天后肠微生物群进行的宏基因组学分析结果,与16S rRNA基因测序结果表现出高度一致性。这不仅体现在两组间显著的β-多样性差异和香农指数的一致趋势上(图3A和图S1a),也体现在微生物群组成上(图3B)。在菌属水平,宏基因组结果同样揭示了两组在 Faecousia、Alistipes和 双歧杆菌属等菌属上的差异。值得注意的是,健康组与患病组在古菌组成上存在显著差异(图S1b)。在丰度前五的古菌中,健康组的甲烷短杆菌属、MGIIb-O2和盐盒菌属丰度较高,而患病组中甲烷短杆菌A和甲烷球形菌属的丰度最高。此外,差异物种分析显示,某些Faecousia菌种在健康组中更为丰富,而Romboutsia、甲烷短杆菌A和甲烷球形菌属的菌株在患病组中更为丰富(图3C和D)。在功能水平上,也发现两组在β-多样性方面存在明显分离(图3E)。Lefse分析表明,健康组中微生物代谢通路如赖氨酸生物合成、糖酵解/糖异生、磷酸戊糖途径、组氨酸代谢以及果糖和甘露糖代谢等上调;而患病组中AMPK信号通路、谷胱甘肽代谢以及柠檬酸循环/TCA循环等通路上调(图3F)。通过比较丰度前20的菌属对这些差异功能的贡献,确定Faecousia是健康组中上调通路的关键贡献者,而甲烷短杆菌A和双歧杆菌属是患病组中上调通路的关键贡献者(图3G)。
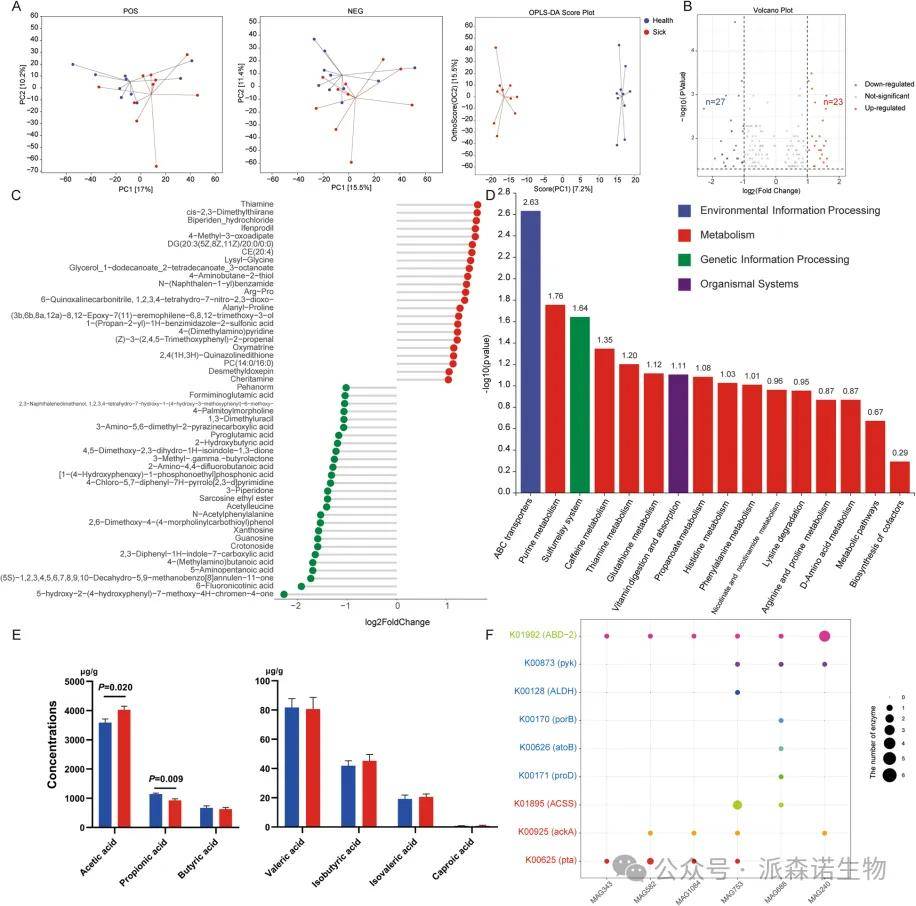
健康奶牛与酮病奶牛后肠的非靶向代谢组学与短链脂肪酸分析
非靶向代谢组学分析显示,在正、负离子模式下,患病组与健康组的粪便代谢谱均存在显著分离。患病组中有23种代谢物显著上调,27种代谢物显著下调(图5B)。具体而言,硫胺素、4-甲基-3-氧代己二酸、二酰甘油(DG(20:3(5Z,8Z,11Z)/20:0/0:0))及胆固醇酯(CE(20:4))等代谢物在患病组中显著上调;而亚胺甲基谷氨酸、1,3-二甲基尿嘧啶、焦谷氨酸和2-羟基丁酸等代谢物则在健康组中显著上调(图5C)。KEGG富集分析表明,涉及谷胱甘肽、组氨酸和赖氨酸代谢的通路显著富集(图5D),这揭示了宏基因组学与代谢组学数据间的强相关性,并提示这些差异代谢物受微生物驱动调控。在靶向短链脂肪酸分析中,健康组的乙酸水平显著较高,而患病组的丙酸水平显著较高(图5E)。进一步分析发现,MAG343、MAG582、MAG1084和MAG753含有与乙酸合成及代谢相关的关键酶,但缺乏丙酸代谢的关键酶;反之,MAG688和MAG240则不含有如pta等关键的乙酸合成酶(图5F)。此外,MAG688富集了ACSS等乙酸代谢酶,而MAG240则未富集此类酶(图5F)。
健康奶牛和酮病奶牛的肝脏转录组结果分析
肝脏转录组学的主成分分析显示,健康组与患病组之间存在明显分离(图6A)。共鉴定出905个显著上调基因和820个显著下调基因(患病组/健康组)(图6B)。KEGG富集分析显示,PI3K-AKT信号通路、谷胱甘肽代谢、丙酸代谢、丙酮酸代谢及PPAR信号通路等通路显著富集(图6C)。对肝脏碳水化合物和脂代谢信号通路的深入分析表明,健康组奶牛肝脏中包括FABP1、PPARA、FADS2、ACOX3、AMPK、PI3KCA和G6PC3在内的关键基因表达上调;而患酮病奶牛肝脏中包括LPL、CD36、PPARD、APOA1、ACSL1、CPT1B、PC、FOXO3、CCND1和BCL2L11在内的关键基因表达上调(图6D)。此外,粪便中乙酸与丙酸水平与肝脏关键差异基因的表达以及血液β-羟基丁酸浓度之间存在强相关性(图6E)。
研究结论
这项大规模队列研究揭示了奶牛粪便微生物群与产后能量代谢障碍之间存在密切关系。在健康奶牛中,粪便内高丰度的Faecousia物种(sp017465625和sp017380435)以及低丰度的Methanosphaerasp016282985和Bifidobacteriumglobosum与乙酸产量增加相关。乙酸进入肝脏后,可调控AMPK-PPARA信号轴中的关键基因,进而影响肝脏健康及糖脂代谢,从而减少BHB的生成。基于这些发现,针对促进乙酸产生的关键肠道微生物制定策略,并为缓解反刍动物产后能量代谢障碍提供有价值的见解。